
- •Термохімія. Закон Гесса та його застосування
- •2 Основні поняття хімічної термодинаміки. Внутрішня енергія ентальпія 1 закон термодинаміки..
- •3. Ентропія. Змінаентропії у фізичних та хімічних процесах. Іі закон термодинаміки.
- •4. Зміна ізобарного та ізохорного потенціалів в результаті перебігу хімічних процесів.
- •6) Молекулярність та порядок хімічної реакції.
- •7 . Залежність швидкості хімічної реакції від температури
- •8. Енергія активації. Каталіз
- •9. Хімічна рівновага в гомогенних та гетерогенних процесах . Зміщення хімічної рівноваги . Принцип Ле Шательє.
- •11 . Розчини. Закони Рауля
- •12) Осмотичний тиск розчинів. Зворотній осмос.
- •13. Класифікація поверхневих явищ. Поверхнева енергія і поверхневий натяг. Адсорбція.
- •14. Класифікація дисперсних систем
- •16) Міцелярна будова колоїдних розчинів.
- •17. Золі, драглі, тиксотропія.
- •Коагуляція
- •18. Коагуляція. Поріг коагуляції
- •19. Силіцій в природі . Властивості сполук силіцію .
- •23.Діаграми стану двокомпонентної системи з хімічною сполукою, що плавиться конгруентно
- •24. Діаграма стану двокомпонентної системи з хімічною сполукою, що плавиться інконгруентно
7 . Залежність швидкості хімічної реакції від температури
Не кожне зіткення частинок реагуючих речовин може спричинити хімічну взаємодію. Внаслідок перерозподілу енергії частина молекул в системі завжди має певний надлишок енергії порівняно з середньою енергією молекул. Такі реакційно-здатні молекули називають активними молекулами. Різниця між середньою енергією системи і енергією, необхідною для перебігу реакції називають енергією активації реакції.
Наявність енергетичного бар єру призвана для того, що багато реакцій перебіг яких цілком можливий самовільно не починається. Наприклад, деревина здатна самозайматись на повітрі, але за звичайних умов не займається.
Ван-Гофф встановив, що при підвищенні температури в системі на 10оС швидк хім реакції збільшиться у 2-4 рази.
Правило Вант-Гоффа
![]()
Δt=t2-t1 γ-температурний кф швидкості реакції.
8. Енергія активації. Каталіз
ЕНЕРГІЯ АКТИВАЦІЇ, найменша кількість енергії, необхідне для початку хімічної реакції. У міру того, як у ході реакції хімічні зв’язки розриваються або формуються, енергія системи збільшується в порівнянні з енергією вихідних речовин, досягає максимуму, а потім зменшується до рівня енергії кінцевих продуктів. Різниця між енергією вихідних речовин і згаданим максимумом й являє собою енергію активації. Ця енергія часто передається суміші реагентів шляхом нагрівання, хоча деякі хімічні реакції починаються спонтанно відразу після з’єднання реагентів.
У більшості випадків для розрахунку енергії активації Е а за експериментальними даними використовують інтегральну форму рівняння Вант-Гоффа-Арреніуса (6) або його запис у вигляді:
lgK = lgKo - Е а / 2,303 RT (9)
Отже, lgK лінійно залежить від зворотного абсолютної температури (див. малюнок)
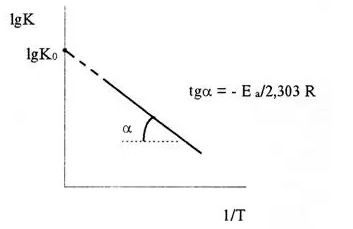
Значення Е а знаходять по тангенсу кута нахилу прямої, що проходить через експериментальні точки: Е а = -2,303 Rtgα.
Предекспоненціальний множник К 0 визначається відрізком, що відсікаються продовженням прямої на осі ординат при 1 / Т = 0.
Якщо є значення константи швидкості хімічної реакції при двох температурах, то з рівняння (9) можна отримати:
Е а = (2,303 RT 1 T 2 lgK 2 / K 1) / (T 2-T 1) (10)
Енергія активації Е а має розмірність енергія / моль і вимірюється в одиницях Дж / моль. Розмірність К 0 збігається з розмірністю константи швидкості. Теорія та експериментальні дані (для широкого температурного інтервалу) показують, що Е а і К залежать від температури. Проте цю залежність можна не враховувати, якщо реакції досліджуються в досить вузькому температурному інтервалі.
КАТАЛіЗ -- процес, що полягає у зміні швидкості хімічних реакцій у присутності речовин, які називаються каталізаторами.
Каталізатори -- речовини, що змінюють швидкість хімічної реакції, які можуть брати участь в реакції, входити до складу проміжних продуктів, але не входять до складу кінцевих продуктів реакції і після закінчення реакції залишаються незмінними.
Каталітичні реакції - реакції, що протікають в присутності каталізаторів.
Позитивним називають каталіз, при якому скоость реакції зростає, негативним (інгібуванням) - при якому вона зменшується. Прикладом позитивного каталізу може служити процес окислення аміаку на платині при отриманні азотної кислоти. Прикладом негативного - зниження швидкості корозії при введенні в рідина, в якій експлуатується метал, нітриту натрію, хромату і діхромата калію.
Каталізатори, сповільнюють хімічну реакцію, називаються інгібіторами.
Залежно від того, знаходиться каталізатор в тій же фазі, що і реагують речовини, або утворює самостійну фазу, говорять про гомогенному або гетерогенному каталізі.
Прикладом гомогенного каталізу є розкладання пероксиду водню в присутності іонів йоду.
