
- •Основные положения теории химического
- •Углеводороды. Классификация.
- •3.Реакции полимеризации
- •1.Реакции присоединения:
- •2.Реакции окисления
- •Реакции полимеризации и сополимеризации олефинов. Натуральный и синтетический каучукипонятие о высокомолекулярных соединениях.
- •1.Реакции замещения
- •2.Реакции присоединения
- •3.Реакции окисления
- •1. Замещение атомов водорода гидроксильных групп
- •2. Замещение гидроксильных групп
- •1.Реакции с участием гидроксильной группы
- •2.Реакции с участием бензольного кольца
- •2.Реакции окисления
- •2.Образование солей:
- •Непредельные одноосновные кислоты. Понятие о двухосновных кислотах и кислотах с несколькими двойными связями.
- •Важнейшие представители: муравьиная, уксусная, капроновая, энантовая, акриловая, щавелевая, олеиновая, стеариновая, сорбиновая кислоты. Реакция поликонденсации.
- •Жиры и масла. Получение, гидролиз и гидрогенизация жиров. Саломас, маргарин.
- •Карбоновые кислоты ароматического ряда. Бензойная кислота. Фталевые кислоты. Понятие об окси-кислотах (молочная, лимонная, винная кислоты).
- •Амины. Классификация, изомерия, номенклатура, получение. Физические и химические свойства (основность, алкилирование, ацилирование, действие азотистой кислоты). Понятие о диаминах.
- •2. Взаимодействие внутри молекулы — образование внутренних солей:
- •3. Взаимодействие аминокислот друг с другом — образование пептидов.
- •3. Цветные (качественные) реакции на белки:
2.Реакции окисления
В молекулах альдегидов атом углерода карбонильной группы, имеющий избыточный положительный заряд, притягивает к себе электроны связи С—Н. Вследствие этого атом водорода приобретает большую реакционную активность, что проявляется в способности альдегидов к окислению. Альдегиды легко окисляются до карбоновых кислот с тем же числом углеродных атомов различными окислителями (сильные окислители: 02 воздуха, подкисленный раствор К2Сг207 или КМn04; слабые окислители: аммиачный раствор оксида серебра (I), щелочной раствор сульфата меди (II) и др.). Реакции с аммиачным раствором оксида серебра (I) и щелочным раствором сульфата меди (II) являются качественными реакциями на альдегиды.
3.Реакции полимеризации (характерны для низших альдегидов)
—Линейная полимеризация
—Циклическая полимеризация (тримеризация, тетрамеризация)
4.Реакции поликонденсацин — это процессы образования высокомолекулярных веществ, в ходе которых соединение исходных мономерных молекул сопровождается выделением таких низкомолекулярных продуктов, как Н20, HCI, NH3 и т. д.
Формальдегид — муравьиный альдегид, CH2O, первый член гомологического ряда алифатических альдегидов; бесцветный газ с резким запахом, хорошо растворимый в воде и спирте, tкип = 19 °С. В промышленности Ф. получают окислением метилового спирта или метана кислородом воздуха. Ф. легко полимеризуется (особенно при температурах до 100 °С), поэтому его хранят, транспортируют и используют главным образом в виде формалина и твёрдых низкомолекулярных полимеров – триоксана и параформа.
Ацетальдегид (уксусный альдегид, этаналь, метилформальдегид) — органическое соединение класса альдегидов с химической формулой CH3-CHO. Это один из наиболее важных альдегидов, широко встречающийся в природе и производящийся в больших количествах индустриально. Ацетальдегид встречается в кофе, в спелых фруктах, хлебе, и синтезируется растениями, как результат их метаболизма. Также производится окислением этанола.
Ацетон (диметилкетон, систематическое наименование: пропан-2-он) — простейший представитель кетонов. Формула: CH3-C(O)-CH3. Бесцветная легкоподвижная летучая жидкость с характерным запахом. Полностью смешивается с водой и большинством органических растворителей. Ацетон хорошо растворяет многие органические вещества (ацетилцеллюлозу и нитроцеллюлозу, воск, резину и др.), а также ряд солей (хлорид кальция, иодид калия). Является одним из метаболитов, производимых человеческим организмом.
Бензойный альдегид (бензальдегид) C6H5CHO — простейший альдегид ароматического ряда, бесцветная жидкость с характерным запахом горького миндаля, желтеющая при хранении и окисляющаяся кислородом воздуха до перекиси бензоила (взрывоопасна), в дальнейшем превращающейся в бензойную кислоту.
Ароматические альдегиды — это ароматические УВ, содержащие альдегидную группу, связанную с углеводородным радикалом.
Непредельные альдегиды, содержащие в радикалах двойные и тройные связи.
Классификация карбоновых кислот. Предельные одноосновные кислоты. Гомологический ряд. Изомерия. Номенклатура. Ацильные радикалы. Физические и химические свойства. Высшие жирные кислоты. Мыла.
КАРБОНОВЫЕ КИСЛОТЫ — это производные УВ, содержащие функциональную карбоксильную группу —СООН.

где т — число карбоксильных групп, определяющее основность кислоты.
По основностикислоты делятся на:
—одноосновные (монокарбоновые), m=1;
—двухосновные (дикарбоновые),m=2;
—трехосновные (трикарбоновые),m=3 и т. д.
В зависимости от строения углеводородного радикалаR карбоновые кислоты делятся на:
—предельные (насыщенные), R = алкил;
—непредельные (ненасыщенные) — производные непредельных УВ;
—ароматические — производные ароматических УВ.
Гомологический ряд
Номенклатура и изомерия
По международной заместительной номенклатуре название кислоты производят от названия соответствующего (с тем же числом атомов углерода) углеводорода с добавлением окончания -овая и слова кислота. Нумерацию цепи всегда начинают с атома углерода карбоксильной группы, поэтому в названиях положение группы —СООН не указывают.
При составлении названий кислот, имеющих сложное строение, иногда также используют тривиальные названия кислот, соответствующие наиболее длинной прямой цепи. В этом случае атомы углерода в прямой цепи обозначают греческими буквами, начиная с атома углерода, соседнего с карбоксильной группой: α (альфа), β(бета), γ (гамма) и т. д.
Например,
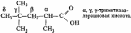
Внутри класса предельных монокарбоновых кислот возможна только изомерия углеродной цепи. Первые три члена гомологического ряда (НСООН, СН3СООН, С2Н5СООН) изомеров не имеют. Монокарбоновые кислоты изомерны сложным эфирам карбоновых кислот.
Ацильные радикалы, генерируемые из альдегидов, легко фрагментируют при температуре выше 100°С на алкильные радикалы и СО.
Физические свойства


Химические свойства
Для насыщенных монокарбоновых кислот характерна высокая реакционная способность. Это определяется главным образом реакциями карбоксильной группы (разрыв связей О—Н и С—О), а также реакциями замещения атомов «Н» у α-утлеродного атома.
1.Реакции с разрывом связи О—Н (кислотные свойства, обусловленные подвижностью атома водорода карбоксильной группы). Предельные монокарбоновые кислоты обладают всеми свойствами обычных кислот.
—Диссоциация. В водных растворах монокарбоновые кислоты ведут себя как одноосновные кислоты: происходит их ионизация с образованием иона водорода и карбоксилат-иона.
Карбоновые кислоты являются слабыми кислотами. Наиболее сильной в гомологическом ряду насыщенных кислот является муравьиная кислота, в которой группа —СООН связана с атомом водорода.
