
- •Содержание
- •2. Оптические методы анализа
- •О птическая схема спектрофотометра икс-40
- •2.3. Фотометрические методы анализа.
- •Оптическая схема кфк-2
- •8, 14.Светофильтр
- •8, 14.Светофильтр
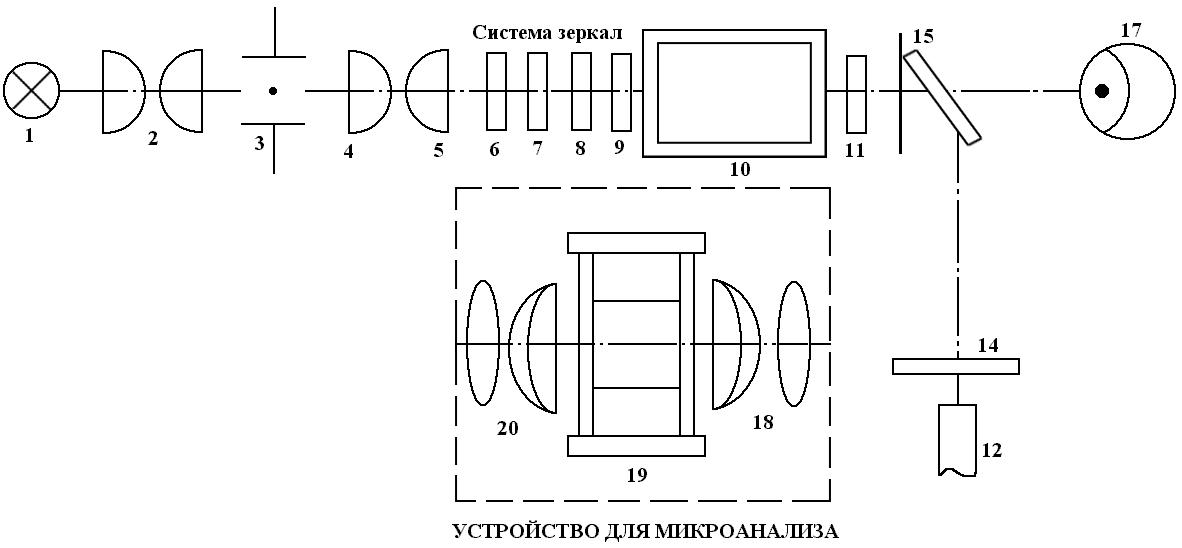
- •О птическая схема кфк-3
- •Светофильтр.
- •Дифракционная решётка.
- •Фотоэлектрокалориметр фэк-56м ( оптическая схема)
- •3. Электрохимические методы анализа.
- •С хема полярографической установки
- •Хроматографический метод анализа
- •Задания
- •1. Железо
- •Нитраты
- •Фосфаты
Оптическая схема кфк-2
Нить лампы накаливания.
Конденсатор.
Диафрагма.
4, 5. Объектив
9-11 Стёкла
7.Нейтральные.
8, 14.Светофильтр
12.Фотодиод.
8, 14.Светофильтр
18, 20.Линзы
19. Кювета
КФК-3, прибор, оснащённый микропроцессором и программным обеспечением рабочий диапазон 315-990 нм, прибор полностью автоматизирован.
Микропроцессорная схема выполняет 7 задач:
0 – измерение и учёт сигнала при неосвещённом фотоэлементе.
Г – градуировочный график.
П – коэффициент измеренного пропускания.
Е – измерение оптической области.
С – измерение концентрации измеряемого вещества.
А – измерение скорости изменения оптической плотности
F – ввод коэффициента погрешности измерения.
От источника света 1 (нить накаливания) через конденсатор 2, и светофильтр 3, световой поток попадает на дифракционную решётку 4, затем попадая на зеркала 5, 6, световой поток проходит объектив 7-8 через кювету 9, и линзу 10 поступает или на фотоэлемент, или фотопотоки.
О птическая схема кфк-3
Нить лампы.
Конденсатор.
Светофильтр.
Дифракционная решётка.
5, 6. Зеркало.
7, 8. Объектив.
9. Кювета.
10. Линза.
11.Приемник.
ФЭК-56М двухлучевой фотоэлектроколориметр имеющий канал исследования и канал сравнения рабочий диапазон 315-630нм.
Световой поток проходит через светофильтры и делится на 2 потока: I канал сравнения, проходит через кюветы с исследуемым веществом; II канал исследуемых веществ проходит через светофильтр сквозь линзу 8. и поступает на фотоэлемент 9. В приборе находится система зеркал направляющая световой поток на фотоэлемент.
Фотоэлектрокалориметр фэк-56м ( оптическая схема)
3. Электрохимические методы анализа.
Ряд важных аналитических методов основан на электрохимических свойствах раствора. Если взять раствор электролита в стеклянный сосуд и опустить в 2-3 м, то мы получим электрохимическую ячейку. Если такую ячейку присоединить к внешнему источнику напряжения несколько вольт, но эта же электрохимическая ячейка может сама по себе действовать как источник электроэнергии и подавать ток во внешнюю цепь.
В основе всех электрохимических методов лежат процессы окислительно-восстановительных реакции. Если через электрохимическую ячейку пропустить постоянный ток, то в ней протекает окислительно-восстановительные реакции. На аноде происходит процесс окисления, а на катоде происходит процесс восстановления. Главное назначение внешней цепи быть проводником электрона от анода к катоду. Электрическая цепь замыкается за счёт ионной проводимости раствора. Для электрохимической реакции свободная энергия связана с электрическими величинами и выражается.
ΔG= n·F·E
Энергия ячейки состоит из потенциала элемента или потенциала полу реакции.
Полу реакция - реакция изменения степень окисления химического элемента. Потенциал ячейки измерить легко, но потенциал электрода невозможно, поэтому возникла необходимость выбора конкретного электрода на шкале потенциала которого имеет нулевое значение поэтому был выбран стандартный водородный электрон.
