- •Предмет, содержание и задачи «Неорганической химии»
- •Химия как наука естествознания. Основная проблема химии и общие способы её решения.
- •Химия и переработка продуктов общественного питания.
- •Основные химические законы. Химический эквивалент. Закон эквивалентов. Определение молярных масс газов.
- •5.Уровни структурной организации материи. Двойственная природа микрочастиц (принципы и постулаты квантовой механики)
- •6.Характеристика состояния электрона в атоме. Правила и порядок заполнения атомных орбиталей.
- •7.Периодическая система химических элементов им. Д. И. Менделеева.
- •8.Целостные свойства атомов - масса, размер, устойчивость, их изменение по периодам и группам.
- •9.Природа и образование химической связи: метод молекулярных орбиталей (ммо). Энергия и длина связи.
- •10.Природа и образование химической связи: метод валентных связей (мвс). Ковалентная связь. Свойства ковалентной связи. Неполярная и полярная ковалентная связь.
- •12.Ионная связь. Свойства ионной связи. Свойства веществ с ионным типом связи.
- •13.Межмолекулярные взаимодействия: электростатическая, донорно-акцепторная, водородная связь и их влияние на свойства веществ.
- •14.Строение вещества в конденсированном состоянии. Зависимость физических свойств от типа химической связи в молекулах, между молекулами и ионами.
- •15.Комплексные соединения: состав, номенклатура и классификация. Применение и значение комплексных соединений.
- •16.Теории химической связи в комплексных соединениях: мвс, ммо и теория кристаллического поля (ткп).
- •18.Растворы и их классификация. Способы выражения состава растворов. Идеальные и неидеальные растворы.
- •19.Растворы электролитов. Слабые и сильные электролиты. Ионные реакции в растворах электролитов.
- •20.Электролитическая диссоциация воды. Ионное произведение воды. Водородный показатель. Значение pH в производстве пищевых продуктов и непродовольственных товаров.
- •21.Гидролиз солей. Типичные случаи гидролиза солей.
- •22.Буферные растворы. Значение буферных растворов в природе и технике.
- •23.Понятие термодинамической системы. Функции состояния. Тепловой эффект химических процессов и изменение энтальпии.
- •24.Понятие об энтропии. Направленность химических процессов.
- •25.Скорость химических реакций: общие понятия, закон действующих масс, правило Вант-Гоффа и уранение Аррениуса.
- •26.Химическое равновесие, принцип Ле Шателье.
- •29.Свойства неметаллов и их соединений. Электронная структура неметаллов. Сродство к электрону. Электроотрицательность. Изменение свойств неметаллов по периодам и группам.
- •33.Химические свойства металлов. Сравнительная активность металлов. Коррозия металлов. Влияние различных факторов на скорость коррозии. Методы борьбы с коррозией.
- •34.Металлы и их соединения в производстве продуктов общественного питания. Макро и микроэлементы. Ксенобиотики.
- •Предмет, содержание и задачи «Неорганической химии»
- •2.Химия как наука естествознания. Основная проблема химии и общие способы её решения.
- •3.Химия и переработка продуктов общественного питания.
9.Природа и образование химической связи: метод молекулярных орбиталей (ммо). Энергия и длина связи.
Метод молекулярных орбиталей исходит из того, что каждую молекулярную орбиталь представляют в виде алгебраической суммы (линейной комбинации) атомных орбиталей. Например, в молекуле водорода в образовании МО могут участвовать только 1s атомные орбитали двух атомов водорода, которые дают две МО, представляющие собой сумму и разность атомных орбиталей 1s1 и 1s2 – МО± = C11s1 ±C21s2. МОЛЕКУЛЯ́РНЫХ ОРБИТА́ЛЕЙ МЕ́ТОД, квантовохимический расчетный метод, основанный на представлении о том, что каждый электрон молекулы описывается своей волновой функцией (молекулярной орбиталью, МО). На практике каждую молекулярную орбиталь часто представляют как линейную комбинацию атомных орбиталей (приближение ЛКАО). Волновая функция молекулы, построенная из молекулярной орбитали тем или иным способом, далее уточняется, напр. вариационным методом. Такой подход позволяет приближенно определить энергетические состояния молекулы, объяснить многие ее свойства и структуру.
Энергия связи (для данного состояния системы) — разность между полной энергией связанного состояния системы тел или частиц и энергией состояния, в котором эти тела или частицы бесконечно удалены друг от друга и находятся в состоянии покоя:
![]()
где
![]() — энергия связи компонентов в системе
из i компонент (частиц),
— энергия связи компонентов в системе
из i компонент (частиц),
![]() —
полная энергия i-го компонента в
несвязаннном состоянии (бесконечно
удалённой покоящейся частицы) и
—
полная энергия i-го компонента в
несвязаннном состоянии (бесконечно
удалённой покоящейся частицы) и
![]() — полная энергия связанной системы.
— полная энергия связанной системы.
Длина связи – это расстояние между ядрами связанных атомов. Чем меньше длина связи и больше энергия связи, тем связь прочнее. Энергия связи тем больше, чем меньше длина связи.
10.Природа и образование химической связи: метод валентных связей (мвс). Ковалентная связь. Свойства ковалентной связи. Неполярная и полярная ковалентная связь.
11.Метод валентных связей (МВС) иначе называют теорией локализованных электронных пар, поскольку в основе метода лежит предположение, что химическая связь между двумя атомами осуществляется с помощью одной или нескольких электронных пар, которые локализованы преимущественно между ними. В отличие от ММО, в котором простейшая химическая связь может быть как двух-, так и многоцентровой, в МВС она всегда двухэлектронная и обязательно двухцентровая. Число элементарных химических связей, которые способен образовывать атом или ион, равно его валентности. Так же, как и в ММО, в образовании химической связи принимают участие валентные электроны. Волновая функция, описывающая состояние электронов, образующих связь, называется локализованной орбиталью (ЛО).
Отметим, что электроны, описываемые ЛО, в соответствии с принципом Паули должны иметь противоположно направленные спины, то есть в МВС все спины спарены, и все молекулы должны быть диамагнитны. Следовательно, МВС принципиально не может объяснить магнитные свойства молекул.
Тем не менее, принцип локализованных связей имеет ряд важных преимуществ, одно из которых – его чрезвычайная наглядность. МВС достаточно хорошо, например, предсказывает валентные возможности атомов и геометрию образующейся молекулы. Последнее обстоятельство связано с так называемой гибридизацией АО. Она была введена для объяснения того факта, что двухэлектронные двухцентровые химические связи, образованные за счет АО в разных энергетических состояниях, имеют одинаковую энергию. Так, Be*(2s11p1), B*(2s12p2), C*(2s12p3) образуют за счет s- и p-орбиталей соответственно две, три и четыре связи, а потому одна из них должна быть прочнее других. Однако опыт показывает, что в BeH2, BCl3, CH4 все связи равноценны. У BeH2 угол связи равен 180°, у BCl3 – 120°, а у CH4 – 109°28'.
Ковалентная связь (атомная связь, гомеополярная связь) — химическая связь, образованная перекрытием (обобществлением) пары валентных электронных облаков. Обеспечивающие связь электронные облака (электроны) называются общей электронной парой.
Характерные свойства ковалентной связи — направленность, насыщаемость, полярность, поляризуемость — определяют химические и физические свойства соединений. Направленность связи обусловлена молекулярным строением вещества и геометрической формы их молекулы. Углы между двумя связями называют валентными.
Насыщаемость — способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей.
Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов. По этому признаку ковалентные связи подразделяются на неполярные и полярные.
Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Полярность и поляризуемость ковалентных связей определяет реакционную способность молекул по отношению к полярным реагентам.
Неполярная ковалентная связь – это связь, при которой общая электронная пара принадлежит обоим атомам одинаково, т.е. отсутствует смещение электронной плотности к одному из атомов.
H — H, F — F, Cl — Cl, O = O, N ≡ N и т.п.
Связи между одинаковыми атомами, имеющими различное окружение, к неполярным не относятся.
Например: H3C—CH=O (ацетальдегид), H3C—COOH (уксусная кислота)
(дипольные моменты связей C—C 2,7 D и 1,7 D, соответственно).
Полярная (несимметричная) ковалентная связь – связь между атомами с различной электроотрицательностью (2 > Δχ > 0,5) и несимметричным распределением общей электронной пары.
Электронная плотность такой связи смещена в сторону более электроотрицательного атома, что приводит к появлению на нем частичного отрицательного заряда δ– (дельта минус), а на менее электроотрицательном атоме – частичного положительного заряда δ+ (дельта плюс):
Cδ+— Clδ–, Cδ+— Oδ–, Cδ+— Nδ–, Oδ–— Hδ+, Cδ–— Mgδ+
Направление смещения электронов обозначается также стрелкой:
C → Cl, C → О, C → N, О ← Н, C ← Mg
Чем больше различие в электроотрицательности связываемых атомов, тем выше полярность связи и больше ее дипольный момент. Между противоположными по знаку частичными зарядами действуют дополнительные силы притяжения, увеличивая прочность связи.
Полярность связей влияет на химические и физические свойства соединений. От полярности связи зависит механизм реакции и даже реакционная способность соседних связей. Полярность связей может привести к полярности молекул и, таким образом, повлиять на физические свойства вещества (температуры плавления и кипения, растворимость).
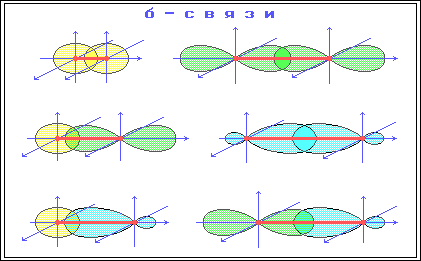
σ-Связь – ковалентная связь, образованная при перекрывании s-, p- и гибридных АО вдоль оси, соединяющей ядра связываемых атомов (т.е. при осевом перекрывании АО).
π-Связь – ковалентная связь, возникающая при боковом перекрывании негибридных р-АО. Такое перекрывание происходит вне прямой, соединяющей ядра атомов.