
- •Предмет, содержание и задачи «Неорганической химии»
- •Химия как наука естествознания. Основная проблема химии и общие способы её решения.
- •Химия и переработка продуктов общественного питания.
- •Основные химические законы. Химический эквивалент. Закон эквивалентов. Определение молярных масс газов.
- •5.Уровни структурной организации материи. Двойственная природа микрочастиц (принципы и постулаты квантовой механики)
- •6.Характеристика состояния электрона в атоме. Правила и порядок заполнения атомных орбиталей.
- •7.Периодическая система химических элементов им. Д. И. Менделеева.
- •8.Целостные свойства атомов - масса, размер, устойчивость, их изменение по периодам и группам.
- •9.Природа и образование химической связи: метод молекулярных орбиталей (ммо). Энергия и длина связи.
- •10.Природа и образование химической связи: метод валентных связей (мвс). Ковалентная связь. Свойства ковалентной связи. Неполярная и полярная ковалентная связь.
- •12.Ионная связь. Свойства ионной связи. Свойства веществ с ионным типом связи.
- •13.Межмолекулярные взаимодействия: электростатическая, донорно-акцепторная, водородная связь и их влияние на свойства веществ.
- •14.Строение вещества в конденсированном состоянии. Зависимость физических свойств от типа химической связи в молекулах, между молекулами и ионами.
- •15.Комплексные соединения: состав, номенклатура и классификация. Применение и значение комплексных соединений.
- •16.Теории химической связи в комплексных соединениях: мвс, ммо и теория кристаллического поля (ткп).
- •18.Растворы и их классификация. Способы выражения состава растворов. Идеальные и неидеальные растворы.
- •19.Растворы электролитов. Слабые и сильные электролиты. Ионные реакции в растворах электролитов.
- •20.Электролитическая диссоциация воды. Ионное произведение воды. Водородный показатель. Значение pH в производстве пищевых продуктов и непродовольственных товаров.
- •21.Гидролиз солей. Типичные случаи гидролиза солей.
- •22.Буферные растворы. Значение буферных растворов в природе и технике.
- •23.Понятие термодинамической системы. Функции состояния. Тепловой эффект химических процессов и изменение энтальпии.
- •24.Понятие об энтропии. Направленность химических процессов.
- •25.Скорость химических реакций: общие понятия, закон действующих масс, правило Вант-Гоффа и уранение Аррениуса.
- •26.Химическое равновесие, принцип Ле Шателье.
- •29.Свойства неметаллов и их соединений. Электронная структура неметаллов. Сродство к электрону. Электроотрицательность. Изменение свойств неметаллов по периодам и группам.
- •33.Химические свойства металлов. Сравнительная активность металлов. Коррозия металлов. Влияние различных факторов на скорость коррозии. Методы борьбы с коррозией.
- •34.Металлы и их соединения в производстве продуктов общественного питания. Макро и микроэлементы. Ксенобиотики.
- •Предмет, содержание и задачи «Неорганической химии»
- •2.Химия как наука естествознания. Основная проблема химии и общие способы её решения.
- •3.Химия и переработка продуктов общественного питания.
26.Химическое равновесие, принцип Ле Шателье.
Химическое равновесие — состояние химической системы, в котором обратимо протекает одна или несколько химических реакций, причём скорости в каждой паре прямая-обратная реакция равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем.
Принцип Ле Шателье — Брауна
Положение химического равновесия зависит от следующих параметров реакции: температуры, давления и концентрации. Влияние, которое оказывают эти факторы на химическую реакцию, подчиняются закономерности, которая была высказана в общем виде в 1885 году французским ученым Ле-Шателье.
Факторы влияющие на химическое равновесие:
1) температура
При увеличении температуры химическое равновесие смещается в сторону эндотермической (поглощение) реакции, а при понижении в сторону экзотермической (выделение) реакции.
CaCO3=CaO+CO2 -Q t↑ →, t↓ ←
N2+3H2↔2NH3 +Q t↑ ←, t↓ →
2) давление
При увеличении давления химическое равновесие смещается в сторону меньшего объёма веществ, а при понижении в сторону большего объёма. Этот принцип действует только на газы, т.е. если в реакции участвуют твердые вещества, то они в расчет не берутся.
CaCO3=CaO+CO2 P↑ ←, P↓ →
1моль=0моль+1моль
3) концентрация исходных веществ и продуктов реакции
При увеличении концентрации одного из исходных веществ химическое равновесие смещается в сторону продуктов реакции, а при увеличении концентрации продуктов реакции-в сторону исходных веществ.
S2+2O2=2SO2 [S],[O]↑ →, [SO2]↑ ←
Катализаторы не влияют на смещение химического равновесия!
27.Окислительно-восстановительные реакции и их классификация. Важнейшие окислители и восстановители. Составление уравнения окислительно-восстановительных реакций. Роль окислительно-восстановительных процессов в природе и в промышленности, их влияние на изменение свойств товаров народного потребления.
Окисли́тельно-восстанови́тельные реа́кции (ОВР) — это встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем.
Окисление - процесс отдачи электронов, с увеличением степени окисления.
При окисле́нии вещества в результате отдачи электронов увеличивается его степень окисления. Атомы окисляемого вещества, называются донорами электронов, а атомы окислителя — акцепторами электронов.
Восстановле́нием называется процесс присоединения электронов атомом вещества, при этом его степень окисления понижается.
При восстановлении атомы или ионы присоединяют электроны. При этом происходит понижение степени окисления элемента.
Виды окислительно-восстановительных реакций
Межмолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах разных веществ, например:
Н2S + Cl2 → S + 2HCl
Внутримолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах одного и того же вещества, например:
2H2O → 2H2 + O2
Диспропорционирование (самоокисление-самовосстановление) — реакции, в которых атомы с промежуточной степенью окисления превращаются в эквимолярную смесь атомов с более высокой и более низкой степенями окисления, например:
Cl2 + H2O → HClO + HCl
Репропорционирование (компропорционирование) — реакции, в которых из двух различных степеней окисления одного и того же элемента получается одна степень окисления, например:
NH4NO3 → N2O + 2H2O
Пример:
![]()
Разделяется на две полуреакции:
Окисление:
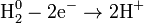
Восстановление:
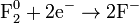
Важнейшие окислители и восстановители.
Пределы окисления и восстановления элемента выражаются максимальным и минимальным значениями степеней окисления *. В этих крайних состояниях, определяемых положением в таблице Менделеева, элемент имеет возможность проявить только одну функцию – окислителя или восстановителя. Соответственно и вещества, содержащие элементы в этих степенях окисления, являются только окислителями (HNO3, H2SO4, HClO4, KMnO4, K2Cr2O7 и др.) или только восстановителями (NH3, H2S, галогеноводороды, Na2S2O3 и др.). Вещества, содержащие элементы в промежуточных степенях окисления, могут быть как окислителями, так и восстановителями (HClO, H2O2, H2SO3 и др.).
СОСТАВЛЕНИЕ УРАВНЕНИЙ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ.
Существуют два метода составления окислительно - восстановительных реакций - метод электронного баланса и метод полуреакций. Здесь мы рассмотрим метод электронного баланса.
В этом методе сравнивают степени окисления атомов в исходных веществах и в продуктах реакции, приэтом руководствуемся правилом: число электронов, отданных восстановителем, должно равняться числу электронов, присоединённых окислителем.
Для составления уравнения надо знать формулы реагирующих веществ и продуктов реакции. Рассмотрим этот метод на примере.Расставить коэффициенты в реакции, схема которой:
HCl + MnO2 Cl2 + MnCl2 + H2O
Алгоритм расстановки коэффициентов
1.Указываем степени окисления химических элементов.
![]()
Подчёркнуты химические элементы, в которых изменились степени окисления.
2.Составляем электронные уравнения, в которых указываем число отданных и принятых электронов.
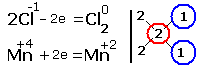
![]()
Роль окислительно-восстановительных процессов в природе и в промышленности, их влияние на изменение свойств товаров народного потребления.
Мы питаемся – идет реакция окисления и др. реакции. А так же при хранении и эксплуатации продуктов.
28.Гетерогенные окислительно-восстановительные процессы. Механизм возникновения двойного электрического слоя. Электродные потенциалы металлов и их зависимость от различных факторов. Уравнение Нернста. Стандартные электродные потенциалы. Гальванические элементы.
ГЕТЕРОГЕННЫЕ РЕАКЦИИ, хим. р-ции с участием в-в, находящихся в разл. фазах и составляющих в совокупности гетерог. систему. Типичные гетерогенные реакции: термич. разложение солей с образованием газообразных и твердых продуктов (напр., СаСО3 -> СаО + СО2), восстановление ожсидов металлов водородом или углеродом (напр., РЬО + С -> Рb + СО), растворение металлов в к-тах (напр., Zn + + H2SO4 -> ZnSO4 + Н2), взаимод. твердых реагентов (А12О3 + NiO -> NiAl2O4). В особый класс выделяют гетерогенно-каталитич. р-ции, протекающие на пов-сти катализатора; при этом реагенты и продукты могут и не находиться в разных фазах. Напр., при р-ции N2 + + ЗН2 -> 2NH3, протекающей на пов-сти железного кат., реагенты и продукт р-ции находятся в газовой фазе и образуют гомог. систему.
ДВОЙНОЙ ЭЛЕКТРИЧЕСКИЙ СЛОЙ, тонкий поверхностный слой из пространственно разделенных электрич. зарядов противоположного знака, образующийся на границе двух фаз.
Существуют следующие способы создания двойного электрического слоя:
Ионизация поверхности – металлические поверхности теряют электроны и приобретают положительный заряд;
Избирательная адсорбция ионов. Поверхность адсорбирует ион, который наиболее близок ей по природе;
Адсорбция полярных молекул на поверхности по правилу Кёна – положительным зарядом обладает та фаза, которая имеет большую диэлектрическую проницаемость.
Состав двойного электрического слоя определяется равнозначными ионами, прочно связанными с дисперсной твердой фазой (как их еще называют – потенциалопределяющие ионы) и равным числом противоположно заряженных ионов, находящихся в жидкой среде возле межфазной поверхности (противоионы).
Электро́дный потенциа́л — разность электрических потенциалов между электродом и находящимся с ним в контакте электролитом (чаще всего между металлом и раствором электролита).
Возникновение электродного потенциала обусловлено переносом заряженных частиц через границу раздела фаз, специфической адсорбцией ионов, а при наличии полярных молекул (в том числе молекул растворителя) — ориентационной адсорбцией их. Величина электродного потенциала в неравновесном состоянии зависит как от природы и состава контактирующих фаз, так и от кинетических закономерностей электродных реакций на границе раздела фаз.
Уравнение Нернста — уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными потенциалами окислительно-восстановительных пар.
![]()
где - электродный потенциал, E0 - стандартный электродный потенциал, измеряется в вольтах;
— универсальная газовая постоянная, равная 8.31 Дж/(моль·K); — абсолютная температура;
— число Фарадея, равное 96485,35 Кл/моль; — число моль электронов, участвующих в процессе;
и
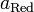 — активности соответственно окисленной
и восстановленной форм вещества,
участвующего в полуреакции.
— активности соответственно окисленной
и восстановленной форм вещества,
участвующего в полуреакции.
Стандартный электродный потенциал – это числовое значение электродного потенциала, измеренное в стандартных условиях относительно стандартного водородного электрода.
Электродный потенциал не может быть получен эмпирически. Потенциал гальванической ячейки вытекает из "пары" электродов. Таким образом, невозможно определить величину для каждого электрода в паре, используя эмпирически полученный потенциал гальванической ячейки. Для этого установлен стандартный водородный электрод, для которого этот потенциал точно определён и равен 0,00 В, и любой электрод, для которого электронный потенциал ещё неизвестен, может быть соотнесён со стандартным водородным электродом с образованием гальванической ячейки — и в этом случае потенциал гальванической ячейки даёт потенциал неизвестного электрода.
Так как электродные потенциалы традиционно определяют как восстановительные потенциалы, знак окисляющегося металлического электрода должен быть изменён на противоположный при подсчёте общего потенциала ячейки. Также нужно иметь в виду, что потенциалы не зависят от количества передаваемых электронов в полуреакциях (даже если оно различно), так как они рассчитаны на 1 моль переданных электронов. Отсюда при расчёте какого-либо электродного потенциала на основании двух других следует проявлять внимательность.
Например:
(ур-е 1) Fe3+ + 3e− --> Fe(тв) −0.036 В
(ур-е 2) Fe2+ + 2e− --> Fe(тв) −0.44 В
Для получения третьего уравнения:
(ур-е 3) Fe3+ + e− --> Fe2+ (+0.77 В)
следует умножить потенциал первого ур-я на 3, перевернуть ур-е 2 (поменять знак) и умножить его потенциал на 2. Сложение этих двух потенциалов даст стандартный потенциал ур-я 3.
ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ(электроды), единичные ячейки хим. источников тока, предназначенных для однократного электрич. разряда (непрерывного или прерывистого).
Рассмотрим реакцию:
Z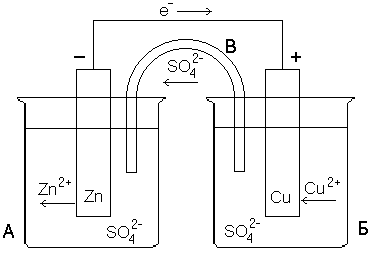 n
+ CuSO4 ® ZnSO4 + Cu
n
+ CuSO4 ® ZnSO4 + Cu
Сущность этой реакции вытеснения сводится к восстановлению одним металлом иона второго. Например, в ряду металлов Zn, Fe, Cu, Ag каждый предыдущий вытесняет последующий из его солей, тогда как обратное вытеснение не наблюдается.
Процесс взаимодействия цинка с ионом меди по приведенной выше схеме можно разбить на две полуреакции:
Zn – 2e ® Zn2+
Cu2+ + 2e ® Cu
Очевидно, что если бы удалось осуществить передачу электронов не непосредственно, а через металлический проводник, то по нему потек бы от цинка к меди поток электронов, т.е. электрический ток. На рисунке 6.1 показана схема гальванического элемента, т.е. установки, делающей возможной такую передачу электронов по проводу. В гальваническом элементе происходит непосредственное преобразование энергии химической реакции в электрическую энергию.
Сосуд А и соединяющая оба сосуда трубка В заполнены раствором ZnSO4, сосуд Б – раствором CuSO4. В первый из них опущена цинковая пластинка, во второй – медная. Если соединить обе пластинки проводом, то по нему в указанном стрелкой направлении начнут перемещаться электроны (потечет электрический ток). Трубка В обеспечивает замкнутость цепи, по ней перемещаются ионы SO42–. Электрод, на котором происходит процесс восстановления (на рисунке 6.1 – медный) называется катодом, а электрод, на котором осуществляется окисление (в рассмотренном примере – цинковый) – анодом.
