
- •12. Элементы органической
- •12.1. Введение
- •12.2. Особенности органических соединений
- •12.3. Тип химических связей и валентность углерода в органических соединениях
- •12.4. Основные положения теории
- •Химического строения органических
- •Соединений
- •А. М. Бутлерова
- •Изомерия положения функциональной группы:
- •III. В молекулах органических веществ атомы и группы атомов влияют друг на друга. Это взаимное влияние определяет свойства веществ.
- •12.5. Классификация органических
- •12.6. Номенклатура органических соединений
- •12.8. Углеводороды
- •12.8.1. Классификация углеводородов
- •12.8.2. Алканы (парафины) Определение, общая формула
- •Изомерия и номенклатура алканов
- •Химические свойства алканов
- •II. Реакции окисления
- •IV. Реакции крекинга алканов
- •V. Изомеризация
- •Получение алканов
- •Применение
- •12.8.2. Алкены (олефины, этиленовые ув) Определение, общая формула
- •I. Реакции присоединения
- •III. Реакции полимеризации
- •IV. Изомеризация.
- •V. Реакции замещения
- •Получение
- •Реакции присоединения
- •12.8.4. Алкины (ацетиленовые ув)
- •Изомерия и номенклатура
- •Химические свойства
- •II.Реакции окисления
- •III. Реакции полимеризации
- •IV. Реакции замещения атомов «н», связанных с sp-гибридизованными атомами углерода
Химические свойства алканов
Тривиальное (историческое) название алканов — «парафины» — означает «не имеющие сродства». Алканы химически малоактивны. Низкая реакционная способность алканов обусловлена очень малой полярностью связей С—С и С—Н в их молекулах вследствие почти одинаковой электроотрицательности атомов углерода и водорода.
Для алканов наиболее характерны реакции замещения. В этих реакциях происходит гомолитическое расщепление ковалентных связей, т. е. они осуществляются по свободнорадикальному (цепному) механизму.
I. Реакции замещения (разрыв связей С—Н)
RH + XY → RX + HY
алкан реагент производное
алкана
1) Галогенирование — замещение атомов водорода атомами галогенов.
Примером этого типа реакций является хлорирование метана:
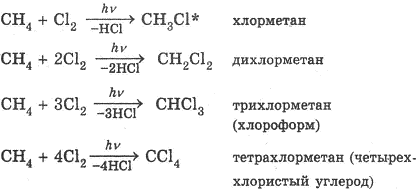
По своему механизму эти реакции представляют собой свободнорадикальные цепные реакции. Они начинаются стадией инициирования (зарождения цепи), в ходе которой под действием УФ-излучения (hν) происходит распад молекулы С12 на два свободных радикала:
![]()
Затем происходит рост цепи (имеется в виду цепь превращений):
![]()
Далее многократно повторяются превращения (2) и (3).
В случае столкновения двух радикалов может происходить обрыв цепи:

Cl• + •CH3 → CH3– Cl (6)
Высшие разветвленные алканы также подвергаются галогенированию. При этом атомы галогенов замещают, прежде всего, атомы водорода у третичных атомов углерода, затем — у вторичных и в последнюю очередь — у первичных. Это общее правило, справедливое и для других реакций замещения.
Алканы очень активно реагируют с фтором. Реакция идет со взрывом:
Kat.
СН4 + 4F2 → CF4 + 4HF
тетрафторметан
В действительности образуется смесь фторпроизводных.
2)Нитрование — замещение атомов водорода нитрогруппой -N02. Нитрующий агент — азотная кислота HN03 (HO-N02).
R–H + HO-N02 → R– H + H2O
Обычно нитрование алканов осуществляется разбавленной HN03 при температуре около 140°С. Этот способ нитрования был открыт русским химиком М. И. Коноваловым в 1888г. и вошел в органическую химию как «реакция Коновалова». Это первая из так называемых именных реакций, с которыми мы будем знакомиться при изучении органической химии. Пример нитрования:
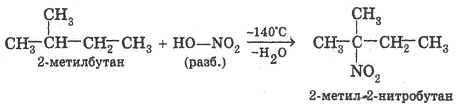
Общее название продуктов нитрования алканов — нитроалканы.
В основе названия нитро- или галогеналкана лежит название самой длинной неразветвленной цепи. Заместители перечисляют в алфавитном порядке. Атомы «С» нумеруют так, чтобы заместитель, который пишется первым, имел меньший номер.
СН3
1 2 3 4 4 3 2׀ 1
СН3–СН–СН2–СН3 СН3–СН–СН–СН3
׀ ׀
NO2 NO2
2-Нитробутан 2-Метил-З-нитробутан
5 4 3 2 1
СН3– СН– СН2– СН– СН3
׀ ׀
Cl СН3
2-Метил-4-хлорпентан
3. Сульфирование (замещение атома водорода cульфо-группой -S03H с образованием алкансульфокислот RS03H). Сульфирующий реагент — серная кислота H2S04 (HO-SO3H).
R–H + HO–SO3H → R–S03H + H2O
Сульфирование алканов происходит при действии очень концентрированной H2S04 при небольшом нагревании.
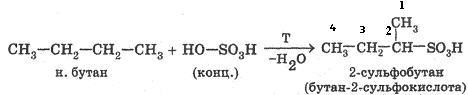
К названию соответствующего алкана нужно прибавить приставку «сульфо-» или окончание «сульфокислота» с указанием положения сульфогруппы:
1 CH3
3 2 1 4 3 2 ׀
CH3–CH2–CH2–S03H CH3–CH2–CH–S03H
1-Сульфопропан Бутан-2-сульфокислота
