
- •Екзаменаційний білет № 22
- •Значення білків у харчуванні людини. Пояснити зміни колоїдного стану білків муки, кріп, бобових при контакті з водою.
- •Разделка рыбы, используемой целиком.
- •Разделка рыбы, используемой непластованной.
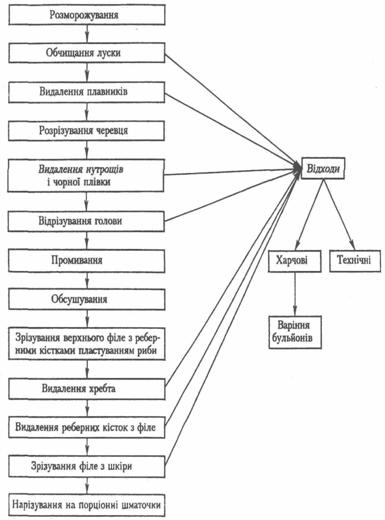
- •Разделка рыбы на филе с кожей и реберными костями.
- •Скільки порцій біфштексу масою 125 г можна нарізати з яловичини 1 категорії? Маса туші – 160 г.
- •Екзаменаційний білет № 24
- •Залежність якості харчових продуктів від властивостей білків. Колоїдний стан білків у харчових продуктах. Приклади з кулінарної практики.
- •Характеристика технологічного процесу приготування дрібнокускових н/ф з сільськогосподарської птиці, дичини, кролика. Вимоги до якості.
- •Визначити кількість відходів, які отримують при розбиранні 160 кг яловичини 1-ї і 2-ї категорії.
Разделка рыбы, используемой целиком.
Так разделывают мелкую рыбу (весом 75—150 г), главным образом для жаренья, при этом оставляя голову (без жабер) или удаляя ее. После снятия чешуи отрезают спинной, анальный, грудные и брюшные плавники на уровне кожного покрова специальными ножницами. Затем рыбу потрошат и промывают.
Разделка рыбы, используемой непластованной.
Таким способом разделывают почти все виды рыб среднего размера (массой до 1,5 кг). Рыбу очищают от чешуи; у краев жаберных крышек глубоко подрезают мякоть, перерубают позвоночник и удаляют голову, а вместе с ней и большую часть внутренностей. Затем, не разрезая брюшка, зачищают внутреннюю полость. Брюшные, спинные, анальные, грудные плавники срезают. Хвостовой плавник и часть хвостового стебля удаляют прямым срезом на расстоянии 1—2 см от основания. Затем удаляют плечевые кости, промывают и обсушивают. Разделанная таким образом рыба называется тушкой.
Разделка рыбы на филе с кожей и реберными костями.
Рыбу массой 1-1,5 кг и более очищают от чешуи, разрезают брюшину от головы до начала хвоста и удаляют внутренности. Прорезают мякоть у края жаберных крышек и удаляют голову, а затем плечевую кость. Выпотрошенную рыбу промывают и пластуют, разрезая рыбу вдоль спины. После пластования с одной половинки срезают позвоночную кость и получают два филе с кожей и реберными костями.
Скільки порцій біфштексу масою 125 г можна нарізати з яловичини 1 категорії? Маса туші – 160 г.
160 /125=1,28
Екзаменаційний білет № 24
Залежність якості харчових продуктів від властивостей білків. Колоїдний стан білків у харчових продуктах. Приклади з кулінарної практики.
Харчові продукти – об’єкти тваринного або рослинного походження, використовувані в харчуванні людини в натуральному вигляді або після певного оброблення як джерела енергії, харчових та смако-ароматичних речовин. Для оцінки якості харчових продуктів існує багато пропозицій щодо визначення поняття “якість харчових продуктів”. Найбільш обґрунтоване визначення наведено у “Медико-биологических требованиях и санитарных нормах качества продовольственного сырья и пищевых продуктов (МБТ)» (1990). А саме: якість харчових продуктів – сукупність властивостей, що відображають здатність продукту забезпечувати потреби організму людини у харчових (поживних) речовинах, органолептичні характеристики продукту, безпечність його для здоров’я споживачів, надійність відносно стабільності складу та збереження споживчих властивостей. Поняття функціонально-технологічні властивості білкових добавок включає їх фізико - хімічні властивості, які визначають їх поведінку під час виробництва готових харчових продуктів, їх вплив на структуру, технологічні та споживчі властивості готових продуктів. До найбільш важливих функціонально - технологічних властивостей білків відносять розчинність, емульгуючу, піноутворюючу, гелеутворюючу та вологозв'язуючу здатність, здатність забезпечувати пластичність, твердість продуктів, адгезію тощо. Розчинність у воді та водних розчинах. Розчинність білків залежить від багатьох факторів, в першу чергу від технологічних параметрів одержання білків. Цей показник використовують одним із перших показників якості харчових білків. Кількісно розчинність білків оцінюють за коефіцієнтом розчинного азоту (КРА) та коефіцієнтом дисперсності білку (КДБ). стабільних харчових емульсій і пін (морозиво, креми, кондитерські вироби). В таких дисперсних системах білки відіграють подвійну функцію - емульгаторів (за рахунок поверхневої активності) та стабілізаторів (збільшують в'язкість дисперсійного середовища). Піноутворюючу здатність білків характеризують об'ємом або висотою стовбчика одержаної піни, що стабілізується одиницею маси білку.Технологія виробництва білкових продуктів із олійного насіння. Емульгуючу властивість характеризують відношенням максимальної кількості емульгованого жиру до кількості білків у розчині. Для характеристики цієї властивості використовують такий параметр як точка коацервації системи, яку визначають за максимальною кількістю жиру, що вводиться в колоїдний розчин білків до досягнення розшарування емульсії.Перевага білків у порівнянні із низько - молекулярними поверхнево -активними речовинами полягає в тому, що білкові моле-кули формують на поверхні дисперсних частинок адсорбційні шари, які перешкоджають коалесценції дисперсної фази. Гелеутворююча здатність білків характеризується значенням критичної концентрації, тобто мінімальною концентрацією білків в системі, при якій відбувається утворення гелю. Адгезійні та реологічні властивості. Адгезійні властивості білків характеризують їх здатність до склеювання поверхневих шарів двох тіл. Реологічні властивості білків можна визначити за в'язкістю білкових суспензій, пластичністю та твердістю продуктів із білковими добавками. Білки, що мають високі функціональні властивості, добре розчинні у воді, здатні утворювати висококонцентровані розчини, суспензії та гелі, ефективно стабілізують емульсії та піни. Білки з низькими функціональними властивостями - погано розчинні, не набрякають у воді, не здатні утворювати в'язкі та концентровані суспензії, стабілізувати піни та емульсії. Такі білки використовують для одержання харчових гідролізатів та як добавки до кормів. Вивчення функціональних властивостей білків є ключовим науковим напрямом проблеми одержання нових форм харчових продуктів, який дає змогу розробляти рецептури багатокомпонентних харчових систем. Регулювання функціональних властивостей білків відбувається перш за все вибором методів і режимів їх одержання (тостування шроту, екстрагування білків, осаджування та висушування білків). Від цих умов залежить ступінь денатурації, деструкції, фракційний склад, природа і кількість домішок, природа продуктів гідролізу білків тощо. Крім того, функціональні властивості білкових продуктів можна регулювати хімічними, ферментативними методами та методом текстурування. 2.3 Гідратація і дегідратація білків.Гідратацією називається здатність білків міцно зв'язувати значну кількість вологи. Гідрофільність окремих білків залежить від їх будови. Розташовані на поверхні білкової глобули гідрофільні групи (амінні, карбоксильні і ін) притягають молекули води, суворо орієнтуючи їх на поверхні. У ізоелектричної точці (коли заряд білкової молекули близький до нуля) здатність білка адсорбувати воду найменша. Зрушення рН в ту або іншу сторону від ізоелектричної точки призводить до дисоціації основних або кислотних груп білка, збільшення заряду білкових молекул і поліпшення гідратації білка. Навколишнє білкові глобули гідратне (водна) оболонка додає стійкість розчинів білка, заважає окремим часткам злипатися і випадати в осад. У розчинах з малою концентрацією білка (наприклад, молоко) білки повністю гідратованих і зв'язувати воду не можуть. У концентрованих розчинах білків при додаванні води відбувається додаткова гідратація. Здатність білків до додаткової гідратації має в технології їжі велике значення. Від неї залежать соковитість готових виробів, здатність напівфабрикатів з м'яса, птиці, риби утримувати вологу, реологічні властивості тіста і т. д. Прикладами гідратації в кулінарній практиці є: приготування омлетів, котлетної маси з продуктів тваринного походження, різних видів тіста, набухання білків круп , бобових, макаронних виробів і т.д. Дегідратацією називається втрата білками зв'язаної води при сушінні, заморожуванні і розморожуванні м'яса і риби, при тепловій обробці напівфабрикатів і т.д. Від ступеня дегідратації залежать такі важливі показники, як вологість готових виробів і їх вихід. Денатурація білків .Це складний процес, при якому під впливом зовнішніх факторів (температури, механічної дії, дії кислот, лугів, ультразвуку та ін) відбувається зміна вторинної, третинної і четвертинної структур білкової макромолекули, тобто нативної (природною) просторової структури. Первинна структура, а отже, і хімічний склад білка не змінюються. При кулінарній обробці денатурацію білків найчастіше викликає нагрівання. Процес цей у глобулярних і фібрилярних білках відбувається по-різному. У глобулярних білках при нагріванні посилюється тепловий рух поліпептидних ланцюгів всередині глобули водневі зв'язки, які утримували їх у певному положенні, розриваються і поліпептидний ланцюг розгортається, а потім згортається по-новому. При цьому полярні (заряджені) гідрофільні групи, розташовані на поверхні глобули і забезпечують її заряд і стійкість, переміщуються всередину глобули, а на поверхню її виходять реакційноздатні гідрофобні групи (дисульфідні, сульфгідрильні та ін), не здатні утримувати воду. Денатурація супроводжується змінами найважливіших властивостей білка: втратою індивідуальних властивостей (наприклад, зміна окраскімяса при його нагріванні внаслідок денатурації міоглобіну); втратою біологічної активності (наприклад, в картоплі, грибах, яблуках і ряді інших рослинних продуктів містяться ферменти, що викликають їх потемніння, при денатурації білки -ферменти втрачають активність); підвищенням атакується травними ферментами (як правило, піддані тепловій обробці продукти, що містять білки, перетравлюються повніше і легше); втратою здатності до гідратації (розчиненню, набухання); втратою стійкості білкових глобул, яка супроводжується їх Композиція (згортанням, або коагуляцією, білка). Агрегування - це взаємодія денатурованих молекул білка, яке супроводжується утворенням більш великих часток. Зовні це виражається по-різному залежно від концентрації та колоїдного стану білків у розчині. Так, в малоконцентрованої розчинах (до 1%) згорнувся білок утворює пластівці (піна на поверхні бульйонів). У більш концентрованих білкових розчинах (наприклад, білки яєць) при денатурації утворюється суцільний гель, що утримує всю воду, що міститься в колоїдній системі. Білки, що представляє собою більш-менш обводнені гелі (м'язові білки м'яса, птиці, риби; білки круп, бобових, борошна після гідратації та ін), при денатурації ущільнюються, при цьому відбувається їх дегідратація з відділенням рідини в навколишнє середовище. Білковий гель, підданий нагріванню, як правило, має менші обсяг, масу, великі механічну міцність і пружність у порівнянні з вихідним гелем нативних (натуральних) білків. Швидкість агрегування золів білка залежить від рН середовища. Менш стійкі білки поблизу ізоелектричної точки. Для поліпшення якості страв і кулінарних виробів широко використовують спрямована зміна реакції середовища. Так, при маринуванні м'яса, птиці, риби перед смаженням; додаванні лимонної кислоти або білого сухого вина при припускании риби, курчат; використанні томатного пюре при гасінні м'яса та ін створюють кисле середовище зі значеннями рН значно нижче ізоелектричної точки білків продукту. Завдяки меншій дегідратації білків вироби виходять більш соковитими. Фібрилярні білки денатурують інакше: зв'язки, які утримували спіралі їх поліпептидних ланцюгів, розриваються, і фібрила (нитка) білка скорочується в довжину. Так денатурують білки сполучної тканини м'яса і риби. Деструкція білків. При тривалій тепловій обробці білки піддаються більш глибоких змін, пов'язаних з руйнуванням їх макромолекул. На першому етапі змін від білкових молекул можуть отщепляться функціональні групи з утворенням таких летючих з'єднань, як аміак, сірководень, фосфористий водень, вуглекислий газ і ін Накопичуючись в продукті, вони беруть участь в утворенні смаку і аромату готової продукції. При подальшій гідротермічної обробки білки гідролізуються, при цьому первинна (пептидна) зв'язок розривається з утворенням розчинних азотистих речовин небілкового характеру (наприклад, перехід колагену у глютин). Деструкція білків може бути цілеспрямованим прийомом кулінарної обробки, що сприяє інтенсифікації технологічного процесу (використання ферментних препаратів для розм'якшення м'яса, ослаблення клейковини тесту, отримання білкових гідролізатів та ін.) Піноутворення. Білки в якості піноутворювачів широко використовують при виробництві кондитерських виробів (тісто бісквітне, білково-взбівное), збиванні вершків, сметани, яєць і ін Стійкість піни залежить від природи білка, його концентрації, а також температури. Важливими є й інші технологічні властивості білків. Так, їх використовують як емульгаторів при виробництві білково-жирових емульсій, як наповнювачі для різних напоїв. Напої, збагачені білковими гідролізатами (наприклад, соєвими), мають низьку калорійність і можуть зберігатися тривалий час навіть при високій температурі без додавання консервантів. Білки здатні зв'язувати смакові і ароматичні речовини. Цей процес обумовлюється як хімічної природою цих речовин, так і поверхневими властивостями білкової молекули, факторами навколишнього середовища. При тривалому зберіганні відбувається "старіння" білків, при цьому знижується їх здатність до гідратації, подовжуються терміни теплової обробки, не може розварювання продукту (наприклад, варіння бобових після тривалого зберігання). При нагріванні з поновлюючими цукрами білки утворюють Меланоїдіни
