
- •2. Стереоизомерия моносахаридов [23, 27]
- •3. Формулы Хеуорса
- •4. Таутомерия
- •5. Химические свойства
- •5.1. Окисление
- •5.2. Образование и гидролиз гликозидов [25]
- •5.3. Взаимодействие с фенилгидразинами [21, 25, 16]
- •II. Олигосахариды. Полисахариды
- •1. Строение и биологическая роль трегалозы
- •2. Гидролиз олигосахаридов
- •3. Эфиры целлюлозы и их применение
- •3.1. Нитраты
- •3.2. Ацетаты
- •3.3. Карбоксиметилцеллюлоза
- •5. Строение и биологическая роль инулина
- •Литература
Акценты
и некоторые дополнительные сведения
к теме «Углеводы»
I. Углеводы. Моносахариды
1. Определение и классификация углеводов
Углеводы (сахарá) –
алифатические полигидроксикарбонильные соединения и их многочисленные (в том числе полимерные) производные, компоненты всех без исключения живых организмов [3];
обширная группа природных органических соединений, химическая структура которых часто отвечает общей формуле Cm(H2O)n [4].
Классификация углеводов [6, 25]

Примеры моносахаридов и их биологическая роль [25]
 Триозы
Тетрозы Пентозы
Триозы
Тетрозы Пентозы
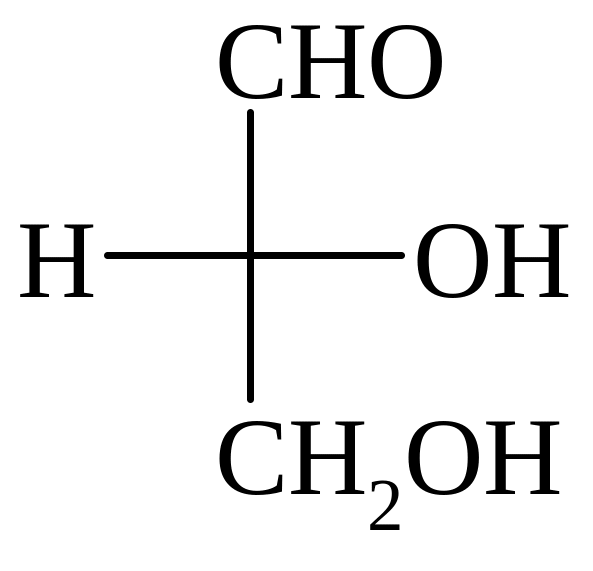
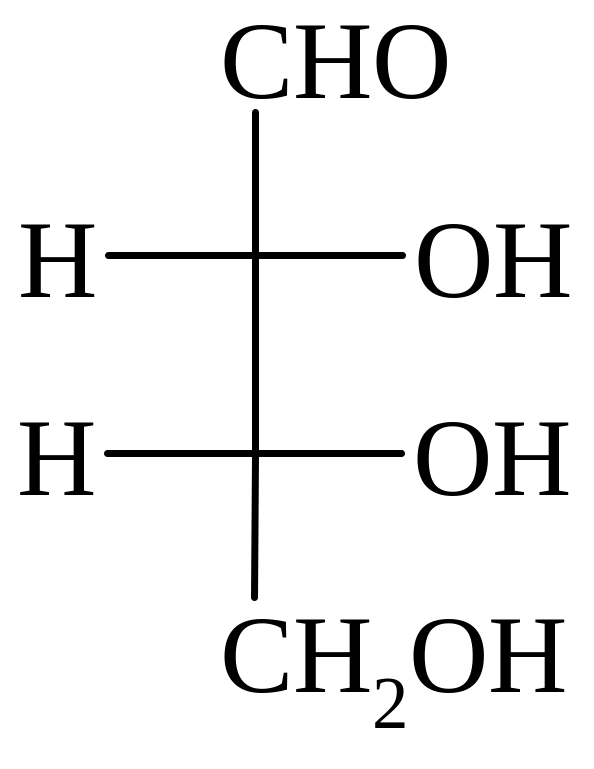
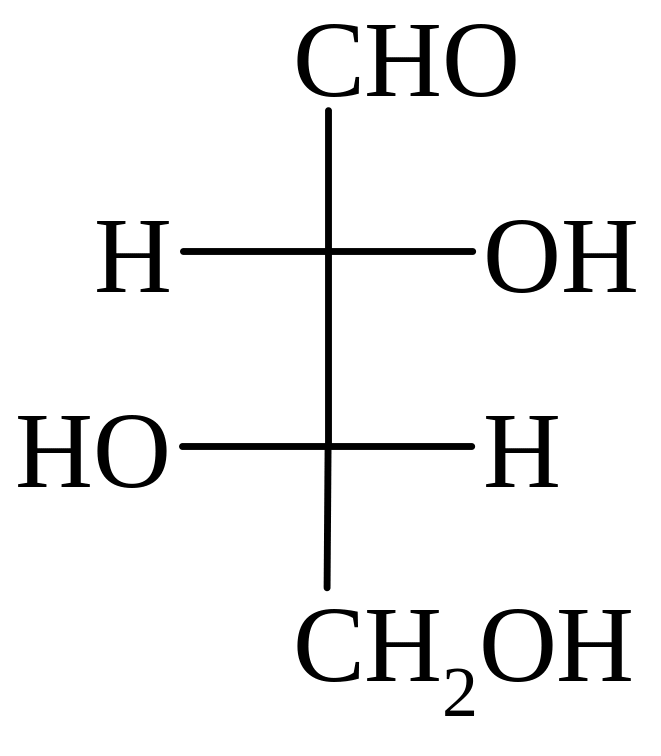
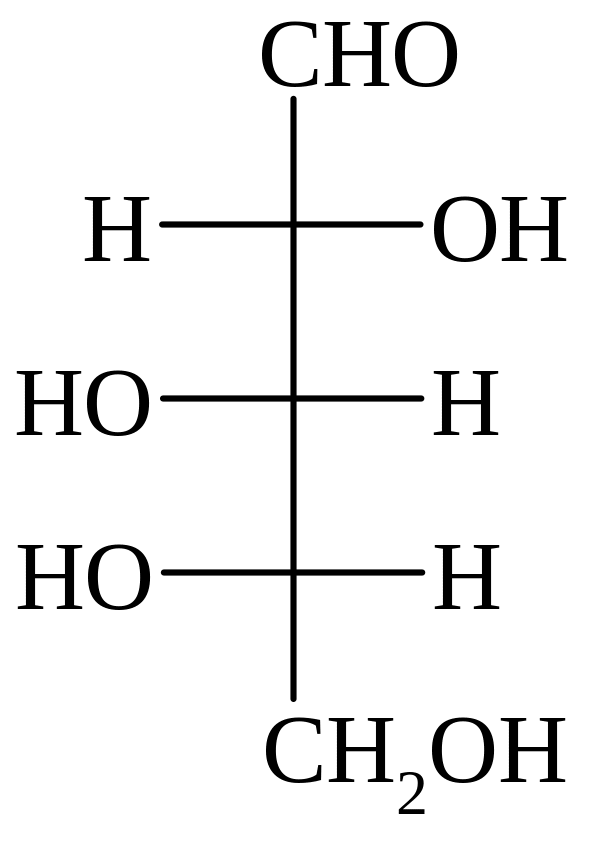

D-глицериновый D-эритроза L-треоза D-рибоза L-арабиноза D-ксилоза
альдегид
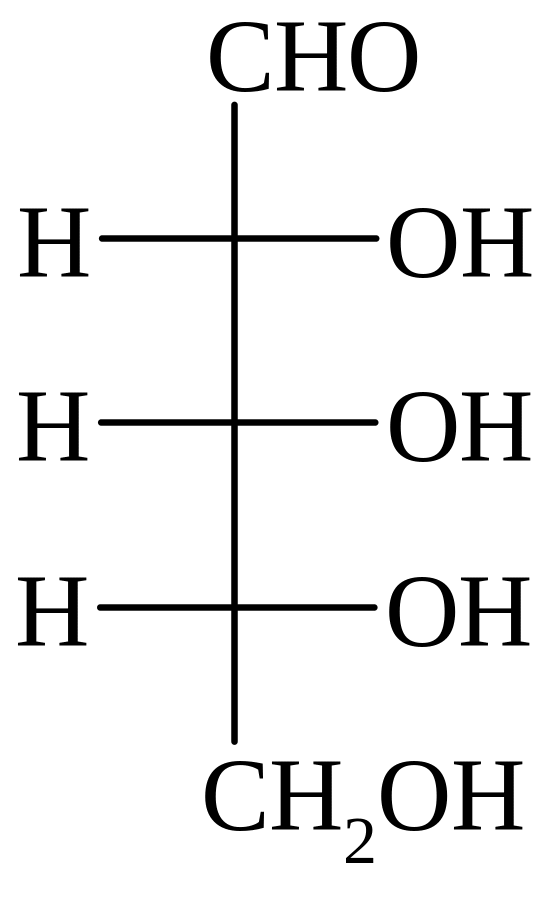
 Гексозы
Высшие сахара
Гексозы
Высшие сахара
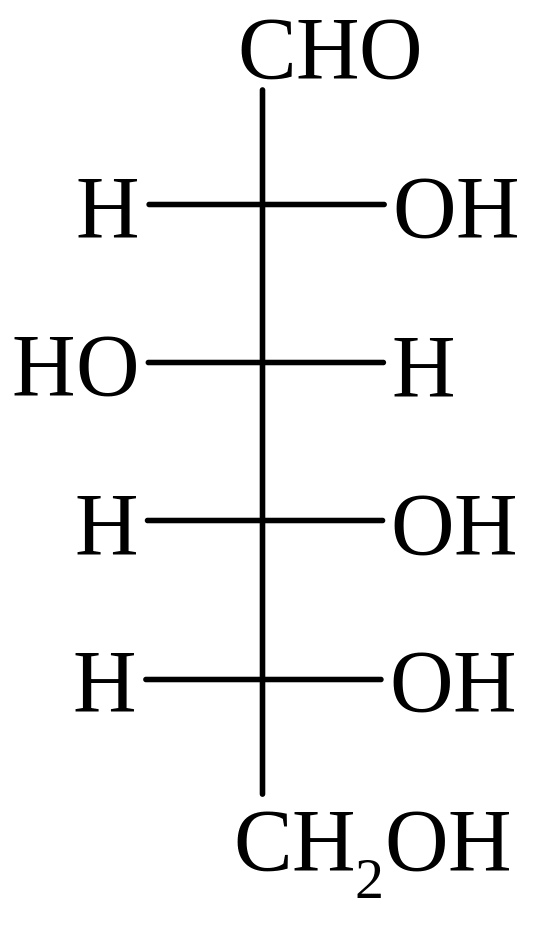
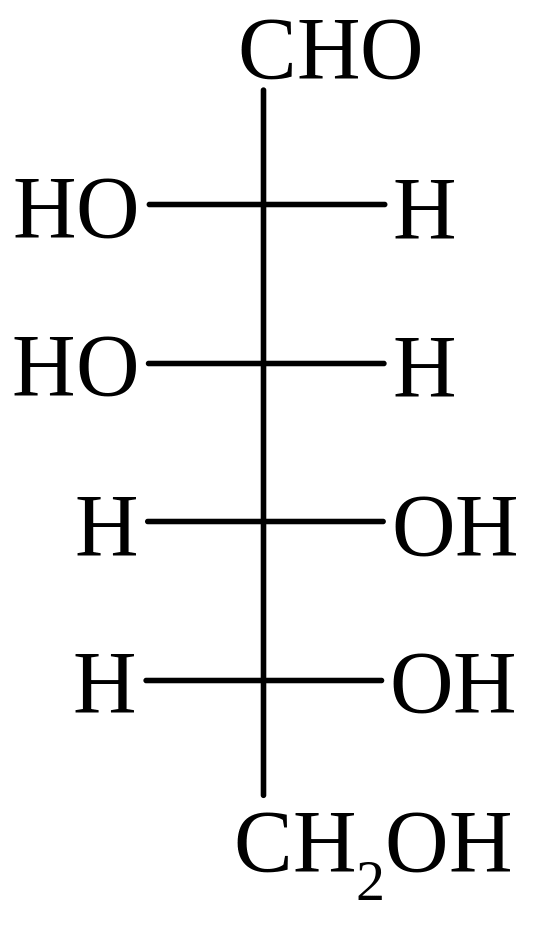
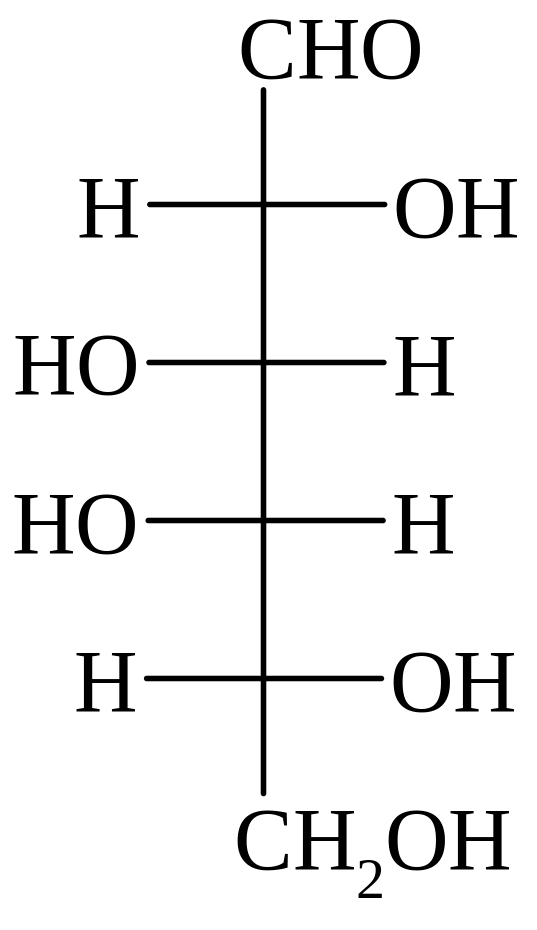
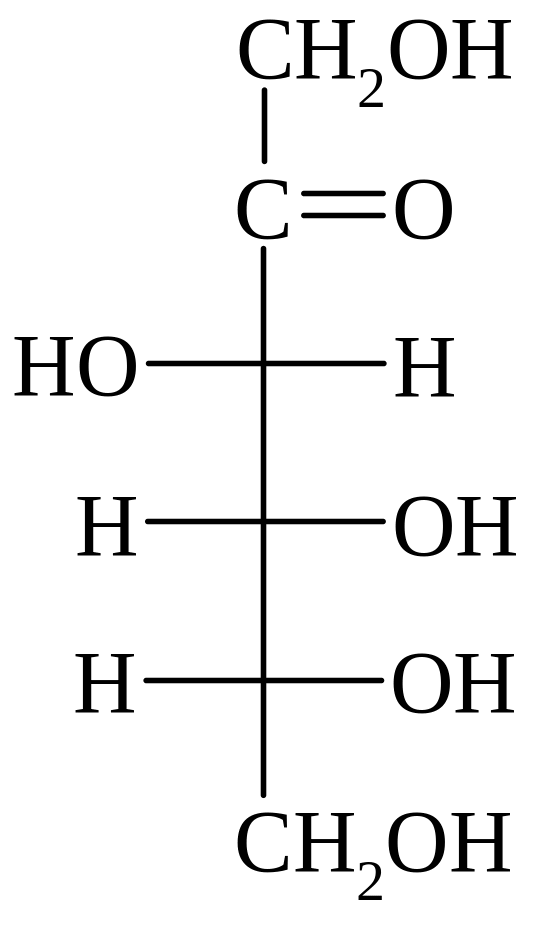

D-глюкоза D-манноза D-галактоза D-фруктоза D-седогептулоза
D-Глицериновый альдегид (глицероза) – в виде фосфата входит в цикл Кальвина, его фосфат образуется также на одной из стадий гликолиза.
D-Эритроза – участвует в цикле Кальвина в виде фосфата.
D-Рибоза – Входит в состав нуклеотидов РНК, содержится в структуре АТФ, НАД и др.
L-арабиноза – входит в состав растительных полисахаридов, например камедей некоторых растений, гемицеллюлозы хвойных деревьев (полисахарид клеточных стенок).
D-ксилоза – содержится во многих растительных полисахаридах.
D-глюкоза – самый распространённый моносахарид, необходимый компонент любых живых организмов – от вирусов до высших растений и позвоночных, содержится в свободном виде и входит в состав различных соединений.
D-манноза – компонент многих полисахаридов растительного, животного и бактериального происхождения.
D-галактоза – составная часть многих природных гликозидов и полисахаридов, найдена в гликолипидах мозга, олигосахаридах молока, в ряде важных гликопротеинов.
D-фруктоза – наряду с глюкозой, играет первостепенную роль в энергетическом обмене углеводов, входит в состав ряда растительных полисахаридов (например инулина) и некоторых бактериальных, а также олигосахаридов (в том числе сахарозы).
D-седогептулоза – одно из звеньев цикла Кльвина, кроме того, участник пентозофосфатного цикла – одного из путей распада глюкозы до СО2 у животных, бактерий и растительных организмов.
2. Стереоизомерия моносахаридов [23, 27]
Говоря о стереоизомерии моносахаридов, прежде всего имеют в виду изомерию, обусловленную наличием асимметрических углеродных атомов.

Энантиомеры – стереоизомеры, относящиеся друг к другу как предмет и несовместимое с ним зеркальное изображение (D-рибоза и L-рибоза).
Диастереомеры – стереоизомеры, которые не относятся друг к другу как предмет и несовместимое с ним зеркальное изображение (D-рибоза и L-арабиноза, D-глюкоза и D-галактоза, D-галактоза и D-манноза).
Эпимеры – стереоизомеры, отличающиеся конфигурацией только одного асимметрического атома углерода (D-рибоза и D-галактоза).
Аномеры – стереоизомеры циклических форм, отличающиеся конфигурацией аномерного атома углерода (хирального центра, который образуется в результате циклизации открытых цепей).
Как видно из схемы, эпимеры – это частный случай диастереомеров, а аномеры – частный случай эпимеров.
3. Формулы Хеуорса
Первый углеродный атом в стандартно изображённой формуле Хеуорса находится в правой части цикла.
Заместители, распложенные в проекции Фишера справа от вертикальной черты, помещают в хéуорсовской формуле под плоскостью, расположенные слева – над плоскостью. Такое утверждение, разумеется, применимо к заместителям при атомах углерода, входящих в цикл, кроме атома, поставляющего для циклизации гидроксил.
Под плоскостью цикла находится гликозидный гидроксил в α-аномерах D-ряда и в β-формах L-ряда.
Гидроксилированный углеводородный «хвост» (остаток цепи, не входящий в цикл) помещают над плоскостью в том случае, если гидроксигруппа, участвующая в циклизации, расположена в проекции Фишера справа.
Остаток цепи, который содержит хиральные центры и находится под плоскостью цикла, выглядит так же, как в проекции Фишера для открытой формы. В противном случае «хвост» поворачивают на 180°, не выводя связи из плоскости бумаги.
Примеры
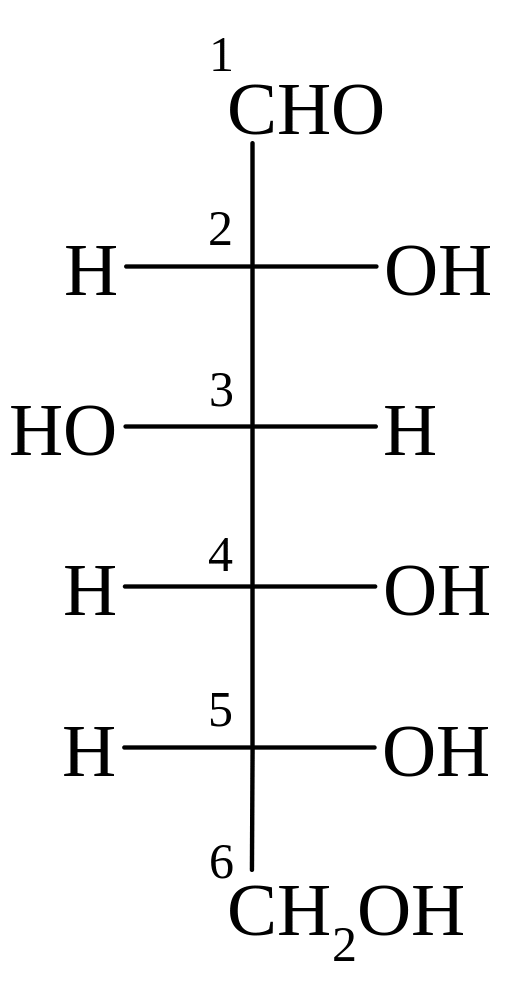
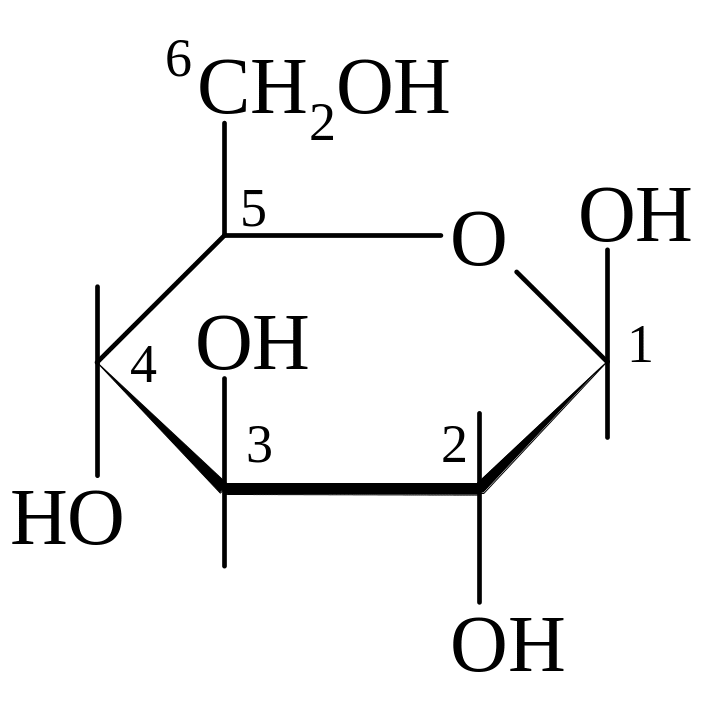
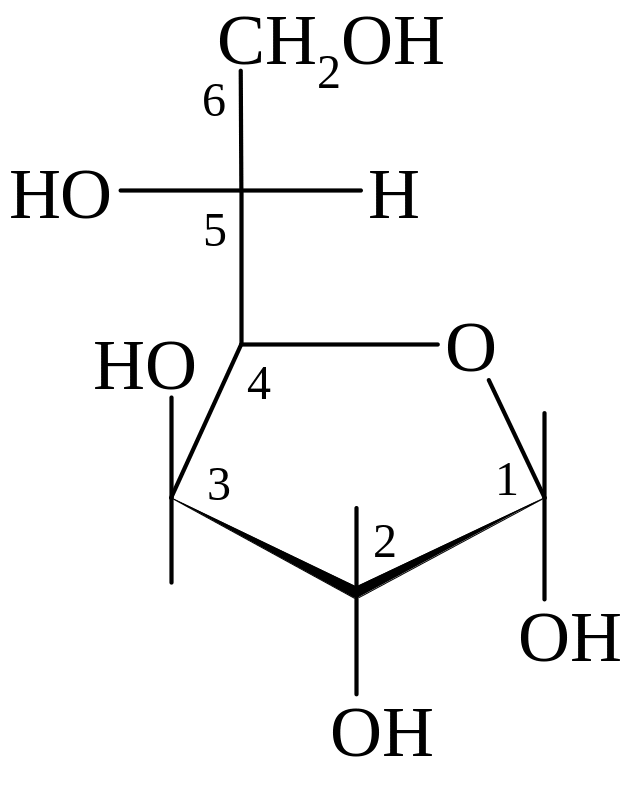
D-глюкоза β-D-глюкопираноза α-D-глюкофураноза
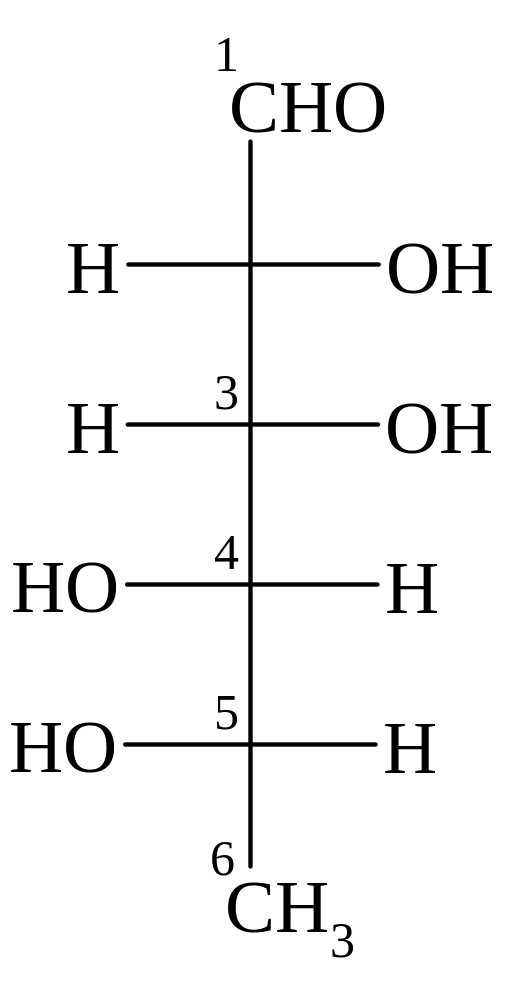
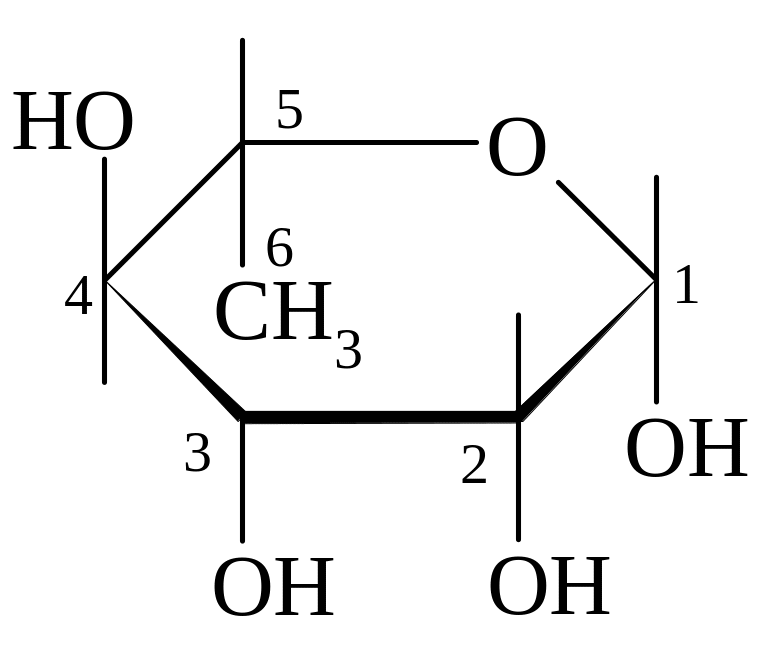

L-рамноза β-L-рамнопираноза D-галактоза α-D-галактофураноза

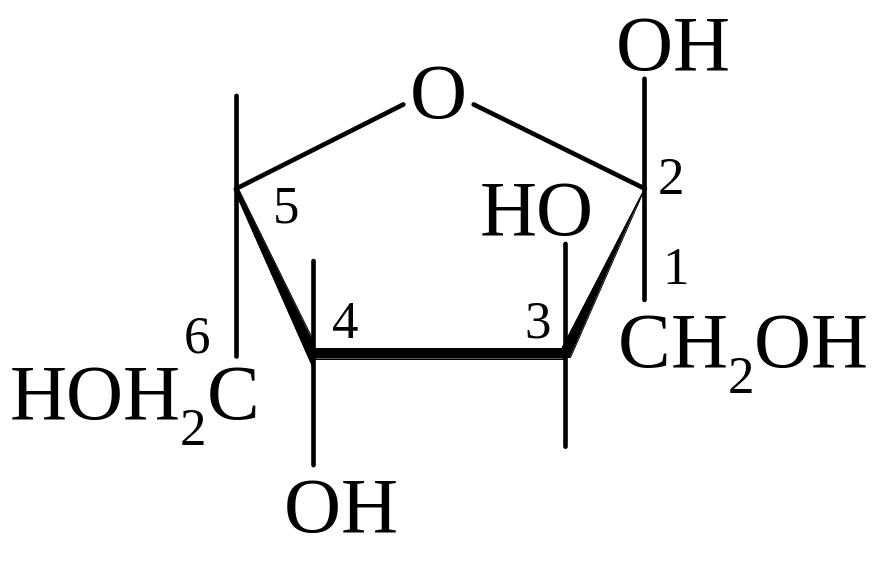
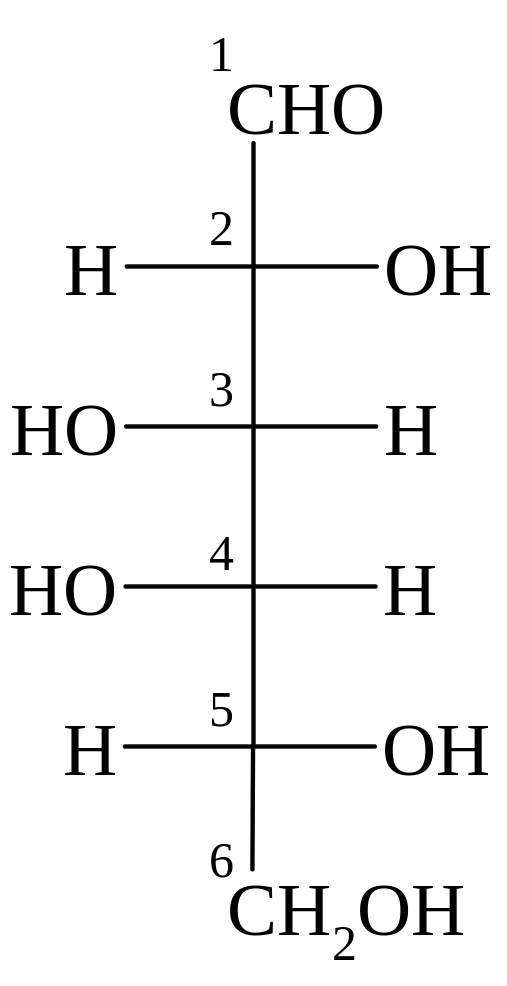
L-сорбоза α-L-сорбофураноза
4. Таутомерия
Таутомерия – явление обратимой изомерии, при которой два или более структурных изомера (таутомера) находятся между собой в подвижном равновесии [4].
Мутаротация – изменение со временем угла вращения плоскости поляризации света до постоянной величины растворами моно- или олигосахаридов, в которых соотношение таутомерных форм не является равновесным.
5. Химические свойства
5.1. Окисление
Окисление бромом [25].
Скорость реакции обратно пропорциональна кислотности среды. Для связывания выделяющейся бромистоводородной кислоты применяют карбонаты кальция или бария.
Окислению молекулярным бромом или трибромид-ионом подвергается β-пиранозная форма. Предложен следующий механизм такого окисления:
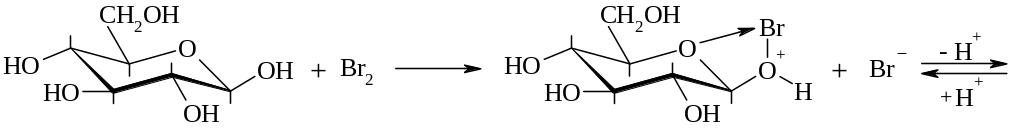
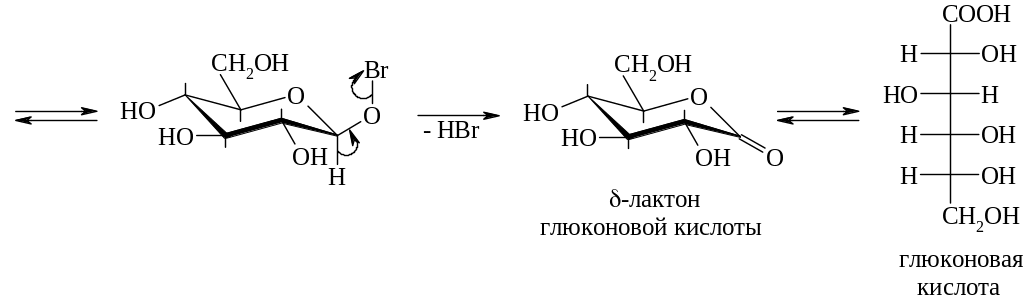
Электрохимическим окислением глюкозы в присутствии бромида кальция и карбоната кальция в фармацевтической промышленности получают кальция глюконат. При электролизе бромида кальция на аноде выделяется свободный бром, который окисляет глюкозу до глюконовой кислоты. Глюконовая и бромоводородная кислота нейтрализуется карбонатом кальция. Образующийся бромид кальция вновь подвергают электролизу [2].
Окисление солями тяжёлых металлов.
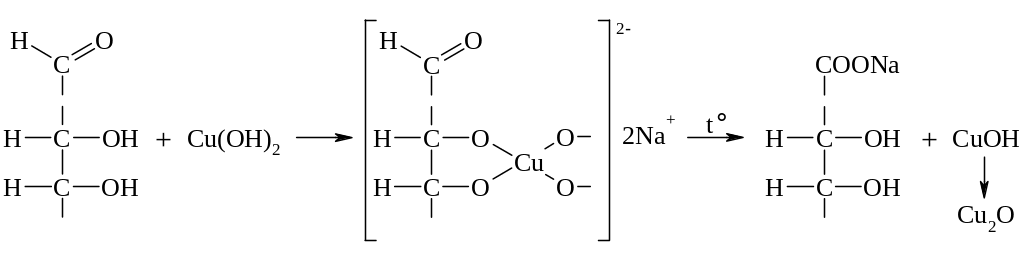
а) Реакция Троммера: взаимодействие углевода с гидроксидом меди в щелочной среде при нагревании. Раствор сульфата меди (+2) смешивают с избыточным количеством раствора щёлочи, при этом выделяется аморфный голубой осадок гидроксида меди (2+). Затем добавляют сахар, и окраска становится синей: гидроокись меди реагирует с углеводом, образуя раствор хелата (качественная реакция на α-гликольный фрагмент). При нагревании наблюдается жёлтый осадок гидроксида меди (+1), разлагающийся до нерастворимого красного оксида меди (+1). Из сахара образуется гликуроновая кислота и другие органические вещества, продукты более глубокого окисления.
![]()


б) Окисление реактивом Фелинга: взаимодействие углевода с комплексной солью, образующейся при смешивании сульфата меди и калий-натриевой соли винной кислоты, при нагревании. Окислительно-восстановительные процессы, протекающие в ходе этой реакции, аналогичны таковым в реакции Троммера.
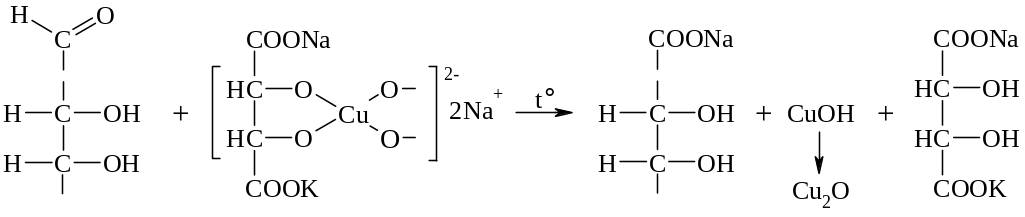

в) Окисление реактивом Толленса: взаимодействие с аммиачным раствором оксида серебра (+1) при нагревании. Реактив готовят, смешивая нитрат серебра с гидроксидом натрия и растворяя выпавший Ag2O в водном аммиаке. Металическое серебро часто осаждается на стенке сосуда в виде зеркального покрытия [21]. Кроме гликоновой кислоты, как и во всех предыдущих случаях, образуются побочные органические продукты разложения [23].

Растворы кетоз также дают все упомянутые окислительные реакции, но признаки взаимодействия наступают медленно, поскольку реагируют не сами кетополиолы, а альдозы, образующиеся в результате изомеризации.
