
- •Часть 1
- •1. Строение атома
- •Квантовые числа
- •Электронные формулы атомов
- •Распределение электронов по квантовым ячейкам
- •Электронно-графические формулы атомов
- •2. Периодическая система д.И. Менделеева
- •Классификация химических элементов по свойствам
- •Свойства элементов
- •Валентность и степени окисления элементов в соединениях
- •Классы и формулы химических соединений
- •Свойства соединений элементов (кислотно-основные и окислительно-восстановительные)
- •3. Химическая связь
- •Основные характеристики ковалентной связи
- •Метод вс
- •Гибридизация атомных орбиталей
- •Метод мо
- •4. Химическая термодинамика
- •5. Химическая кинетика
- •6. Химическое равновесие
- •Смещение химического равновесия
- •7. Растворы электролитов
- •Способы выражения содержания растворенного вещества в растворе (концентрации)
- •Электролитическая диссоциация
- •Буферные растворы
- •Произведение растворимости
- •Гидролиз
- •8. Коллигативные свойства растворов
- •Давление насыщенного пара
- •Температуры кипения и замерзания
- •Осмотическое давление
- •9. Окислительно-восстановительные реакции
- •Прогнозирование окислительно-восстановительных свойств
- •10. Электрохимия
- •Электрохимический ряд напряжений метaллов
- •Гальванический элемент
- •Электролиз
- •Анод – окисление, катод – восстановление.
- •Катодные процессы при электролизе
- •Анодные процессы при электролизе водных растворов веществ
- •Закон Фарадея:
- •Коррозия
- •11. Коллоидные растворы
- •12. Методы анализа химических соединений
- •13. Перечень умений и навыков
- •Часть 2 Приложение
- •В водных растворах (при 298 к)
- •Список литературы
- •Содержание
Гидролиз
Гидролиз соли – разложение соли водой с образованием слабого электролита, сопровождающееся изменением рН среды.
Гидролиз по катиону протекает для солей, образованных сильной кислотой и слабым основанием, например, ZnCl2, AlCl3, Fe2(SO4)3, NH4NO3 и т.д., при этом раствор приобретает кислую реакцию (pH<7).
Первая ступень:
Zn2++ HOH ↔ Zn(OH)+ + H+ (краткое ионно-молекулярное уравнение)
ZnCl2 +HOH ↔ Zn(OH)Cl + HCl (молекулярное уравнение)
Вторая ступень:
Zn(OH)+ + HOH ↔ Zn(OH)2 + H+ (краткое ионно-молекулярное уравнение)
Zn(OH)Cl + HOH ↔ Zn(OH)2 + HCl (молекулярное уравнение)
Гидролиз по аниону характерен для солей, образованных слабой кислотой и сильным основанием, например, CH3COONa, Na2CO3, K2SO3. Реакция раствора становится щелочной - pH>7.
NaCN+ HOH ↔ HCN + NaOH
CN– + HOH ↔ HCN + OH–
Гидролиз по аниону и катиону характерен для солей, образованных слабой кислотой и слабым основанием, например, CH3COONH4, ZnSО3. Величина pH в этом случае зависит от относительной силы образующихся кислоты и основания.
CH3COONH4 + HOH ↔ CH3COOH + NH4OH
CH3COO– + NH4++ HOH ↔ CH3COOH + NH4OH
Соли, образованные сильными основаниями и сильными кислотами (KCl, LiNO3, Na2SO4 и др.), гидролизу не подвергаются.
Гидролиз характеризуется константой гидролиза КГ. Например, для гидролиза NaCN константа гидролиза имеет вид:
 .
.
Константа гидролиза связана с ионным произведением воды и константой диссоциации слабого электролита, образующегося в результате гидролиза, соотношением:
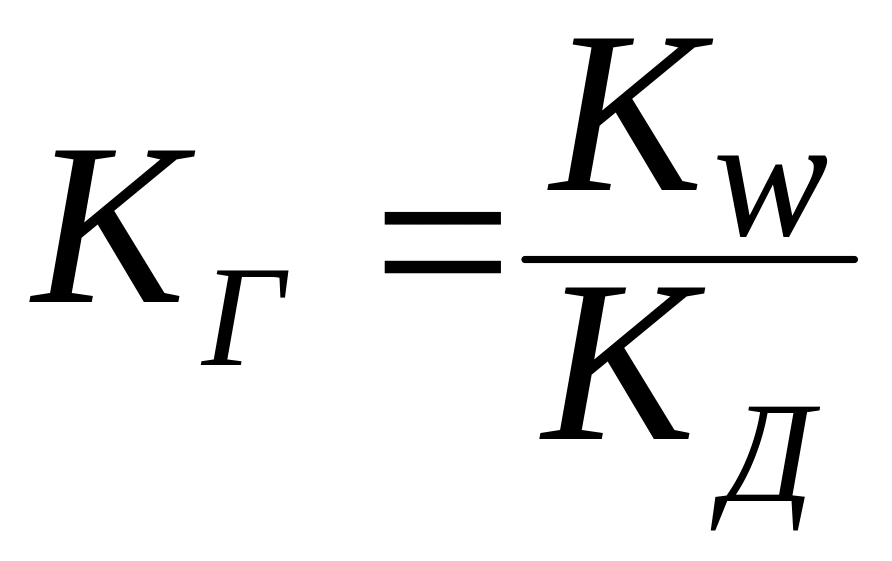
8. Коллигативные свойства растворов
Коллигативные свойства растворов не зависят от химической природы растворенного вещества, а определяются только числом частиц, находящихся в растворе.
Давление насыщенного пара
Формулировка I закона Рауля: относительное понижение давления насыщенного пара растворителя над раствором не зависит от природы растворенного вещества, а определяется молярной долей растворенного вещества:
 ,
,
где Р0
и Р
- давление пара над чистым растворителем
и над раствором соответственно, Па; ν1
и ν2
- количество растворителя и растворенного
вещества соответственно, моль;
 - молярная доля растворенного вещества.
- молярная доля растворенного вещества.
По известным значениям Р0 и Р можно вычислить молярную массу растворенного вещества:
 ,
,
где Р0 и Р - давление пара над чистым растворителем и над раствором соответственно; m1 и m2 - масса растворителя и растворенного вещества соответственно, г; М1 и М2 - молярная масса растворителя и растворенного вещества соответственно, г/моль.
Температуры кипения и замерзания
Формулировка II закона Рауля: повышение температуры кипения и понижение температуры замерзания раствора по сравнению с чистым растворителем не зависят от природы растворенного вещества, а определяются только концентрацией раствора:
 ,
,
где Δt - понижение температуры кристаллизации (замерзания) или повышение температуры кипения раствора по сравнению с чистым растворителем, С или К; К - криоскопическая или эбулиоскопическая константа; m1 и m2 - масса растворителя и растворенного вещества соответственно, г; М2 - молярная масса растворенного вещества, г/моль.
