
- •Часть 1
- •1. Строение атома
- •Квантовые числа
- •Электронные формулы атомов
- •Распределение электронов по квантовым ячейкам
- •Электронно-графические формулы атомов
- •2. Периодическая система д.И. Менделеева
- •Классификация химических элементов по свойствам
- •Свойства элементов
- •Валентность и степени окисления элементов в соединениях
- •Классы и формулы химических соединений
- •Свойства соединений элементов (кислотно-основные и окислительно-восстановительные)
- •3. Химическая связь
- •Основные характеристики ковалентной связи
- •Метод вс
- •Гибридизация атомных орбиталей
- •Метод мо
- •4. Химическая термодинамика
- •5. Химическая кинетика
- •6. Химическое равновесие
- •Смещение химического равновесия
- •7. Растворы электролитов
- •Способы выражения содержания растворенного вещества в растворе (концентрации)
- •Электролитическая диссоциация
- •Буферные растворы
- •Произведение растворимости
- •Гидролиз
- •8. Коллигативные свойства растворов
- •Давление насыщенного пара
- •Температуры кипения и замерзания
- •Осмотическое давление
- •9. Окислительно-восстановительные реакции
- •Прогнозирование окислительно-восстановительных свойств
- •10. Электрохимия
- •Электрохимический ряд напряжений метaллов
- •Гальванический элемент
- •Электролиз
- •Анод – окисление, катод – восстановление.
- •Катодные процессы при электролизе
- •Анодные процессы при электролизе водных растворов веществ
- •Закон Фарадея:
- •Коррозия
- •11. Коллоидные растворы
- •12. Методы анализа химических соединений
- •13. Перечень умений и навыков
- •Часть 2 Приложение
- •В водных растворах (при 298 к)
- •Список литературы
- •Содержание
7. Растворы электролитов
Дисперсные системы: взвеси, коллоидные растворы, растворы.
Раствор: гомогенная дисперсная система переменного состава, состоящая из двух или более компонентов.
Компоненты раствора: растворенное вещество и растворитель.
Физико-химическая природа раствора: сочетание признаков механической смеси и продукта химического взаимодействия.
Эффекты при растворении: изменение объема, выделение или поглощение тепла, изменение цвета.
Идеальные растворы - разбавленные растворы, взаимодействия между частицами практически отсутствуют (близость к механической смеси).
Реальные растворы - наличие взаимодействий между частицами.
Сольватация (для водных растворов гидратация) - совокупность всех процессов взаимодействия между растворенным веществом и растворителем, возникающих в результате появления в растворителе растворенного вещества (от латинского «solvent» - растворять).
Молярная теплота растворения - количество тепла, выделяемое или поглощаемое при растворении 1 моль вещества с образованием 1 л раствора.
Насыщенный раствор содержит максимально возможные при данных условиях количества растворенного вещества; пример равновесной системы.
Ненасыщенный раствор содержит количества растворенного вещества, меньшие, чем в насыщенном.
Пересыщенный раствор содержит количества растворенного вещества большие, чем насыщенный раствор (готовят при нагревании); пример ложного равновесия.
Способы выражения содержания растворенного вещества в растворе (концентрации)
Массовая доля ω - отношение массы растворенного вещества к массе раствора:
 ,
,
где m1 и m2- масса растворителя и растворенного вещества соответственно, г или кг; m - масса раствора (m = m1 + m2), г или кг.
Объемная доля Ф - отношение объема растворенного вещества к объему всего раствора:
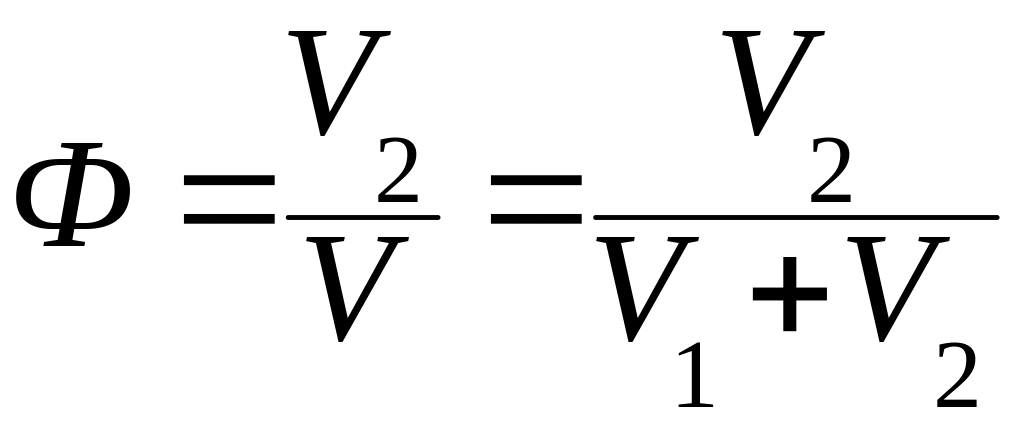 ,
,
где V1 и V2 - объем растворителя и растворенного вещества соответственно, мл или м3, V - объем раствора (V = V1 + V2), мл или м3.
Мольная доля Х - отношение количества растворенного вещества к общему количеству вещества в растворе:
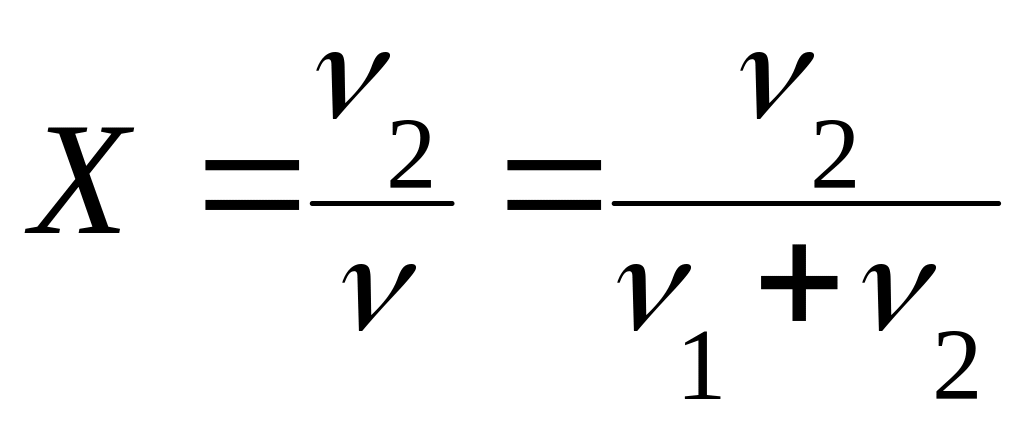
где ν1 и ν2- количество растворителя и растворенного вещества соответственно, моль; ν - общее количество вещества в растворе (ν = ν1 + ν2), моль.
Массовую, объемную и мольную доли можно выразить в процентах.
Молярная концентрация сМ - количество растворенного вещества в единице объема раствора (моль/л):
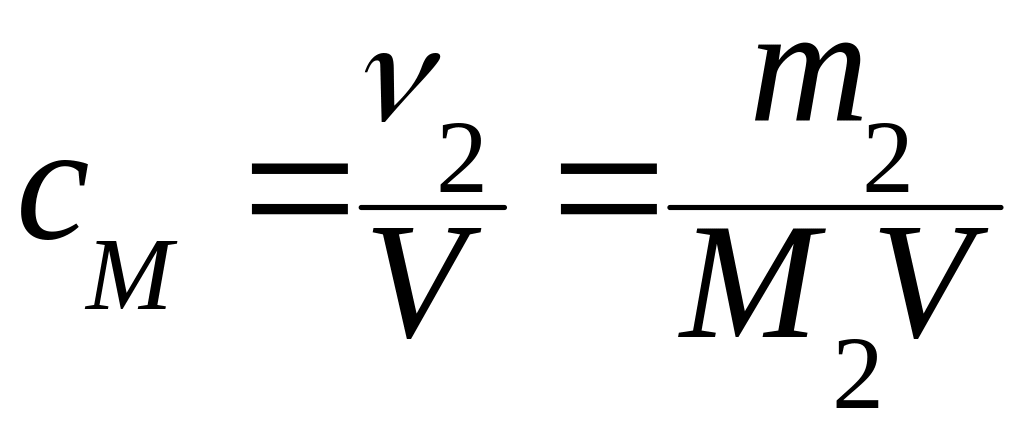 ,
,
где ν2 - количество растворенного вещества, моль; m2 - масса растворенного вещества, г; М2 - молярная масса растворенного вещества (г/моль); V -объем раствора (л или м3).
Нормальная концентрация сN - количество эквивалентов растворенного вещества в единице объема раствора (моль-экв/л):
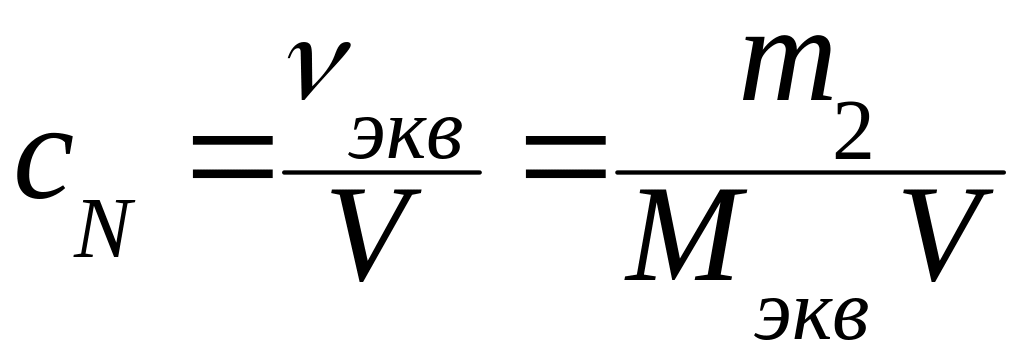 ,
,
где νэкв – количество эквивалента растворенного вещества, моль-экв; Mэкв – молярная масса эквивалента вещества, г/моль-экв; m2 – масса растворенного вещества, г; V - объем раствора (л или м3).
Моляльная концентрация сm – количество растворенного вещества в 1 кг растворителя (моль/кг):
 ,
,
где ν2 - количество растворенного вещества, моль; m1 - масса растворителя, кг.
