
- •Часть 1
- •1. Строение атома
- •Квантовые числа
- •Электронные формулы атомов
- •Распределение электронов по квантовым ячейкам
- •Электронно-графические формулы атомов
- •2. Периодическая система д.И. Менделеева
- •Классификация химических элементов по свойствам
- •Свойства элементов
- •Валентность и степени окисления элементов в соединениях
- •Классы и формулы химических соединений
- •Свойства соединений элементов (кислотно-основные и окислительно-восстановительные)
- •3. Химическая связь
- •Основные характеристики ковалентной связи
- •Метод вс
- •Гибридизация атомных орбиталей
- •Метод мо
- •4. Химическая термодинамика
- •5. Химическая кинетика
- •6. Химическое равновесие
- •Смещение химического равновесия
- •7. Растворы электролитов
- •Способы выражения содержания растворенного вещества в растворе (концентрации)
- •Электролитическая диссоциация
- •Буферные растворы
- •Произведение растворимости
- •Гидролиз
- •8. Коллигативные свойства растворов
- •Давление насыщенного пара
- •Температуры кипения и замерзания
- •Осмотическое давление
- •9. Окислительно-восстановительные реакции
- •Прогнозирование окислительно-восстановительных свойств
- •10. Электрохимия
- •Электрохимический ряд напряжений метaллов
- •Гальванический элемент
- •Электролиз
- •Анод – окисление, катод – восстановление.
- •Катодные процессы при электролизе
- •Анодные процессы при электролизе водных растворов веществ
- •Закон Фарадея:
- •Коррозия
- •11. Коллоидные растворы
- •12. Методы анализа химических соединений
- •13. Перечень умений и навыков
- •Часть 2 Приложение
- •В водных растворах (при 298 к)
- •Список литературы
- •Содержание
5. Химическая кинетика
Скорость химической реакции – число столкновений активных частиц в единицу времени в единице реакционного пространства или изменение концентрации одного из реагентов в единицу времени:
 ,
,
V - скорость химической реакции; Δс - изменение концентрации одного из реагентов, моль/л; Δτ - время, с.
Лимитирующая стадия – самая медленная стадия реакции.
Факторы, влияющие на величину скорости химической реакции:
– природа реагирующих веществ;
– температура;
– концентрация реагирующих веществ;
– присутствие катализаторов.
Зависимость скорости реакции от температуры (формула Вант-Гоффа):
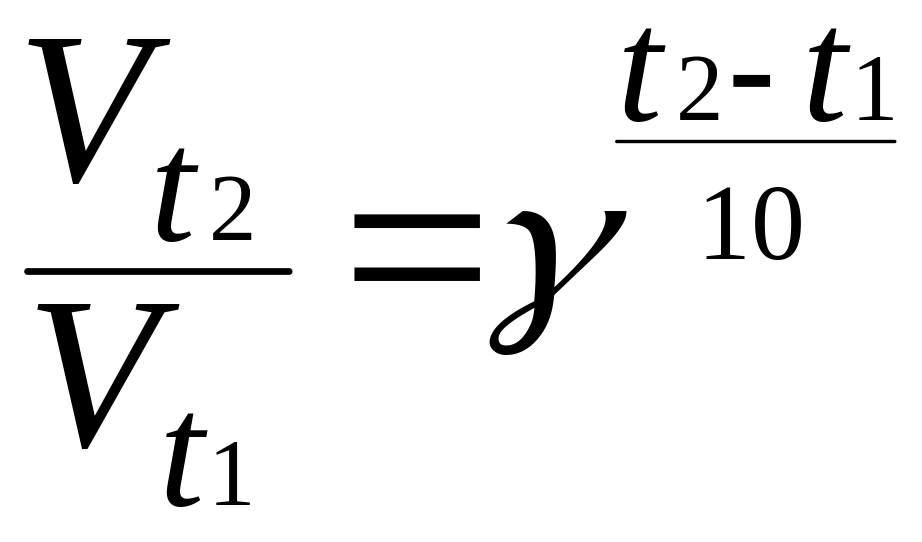 ,
,
где Vt2 - скорость реакции при температуре t2; Vt1 - скорость реакции при температуре t1; γ - постоянная для данной реакции величина, называемая температурным коэффициентом реакции.
Зависимость скорости реакции от концентраций реагирующих веществ (кинетическое уравнение):
![]() ,
,
где V - скорость реакции; k - константа скорости реакции; сA, сB -концентрации веществ А и В соответственно; х, у - частные порядки реакции по реагентам А и В соответственно (сумма х+у называется общим порядком реакции).
6. Химическое равновесие
Обратимые химические реакции: одновременно с прямой реакцией протекает обратная.
Состояние химического равновесия: скорость прямой реакции равна скорости обратной; энергия системы минимальная; ΔG° = 0.
Константа химического равновесия характеризует взаимосвязь равновесных концентраций веществ, участвующих в данной реакции. Константа химического равновесия (Кс или Кр для газов) для реакции:
![]()

В правую часть каждого из выражений включают концентрации только газообразных и растворенных, но не чистых жидких или твердых веществ, концентрации которых считают постоянными.
Гомогенное равновесие: все вещества находятся в одинаковом фазовом состоянии, реакция происходит в однородной, гомогенной среде.
Гетерогенное равновесие: вещества находятся в разных фазовых состояниях, реакция протекает в неоднородной, гетерогенной среде.
Смещение химического равновесия
Принцип Ле Шателье: если на систему, находящуюся в равновесии, оказывается воздействие извне, то равновесие смещается в сторону той реакции, протекание которой максимально ослабляет внешнее воздействие.
Действие извне |
В сторону какой реакции смещается равновесие |
Повышение температуры (нагревание) |
В сторону эндотермической реакции (поглощение тепла, ΔН>0) |
Понижение температуры (охлаждение) |
В сторону экзотермической реакции (выделение тепла, ΔН<0) |
Повышение давления |
В сторону реакции с уменьшением количеств газообразных веществ |
Понижение давления |
В сторону реакции с увеличением количеств газообразных веществ |
Повышение концентрации (добавление одного из веществ) |
В сторону реакции, в которой это вещество расходуется |
Понижение концентрации (отвод одного из веществ) |
В сторону реакции, в которой это вещество образуется |
