
- •Часть 1
- •1. Строение атома
- •Квантовые числа
- •Электронные формулы атомов
- •Распределение электронов по квантовым ячейкам
- •Электронно-графические формулы атомов
- •2. Периодическая система д.И. Менделеева
- •Классификация химических элементов по свойствам
- •Свойства элементов
- •Валентность и степени окисления элементов в соединениях
- •Классы и формулы химических соединений
- •Свойства соединений элементов (кислотно-основные и окислительно-восстановительные)
- •3. Химическая связь
- •Основные характеристики ковалентной связи
- •Метод вс
- •Гибридизация атомных орбиталей
- •Метод мо
- •4. Химическая термодинамика
- •5. Химическая кинетика
- •6. Химическое равновесие
- •Смещение химического равновесия
- •7. Растворы электролитов
- •Способы выражения содержания растворенного вещества в растворе (концентрации)
- •Электролитическая диссоциация
- •Буферные растворы
- •Произведение растворимости
- •Гидролиз
- •8. Коллигативные свойства растворов
- •Давление насыщенного пара
- •Температуры кипения и замерзания
- •Осмотическое давление
- •9. Окислительно-восстановительные реакции
- •Прогнозирование окислительно-восстановительных свойств
- •10. Электрохимия
- •Электрохимический ряд напряжений метaллов
- •Гальванический элемент
- •Электролиз
- •Анод – окисление, катод – восстановление.
- •Катодные процессы при электролизе
- •Анодные процессы при электролизе водных растворов веществ
- •Закон Фарадея:
- •Коррозия
- •11. Коллоидные растворы
- •12. Методы анализа химических соединений
- •13. Перечень умений и навыков
- •Часть 2 Приложение
- •В водных растворах (при 298 к)
- •Список литературы
- •Содержание
Электролитическая диссоциация
Электролитическая диссоциация – процесс распада вещества на ионы. Сильные электролиты – диссоциированы полностью. Слабые электролиты – диссоциированы в незначительной степени, находятся в равновесии с недиссоциированной формой.
![]()
Константа диссоциации слабого электролита:

Степень диссоциации слабого электролита – число, показывающее, какая доля молекул электролита находится в растворе в виде ионов:
![]()
Закон разбавления Оствальда:
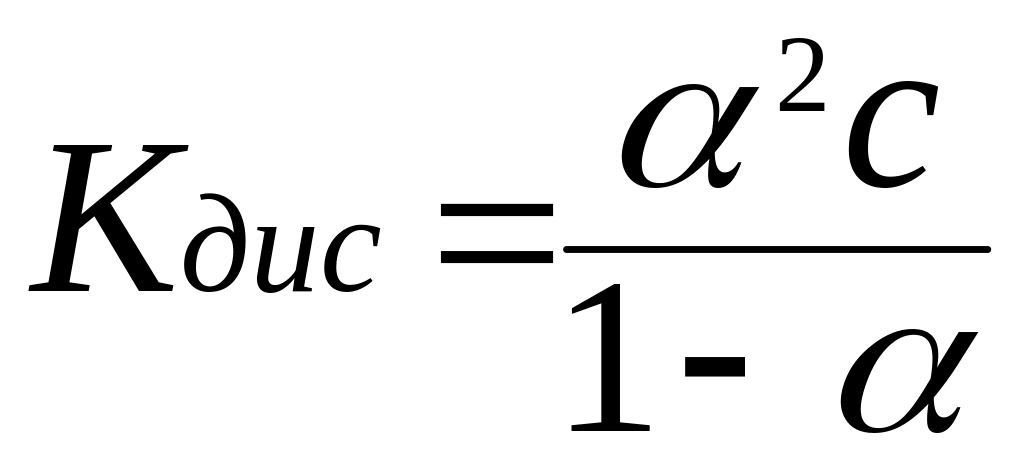
Диссоциация воды как слабого электролита: Н2О ↔ H+ + OH–
Ионное произведение воды: Кw = [H+][OH–] = 10-–14
Водородный показатель рН вычисляется по формулам:
pH = – lg[H+] рН + рОН = 14 pOH = – lg[OH–]
Сильные и слабые электролиты
Классы |
Электрoлиты |
|
сильные |
слабые |
|
Оксиды |
– |
Н2О |
Основания |
Щелочи: NaOH, КОН, Ва(ОН)2 и др. основания s-металлов (за исключением Ве) |
NH4OH, Zn(OH)2, Fe(OH)3 и др. основания p- и d-металлов |
Кислоты |
НСl, HNO3, HBr, H2SO4, HI HClO4 и др. |
HCN, HF, H2S, H2SO3, H3PO4, Н2СО3, HNO2 и др.; органические кислоты |
Соли |
Практически все |
– |
Два вещества будут взаимодействовать друг с другом, если среди продуктов предполагаемой обменной реакции есть:
– трудно- или малорастворимые вещества;
– газообразные вещества;
– слабые электролиты.
Если ни одно из условий не выполняется, реакция происходить не будет.
Например, реакция NaCl + Fe(NO3)3 FeCl3 + NaNO3 происходить не будет, так как ее предполагаемые продукты FeCl3 и NaNO3 – сильные электролиты (соли), хорошо растворимые в воде, а обменное взаимодействие между хлоридом натрия и нитратом серебра будет происходить, так как в результате обмена образуется труднорастворимый хлорид серебра:
NaCl + AgNO3 AgCl + NaNO3.
Правила составления ионных уравнений:
В ионной форме |
В молекулярной форме |
Сильные электролиты, растворимые в воде |
1. Слабые электролиты 2. Трудно- и малорастворимые соединения 3. Газообразные вещества |
Буферные растворы
Растворы, содержащие смесь слабого электролита и его соли, сохраняющие характерные для него значения рН при разбавлении, добавлении сильных кислот и щелочей, называются буферными.
Для системы слабая кислота – соль (например, уксусная кислота СН3СООН и ацетат натрия СН3СООNa) расчет рН ведут по формуле:
 .
.
Для системы слабое основание – соль (например, гидроксид аммония NH4OH и хлорид аммония NH4Cl) рН рассчитывают следующим образом:
 .
.
Произведение растворимости
В насыщенном растворе труднорастворимого сильного электролита произведение концентрации его ионов в степенях стехиометрических коэффициентов при данной температуре есть величина постоянная, называемая произведением растворимости (ПР).
Для системы
![]()
произведение растворимости равно:
![]() .
.
Произведение растворимости характеризует растворимость (S) труднорастворимого сильного электролита при данной температуре. Большей растворимостью обладает та соль, у которой ПР больше.
В общем виде растворимость S труднорастворимого электролита AnBm определяется соотношением:
![]() .
.
