
- •Білет №1 II триместр (§2) Зв’язок між векторами лінійних і кутових швидкостей і прискорень.
- •Білет №2. II триместр (§8) Робота змінної сили. Потужність.
- •Білет№4 II триместр Закон збереження і перетворення енергії в механіці.
- •Білет№5. II триместр (§10) Обертання абсолютно твердого тіла навколо нерухомої осі. Момент інерції
- •Білет№6 II триместр (§11)”Основний закон дінаміки обертального руху”
- •Білет №7. II триместр (§12)”Кінетична енергія обертального руху. Робота при обертанні”
- •Білет№8 II триместр (§13)”Закон збереження моменту імпульсу”
- •Білет №9 II триместр (§14)”Гіроскопічний ефект та його застосування”
- •Білет №10 II триместр (§20)”Середня кінетична енергія молекул. Молекулярно-кінетичне тлумачення температури”
- •Білет №11 II триместр (§21)”Максвелівський розподіл молекул за швидкостями”
- •Білет №12 II триместр (§22) “Бараметрична формула. Больцманівський розпділ частинок у потенціальному полі.”
- •Білет №20 II триместр (§36). Рівняння Вандерваальса та його аналіз. Критичний стан.
- •Білет №21 II триместр §38. Ефект Джоуля-Томпсона. Температура інверсії.
- •Білет №22 II триместр §43. Закон Дюлонга і Пті.
- •Білет №23 II триместр §45. Криві фазової рівноваги. Рівняння Клаперона-Клаузеуса.
- •Білет №24 II триместр §48 . Потік вектора напруженості. Теорема Остроградського-Гаусса.
- •Білет №25 II триместр §50. Робота сил поля при переміщенні зарядів. Потенціал.
- •Білет №26 II триместр §51. Зв’язок між потенціалом і напруженністю поля.
- •Білет №28 II триместр §55.Електричне зміщення. Теорема Остроградського-Гауса для поля в діелектриках.
- •Білет №29 II триместр §58.Енергія електричного поля.
- •Білет №30 II триместр §59.Вектор густини струму. Закон Ома і Джоуля-Ленца в диференціальній формі.
- •Білет № 31 II триместр (§61)“Правила Кірхгофа”
- •Білет № 32 II триместр (§63)”Зв’язок між теплопровідністю та електропровідністю.
- •Білет № 34 II триместр (§70) “Циркуляція вектора напруженості магнітного поля. Поле соленоїда”
- •Білет № 35 II триместр §72. Ефект Хола. (гальваномагнітне явище).
- •Білет № 36 II триместр §73. Контур зі струмом у магнітному полі.
Білет №20 II триместр (§36). Рівняння Вандерваальса та його аналіз. Критичний стан.
PVM=RT
Якщо такий ідеальний газ помістити в циліндр з поршнем і натиснути на поршень, то між поршнем і дном циліндру не буде проміжку, нема об”єму.
При нормальному газі буде проміжок між стислими молекулами
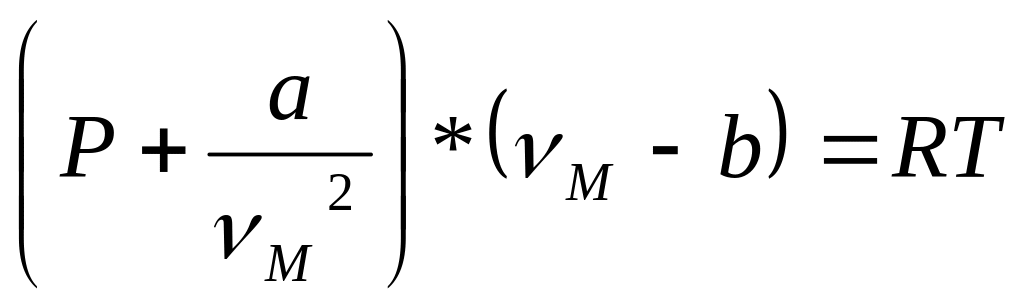 ;
;
a- сили тяжіння між молекулами - сталі Вандерваальса
b- стала яка враховує мласний об”єм молекул
В граничному переході рівняння Вандерваальса переходять у рівняння Менделеєва-Клаперона
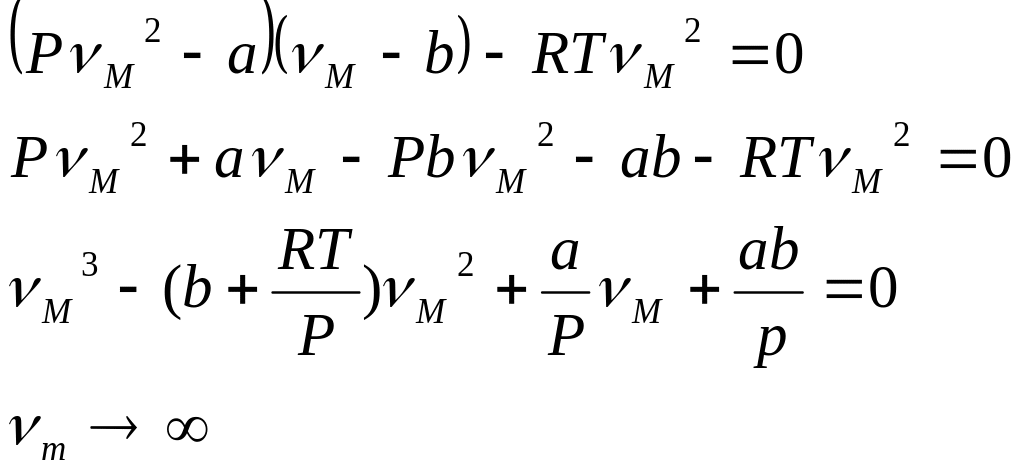
Рівняння третього степеню мусить мати три корені:
3 різних корені дійсних к-крітична точка;
3 корені дійсні рівні;
3 корені: 1- дійсний
2- уявний;
![]()
критичні параметри
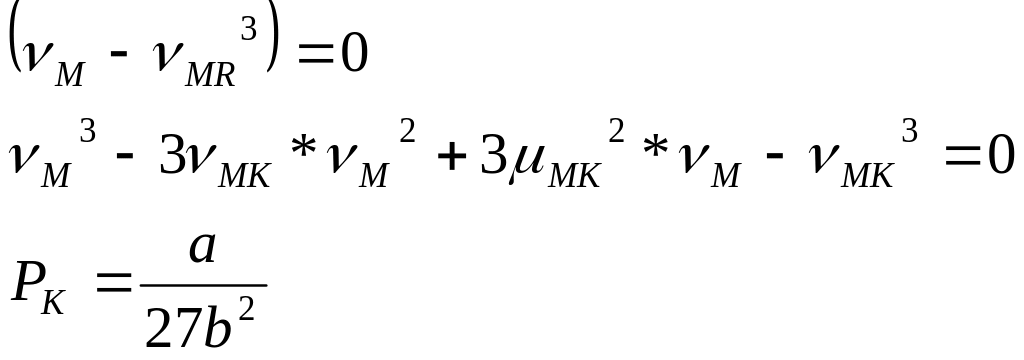
Критичний стан спостерігати: Ендрюс, Менделеєв CO2
Доки CO2 не перетворився повністю на рідину, тиск не зростав.
Рідина майже не стискується.
Спостерігав метостабільні стани. Якщо температура меньше 32 - CO2 давала рідину, якщо вище- неможливо стискування перевести в рідину.
PVM=RT
Властивості критичного стану:
ніяким стиском не можна перевести газ у рідину, якщо його температура вище критичної;
в критичному стані зникає різниця між рідиною і парою (зникає тиск, поверхневий натяг і непотрібна теплота пароутворення);
спочатку критичні параметри, а потім -a,b.
Білет №21 II триместр §38. Ефект Джоуля-Томпсона. Температура інверсії.
Суть ефекта: якщо в процесі різкого зниження тиску у відсутності тіплообміну з навколишнім середовищем температура газу зменьшується – ефект зветься позитивним, якщо підвищується – негативним, якщо не змінюється – нульовим. Цей ефект використовується для охолодження.
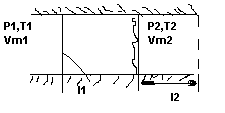
адіабатний процес
dq=0;
A1=F1*L=P1*SL1=P1V1- ЗЛІВА
SL-ОБ”ЄМ
A2=P2V2-справа
Якщо в процесі підвищується тепло товоно іде на виконання роботи і зміну енергії. Тут нема тепла:
А+ Q=0 U2-U1=A1-A2
U2+P2V2=U1+P1V1
U=PV=const ентропія
В процесі адіабатного дросилювання не змінюється ентальний процес
P1Vm1+Vm1=P2Vm2+Vm2
P=![]() ;
T=T2-T1=
;
T=T2-T1=
![]() ;
U=
;
U=![]() ;
;
T=2a/Rb;
T>0 Крива інверсії
Е жект
Дж. Томпсона позитивний застосовується
в промисловості зрідження газів.
жект
Дж. Томпсона позитивний застосовується
в промисловості зрідження газів.
Білет №22 II триместр §43. Закон Дюлонга і Пті.
Mc=3R Атомна теплоємність хімічно чистих кристалічних тіл дорівнює 3R.
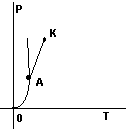
Білет №23 II триместр §45. Криві фазової рівноваги. Рівняння Клаперона-Клаузеуса.
Потрійна точка А К1- РІДКА ФАЗА
 К-
крітична точка К2- ГАЗОПОДІБНА
ФАЗА
К-
крітична точка К2- ГАЗОПОДІБНА
ФАЗА
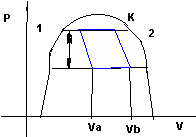
Длля вивода рівняння Клапірона –Клаузеуса здійснемо цикл Карно в двохфазній області.
ВС- Адіабата
ДС-ізотерма, ізобара,
ДА- адіабата
АВ- ізотерма, ізобара
![]()
q1-2- теплота фазового переходу1-2;
V’’,V’- об”єм відповідно фази в т.1і2 Vb-Va=m(V’’-V’)
Питомий об”єм:
![]() ;
dp/dt=q1-2/(T1(V’’-V’));
Рівняння Клаперона клаузиса.
;
dp/dt=q1-2/(T1(V’’-V’));
Рівняння Клаперона клаузиса.
Два фазових переходи:
Першого роду- коли супроводжується поглинання або виделення тепла(сублімація, плавління)
Другого роду – без теплових ефектів( тепло не виділяється і не поглинається)
