
- •О сновы молекулярной физики
- •Архангельск
- •Рассмотрены и рекомендованы к изданию
- •Рекомендации по решению задач расчетно-контрольных заданий
- •Уравнение состояния идеального газа.
- •Основное уравнение молекулярно-кинетической теории газов.
- •Распределение молекул по скоростям и энергиям.
- •Скорость молекул газа.
- •Барометрическая формула. Распределение Больцмана.
- •Основные законы термодинамики.
- •Соотношение между ними определяется уравнением Майера:
- •Адиабатный процесс.
- •Первое начало термодинамики.
- •Второе начало термодинамики.
- •Явления переноса.
- •Поверхностное натяжение. Капиллярные явления.
- •Примеры решения задач
- •Подставив в эту формулу числовые значения величин, найдем
- •Произведя вычисления по этой формуле, найдем
- •Сделав подстановку значений величин, получим
- •После вычисления по формуле (4) найдем
- •Задачи расчетно-контрольных заданий
- •1. Уравнение состояния идеального газа.
- •4. Распределения Максвелла
- •11. Поверхностное натяжение.Капиллярные явления.
Примеры решения задач
Пример 1. Определить: 1) число N молекул воды, занимающей при температуре t=4 °С объем V=1мм3; 2) массу m0 молекулы воды; 3) диаметр d молекулы воды, считая, что молекулы имеют форму шариков, соприкасающихся друг с другом.
Решение. 1. Число N молекул, содержащихся в теле некоторой массы m, равно произведению постоянной Авогадро NА на количество вещества :
N= NА.
Так как =m/, где — молярная масса, то
N=(m/) NА.
Выразив в этой формуле массу как произведение плотности на объем V, получим
N=(V/) NА (1).
Все величины, кроме молярной массы воды, входящие в (1), известны: =1000кг/м3, NА=6,021023 моль-1.
Подставим значения величин в (1) и произведем вычисления;
N = [11031 10-9/1810-3)] 6,021023 молекул = 3,341019 молекул.
2. Массу одной молекулы воды найдем по формуле:
m0=/ NА
Произведя вычисления по этой формуле, получим
m0=1810-3/(6,021023) = 2,9910-26, кг.
3. Будем считать, что молекулы плотно прилегают друг к другу, тогда на каждую молекулу диаметром d приходится объем (кубическая ячейка) V0=d3. Отсюда
![]() .
.
Объем V0 найдем, разделив молярный объем V вещества на число молекул в моле, т. е. на постоянную Авогадро. Молярный объем равен отношению молярной массы к плотности вещества, т. е. V=/. Поэтому можем записать, что
V0==/(NА).
Подставив полученное выражение V0 в формулу (1), получим
![]()
Теперь подставим значения величин в полученную формулу и произведем вычисления:
d=3,l11010 м = 311 пм.
Пример 2. В баллоне объемом V=10 л находится гелий под давлением p1 = l МПа при температуре T1 = 300 К. После того как из баллона был израсходован гелий массой m=10 г, температура в баллоне понизилась до Т2 = 290 К. Определить давление р2 гелия, оставшегося в баллоне.
Решение. Для решения задачи воспользуемся уравнением Клапейрона - Менделеева, применив его дважды к начальному и конечному состояниям газа. Для начального состояния уравнение имеет вид
P1V=(m1/)RT1 (1)
а для конечного состояния –
P2V=(m2 /)RT2 (2)
где m1 и m2 - массы гелия в начальном и конечном состояниях.
Выразим массы m1 и m2 гелия из уравнений (1) и (2):
m1= P1V / RT1 (3)
m2= P2V / RT2 (4)
Вычитая из (3) равенство (4), получим
m = m1 – m2 = (V / R)( P1/ T1 – P2/ T2)
Отсюда найдем искомое давление:
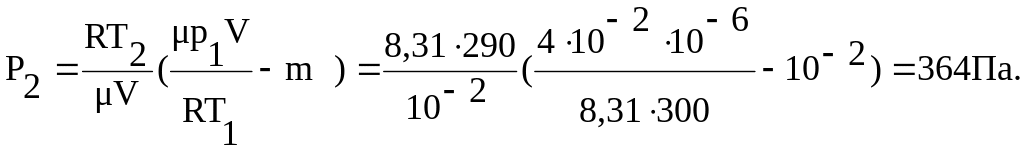
Пример 3. Какая часть молекул кислорода при 00С обладает скоростью от 100м/c до 110 м/с?
Решение. Воспользуемся распределением молекул по относительным скоростям.
![]() ,
,
где u- относительная скорость. В нашем случае v=100 м/с и v=10 м/с. Наиболее вероятная скорость
![]() .
.
Следовательно, u= v/vв=100/376, u2=0,071, exp(-u2)= 0,93. Тогда,
![]()
Т.о., число молекул, скорости которых находятся в заданном интервале, составляют 4% от общего числа молекул.
Пример 4. Частицы гуммигута диаметром 0,310-4см были взвешены в жидкости, плотность которой на 0,2 г/см3 меньше плотности частиц. Температура гуммигута 200С. Найти по этим данным значение числа Авогадро, если в двух соседних слоях, расстояние между которыми 100 мкм, число частиц различается в два раза.
Решение. Проведем расчеты по формуле Больцмана.
![]()
тогда концентрация молекул на высоте h1 определяется как
![]()
на высоте h2
![]()
Отсюда, отношение концентраций определяется следующей зависимостью,
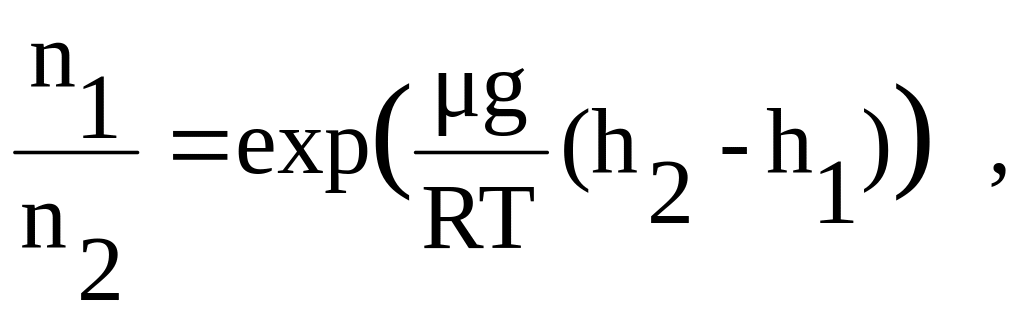 или
или
![]()
Т.к. масса частицы определяется выражением m0 = /NA, то можно записать:
![]()
Из этого выражения, учитывая поправку на силу Архимеда, получим
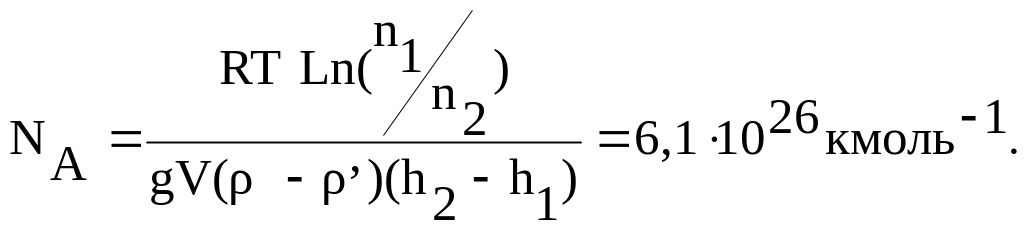
Где и , - соответственно плотность гуммигута и жидкости.
Пример 5. Вычислить удельные теплоемкости Сv и Cp смеси неона и водорода. Массовые доли газов соответственно равны 1=0,8 и 2=0,2.
Решение. Удельную теплоемкость смеси при постоянном объеме СV найдем из следующих рассуждений. Теплоту, необходимую для нагревания смеси на T, выразим двумя соотношениями:
Q = cV(m1 +m2) T (1)
где cV — удельная теплоемкость смеси m1 — масса неона; m2 — масса водорода, и
Q =( cV1m1 +cV2m2) T (2)
где cV1 и cV2 — удельные теплоемкости неона и водорода соответственно.
Приравняв правые части выражений (1) и (2) и разделив обе части полученного равенства на T, найдем
cV (T1 + T2) = cV1m1 + cV2m2
откуда
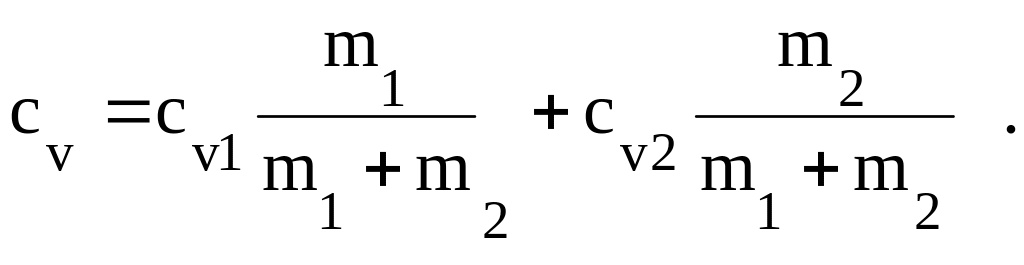
Отношения =m1(m1+m2) и =m2(m1+m2) выражают массовые доли соответственно неона и водорода. С учетом этих обозначений последняя формула примет вид
cv=cv11+cv11.
