
- •Бийский технологический институт (филиал) г.В. Багров, г.И. Севодина, о.Ю. Кравцова общая химическая технология
- •Содержание
- •Введение
- •Цель работы
- •Краткие теоретические сведения
- •Математическое описание процесса
- •Алгоритм решения
- •Задание
- •Контрольные вопросы
- •Лабораторная работа № 2. Исследование процесса восстановления двуокиси углерода углем
- •2.1 Цель работы
- •2.2 Краткие теоретические сведения
- •2.3 Описание кинетики процесса
- •2.4 Задание
- •2.5 Контрольные вопросы
- •Лабораторная работа № 3. Сравнение эффективности работы изотермических реакторов
- •3.1 Цель работы
- •3.2 Краткие теоретические сведения
- •3.3 Математическое описание изотермических реакторов
- •3.4 Задание
- •3.5 Контрольные вопросы
- •Лабораторная работа № 4. Исследование влияния условий проведения газофазной реакции на объем реактора
- •4.1 Цель работы
- •4.2 Краткие теоретические сведения
- •4.3 Математическое описание кинетики процесса
- •4.4 Задание
- •4.5 Контрольные вопросы
- •Лабораторная работа № 5. Расчет неизотермических реакторов
- •5.1 Цель работы
- •5.2 Краткие теоретические сведения
- •5.3 Задание
- •5.4 Контрольные вопросы
- •Лабораторная работа № 6. Реакторы с неидеальной структурой потока
- •6.1 Цель работы
- •6.2 Краткие теоретические сведения
- •6.3 Задание
- •6.4 Контрольные вопросы
- •Лабораторная работа № 7. Обогащение минерального сырья. Флотация
- •7.1 Цель работы
- •7.2 Краткие теоретические сведения
- •7.3 Описание лабораторной установки
- •7.4 Методика проведения работы
- •7.5 Обработка данных
- •7.6 Контрольные вопросы
- •Лабораторная работа № 8. Жесткость воды и еЕ определение. Методы снижения жесткости воды
- •8.1 Цель работы
- •8.2 Краткие теоретические сведения
- •8.3 Описание лабораторной установки
- •8.4 Определение жесткости воды
- •8.5 Обработка данных
- •8.6 Контрольные вопросы
- •Литература
- •А2 Программа № 2
- •А3 Программа № 3
- •А4 Программа № 4
- •А5 Программа № 5
- •А6 Программа № 6
- •А7 Программа № 7
- •А8 Программа № 8
- •А9 Программа № 9
Контрольные вопросы
1. Каковы основные стадии получения серной кислоты в промышленных условиях?
2. Особенности стадии окисления SO2 в SO3.
3. Какие аппараты и катализаторы применяются в промышленности для этой стадии?
4. Какими путями можно достичь повышения степени превращения SO2?
5. Что такое линия оптимальных температур?
6. Назовите способы осуществления оптимального температурного режима.
Лабораторная работа № 2. Исследование процесса восстановления двуокиси углерода углем
2.1 Цель работы
Целью данной работы является определение области протекания гетерогенного процесса восстановления двуокиси углерода на угле.
2.2 Краткие теоретические сведения
Газификация производится для получения из малоценного твердого топлива генераторных газов, которые являются беззольным, транспортабельным топливом и сырьем для химических синтезов.
Различают:
- газификацию при помощи воздуха CО2
+ C
![]() 2CO - Q;
2CO - Q;
- газификацию водяным паром С + H2O(пар) CO + H2 – Q.
Этот обратимый, эндотермический, гетерогенный процесс может быть осложнён как внешним, так и внутридиффузионным торможением. Для правильного выбора технологического режима этого процесса необходимо знать, какая стадия определяет скорость процесса –химическая кинетика или подвод реагентов к поверхности раздела фаз. При низких и средних температурах процесс газификации идет в кинетической области, т.е. лимитируется скоростью химических реакций. При увеличении температуры коэффициент скорости химической реакции возрастает в несколько раз быстрее, чем коэффициент диффузии, поэтому при определенной для данных условий температуре (примерно 900 оС) скорость реакции уравнивается со скоростью диффузии (а при более высоких температурах превышает последнюю). При температуре выше 1000 оС процесс протекает в диффузионной области.
Поэтому так же, как и в ряде других случаев взаимодействия газа с твердым материалом, скорость газификации зависит в основном от поверхности газификации, диффузии активного газового компонента (углекислого газа, водяного пара) к углероду топлива и от интенсивности перемешивания фаз.
Задача определения области протекания процесса может быть облегчена, если известны его кинетические закономерности. В этом случае результаты эксперимента необходимо сопоставить с теоретическими расчетами, проведенными по уравнению, описывающему химическую кинетику процесса.
2.3 Описание кинетики процесса
Уравнение химической кинетики восстановления двуокиси углерода, найденное на основании представлений о механизме реакции при отсутствии диффузионных торможений и с учетом неоднородности поверхности, имеет вид:
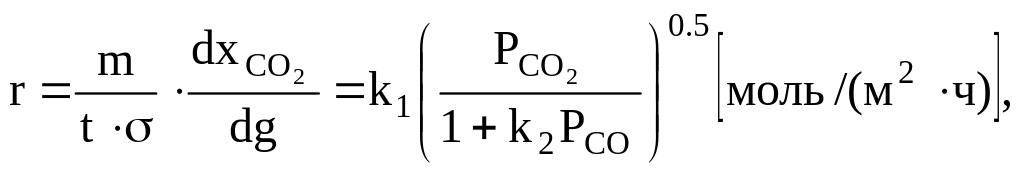
(2.1)
где т – число молей СО2, поступающих в реактор за время t;
![]() –
удельная поверхность угля, м2/кг;
–
удельная поверхность угля, м2/кг;
g – масса угля, кг;
t – время, ч;
![]() –
степень превращения С02;
–
степень превращения С02;
![]() ,
,
![]() –
парциальные
давления СО2
и СО, атм.
–
парциальные
давления СО2
и СО, атм.
Константы прямой и обратной скоростей реакции зависят от температуры процесса и определяются по уравнениям:

(2.2)
Уравнение кинетики дает возможность рассчитать скорость реакции восстановления двуокиси углерода при заданной температуре опыта в интервале парциальных давлений СО2:
[атм.]![]()
Для численного решения уравнения (2.1) преобразуем его таким образом, чтобы в него была введена независимая переменная – время пребывания.
Подставим в уравнение (2.1) выражение для dg:
dg=![]() dV,
(2.3)
dV,
(2.3)
где – насыпная масса угля, кг/м3;
dV – изменение объема массы g угля в процессе реакции, м3.
Объем реакционной массы связан с временем пребывания в реакционной зоне следующим соотношением:
dV=vo d , (2.4)
где v0 – объемный расход газа через слой угля, м3/ч.
Таким образом, изменение массы угля как функции времени выразится зависимостью:
dg= vo d . (2.5)
После подстановки выражения (2.5) в уравнение (2.1) получим:
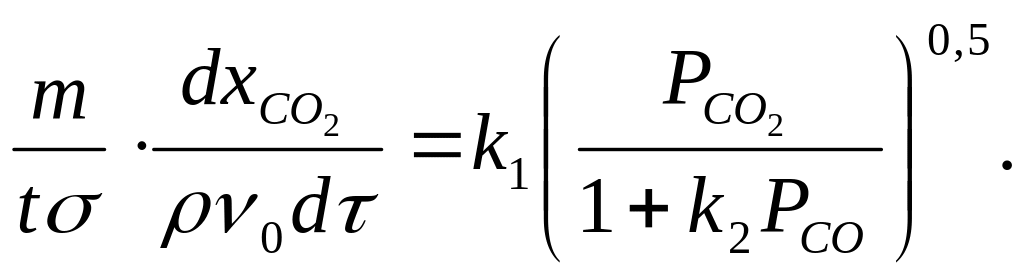 (2.6)
(2.6)
У читывая,
что величины m,
t,
,
,v0
постоянны
для выбранных условий опыта, обозначим
читывая,
что величины m,
t,
,
,v0
постоянны
для выбранных условий опыта, обозначим
![]() .
Если в уравнении (2.6) выразить
концентрации компонентов газовой смеси
через степень превращения
.
Если в уравнении (2.6) выразить
концентрации компонентов газовой смеси
через степень превращения
(2.7)
то получим:
 .
(2.8)
.
(2.8)
Решая уравнение (2.8) численным методом,
можно найти зависимость
![]() или
или
![]() .
Исследование процесса восстановления
СО2 с помощью уравнения (2.8)
необходимо провести для случая с
неподвижным слоем твердого реагента,
в качестве которого применяется
активированный уголь марки БАУ с
характеристиками: насыпная плотность
р =260 кг/м3, удельная поверхность
=57
.103 м2/кг. Процесс
проводится при температуре Т = 1000 К.
Принять
.
Исследование процесса восстановления
СО2 с помощью уравнения (2.8)
необходимо провести для случая с
неподвижным слоем твердого реагента,
в качестве которого применяется
активированный уголь марки БАУ с
характеристиками: насыпная плотность
р =260 кг/м3, удельная поверхность
=57
.103 м2/кг. Процесс
проводится при температуре Т = 1000 К.
Принять
![]() .
.
При определении времени пребывания для достижения заданной степени превращения задача сводится к вычислению интеграла вида:
 ,
(2.9)
,
(2.9)
где f(x) – правая часть уравнения (2.8).
