
- •Химические свойства некоторых кислородсодержащих соединений галогенов
- •Халькогены
- •История открытия
- •Распространение в земной коре
- •Основные характеристики халькогенов
- •I. Взаимодействие с простыми веществами
- •2) Взаимодействует с металлами
- •Получение кислорода
- •1) Электролизом водных растворов щелочей
- •2) При термическом или каталитическом разложении кислородсодержащих соединений
- •1) Перегонкой жидкого воздуха
- •2) Особо чистый кислород получают электролизом растворов щелочей или электролизом воды
- •Роль кислорода в природе
- •Строение молекулы о3
- •Физические свойства озона
- •Химические свойства озона
- •2) Взаимодействует с металлами
- •5) Качественная реакция на озон – йодокрахмальная реакция
- •Получение озона
- •Применение озона
- •Пероксид водорода h2o2 История открытия пероксида водорода
- •Строение молекулы h2o2
- •Физические свойства пероксида водорода
- •Химические свойства пероксида водорода
- •Получение пероксида водорода
- •Применение пероксида водорода
Окончание лекции № 5
Химические свойства некоторых кислородсодержащих соединений галогенов
HClO хлорноватистая кислота
Получается при растворении хлора в воде:
Cl2 + H2O Combin HCl + HOCl
Нестойкая и легко разлагается:
HOCl Combin HCl + O(атомарный кислород)
Также разлагается при нагревании
HOCl Combin HCl + HClO3
Соли – гипохлориты – получаются при пропускании хлора через раствор щелочей:
Сl2 + KOH → KCl + KClO + H2O
Сl2 + Ca(OH)2 → CaOCl2 (хлорная известь)+ H2O
CaOCl2 + CO2 + H2O → CaCO3 +CaCl2 + HOCl (она и проявляет отбеливающие свойства)
CaOCl2 + HCl → CaCl2 + Cl2 + H2O
HClO2 – хлористая кислота
Очень неустойчива, быстро разлагается даже в разбавленном растворе
HClO2 → HCl + HClO3 + ClO2 + H2O
HClO3 – хлорноватая кислота
Сильная кислота и сильный окислитель – концентрированные растворы воспламеняют дерево
Соли – хлораты –менее сильные окислители, хорошо растворимы в воде, ЯДОВИТЫ
KClO3 – бертоллетова соль. Легко разлагается:
KClO3 Combin KCl + KClO4
В присутствии катализатора (MnO2) разлагается с выделением кислорода:
KClO3 Combin KCl + O2
Получают хлораты, пропуская хлор через горячий раствор щелочей
Сl2 + KOH Combin KCl + KClO3 + H2O
При нагревании хлораты – сильные окислители. С серой, углеродом, фосфором бертоллетова соль образует взрывные смеси (при ударе) – используются как запалы в оружии.
Головки спичек на 50 % состоят из KClO3 (а также серы, молотого стекла и клея). Коробок покрыт смесью красного фосфора, Sb2S3, Fe2O3, SiO2 и клея. При трении фосфор загорается, поджигая состав головки, а затем дерево:
S + KClO3 → SO2 + KCl
P + KClO3 → P2O5 + KCl
HClO4 – хлорная кислота
Одна из самых сильных кислот. Устойчива при концетрации 57 %. 100 %-я взрывается при хранении. Но растворы устойчивы.
Безводная HClO4 – очень сильный окислитель.
Разлагается при нагревании:
HClO4 Combin ClO2 + O2 + H2O
Получается действием серной кислоты на перхлорат калия:
KClO4 + H2SO4 → HClO4 + KHSO4
Соли – перхлораты – в растворе не проявляют сильных окислительных свойств, но в сухом виде при спекании – очень сильные окислители.
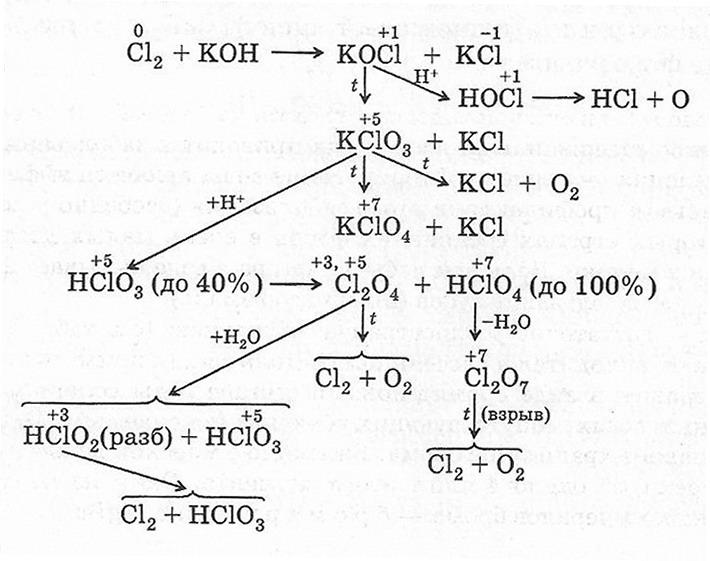
Схема химических превращений кислородсодержащих соединений хлора
Халькогены
(гр. "рождающие медную руду")
Элементы главной подгруппы VI группы – O, S, Se, Te, Po
История открытия
Кислород (O) – "рождающий кислоту (гр.)" – 1772 К. Шееле (швед.), независимо от него 1774 Дж. Пристли (англ.)
Сера (S) - "сульфур (лат.)" – известна с 5 тысячелетия до н.э.
Селен (Se) - "луна (гр.)" – 1817 Й. Я. Берцелиус (швед.)
Теллур (Te) - "земля (лат.)" – 1798 М. Клапрот (нем.)
Полоний (Po) – в честь Польши – 1898 М. Склодовская-Кюри (польск.)
Распространение в земной коре
O – 47 %. Самый распространенный элемент. В свободном состоянии – в воздухе (21 % объемн.) – 1015 т в атмосфере. H2O, SiO2, силикаты, минералы (более 1400), в виде озона О3 , во всех живых существах (как макроэлемент)
S – 0,05 %. Самородная сера S, сульфиды металлов (FeS2, CuFeS2, ZnS, PbS и др.); сульфаты металлов (CaSO4·2H2O – гипс, Na2SO4·10H2O – глауберова соль, CaSO4, MgSO4 – в природных водах); SO2 и H2S – в вулканических газах
Se – 8·10-5 %. Селениды – примеси к сульфидным рудам
Te –10-7 %. В виде теллуридов в минералах золота и серебра
Po – изотоп 210Po в следовых количествах сопутствует урановым рудам. Это продукт радиоактивного распада
