
- •Закон Больцмана о равномерном распределении энергии по степеням свободы
- •Внутренняя энергия термодинамической системы
- •Работа и теплота
- •Первое начало термодинамики
- •Работа газа при изменении его объема
- •Графическое изображение работы
- •Теплоемкость
- •Молярные теплоемкости при постоянных объеме и давлении
- •Уравнение Майера
- •Температурная зависимость молярных теплоемкостей
- •Применение первого начала термодинамики к изопроцессам
- •Адиабатный процесс
- •Политропный процесс
- •Круговой процесс (цикл) Обратимые и необратимые процессы
- •Коэффициент полезного действия для кругового процесса
- •Энтропия
- •Неравенство Клаузиуса
- •Изменение энтропии в изотермическом и изохорном процессах
- •Второе начало термодинамики
- •Третье начало термодинамики
- •Тепловой двигатель. Теорема Карно
- •Принцип работы теплового двигателя
- •Термический кпд цикла Карно
Температурная зависимость молярных теплоемкостей
Из формул (34) и (36) следует, что молярные теплоемкости определяются лишь числом степеней свободы и не зависят от температуры. Это утверждение молекулярно-кинетической теории справедливо в довольно широком интервале температур лишь для одноатомных газов. Уже у двухатомных газов число степеней свободы, проявляющееся в теплоемкости, зависит от температуры. Молекула двухатомного газа обладает тремя поступательными, двумя вращательными и одной колебательной степенями свободы.
Рассмотрим качественную экспериментальную зависимость CV водорода от температуры.
Согласно
закону равномерного распределения
энергии по степеням свободы для
комнатных температур CV
=
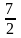 R.
Из рисунка 9 следует, что CV
зависит от температуры: при низкой
температуре (~50 К) CV
=
R.
Из рисунка 9 следует, что CV
зависит от температуры: при низкой
температуре (~50 К) CV
=
 R,
при комнатной CV
=
R,
при комнатной CV
=
 R,
(вместо расчетных -
R!)
и при очень высокой CV
=
R
. Это можно объяснить, предположив, что
при низких температурах наблюдается
только поступательное движение молекул,
при комнатных — добавляется их вращение,
а при высоких — к этим двум видам движения
добавляются еще колебания молекул.
R,
(вместо расчетных -
R!)
и при очень высокой CV
=
R
. Это можно объяснить, предположив, что
при низких температурах наблюдается
только поступательное движение молекул,
при комнатных — добавляется их вращение,
а при высоких — к этим двум видам движения
добавляются еще колебания молекул.

Рисунок 9 – Зависимость CV водорода от температуры
Значения i, CV , Cp и γ = Cp / CV при комнатной температуре
Газ |
i |
CV |
Cp |
γ |
Одноатомный |
3 |
|
|
1,67 |
Двухатомный |
5 |
|
R |
1,4 |
Многоатомный |
6 |
3R |
4R |
1,33 |
i
— число степеней свободы; CV
— молярная теплоемкость при постоянном
объеме; Ср
— молярная теплоемкость при постоянном
давлении; γ=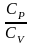 - характерное для каждого газа отношение.
- характерное для каждого газа отношение.
Применение первого начала термодинамики к изопроцессам
Изохорный процесс (V = const).
Первое начало термодинамики: .
При
изохороном процессе газ не совершает
работы над внешними телами:
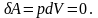
Следовательно:
 , (38)
, (38)
т.е. теплота, сообщенная газу в изохорном процессе, идет на увеличение его внутренней энергии.
Для произвольной массы газа, учитывая (33), получим:
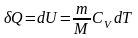 . (39)
. (39)
Изобарный процесс (p = const).
При изобарном процессе работа газа при увеличении объема от V1 до V2 равна

Из
уравнения Клапейрона—Менделеева:
 получаем:
получаем:
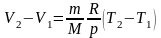 .
.
Тогда выражение для работы при изобарном расширении будет иметь вид:
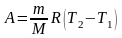 . (40)
. (40)
Физический смысл молярной газовой постоянной.
Если в выражении (40) для работы изобарного расширения T2 – T1 = 1K, то для 1 моль газа R = A, т. е. молярная газовая постоянная R численно равна работе изобарного расширения 1 моль идеального газа при нагревании его на 1 К.
В
изобарном процессе при сообщении газу
массой m
количество теплоты
 его внутренняя энергия возрастает на
величину
его внутренняя энергия возрастает на
величину
 и при этом газ совершает работу
.
и при этом газ совершает работу
.
Изотермический процесс (T = const).
Работа изотермического расширения газа:
 .
.
При T = const внутренняя энергия идеального газа не изменяется:
 .
.
Тогда из первого начала термодинамики получим:
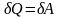 , (41)
, (41)
т.е. все количество теплоты, сообщаемое газу, расходуется на совершение им работы против внешних сил.
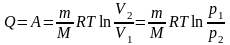 .
(42)
.
(42)
Чтобы при расширении газа его температура не понижалась, к газу в течение изотермического процесса необходимо подводить количество теплоты, эквивалентное внешней работе расширения.

 ,
,