
- •Закон Больцмана о равномерном распределении энергии по степеням свободы
- •Внутренняя энергия термодинамической системы
- •Работа и теплота
- •Первое начало термодинамики
- •Работа газа при изменении его объема
- •Графическое изображение работы
- •Теплоемкость
- •Молярные теплоемкости при постоянных объеме и давлении
- •Уравнение Майера
- •Температурная зависимость молярных теплоемкостей
- •Применение первого начала термодинамики к изопроцессам
- •Адиабатный процесс
- •Политропный процесс
- •Круговой процесс (цикл) Обратимые и необратимые процессы
- •Коэффициент полезного действия для кругового процесса
- •Энтропия
- •Неравенство Клаузиуса
- •Изменение энтропии в изотермическом и изохорном процессах
- •Второе начало термодинамики
- •Третье начало термодинамики
- •Тепловой двигатель. Теорема Карно
- •Принцип работы теплового двигателя
- •Термический кпд цикла Карно
Основы термодинамики
Закон Больцмана о равномерном распределении энергии
по степеням свободы
Число степеней свободы молекул i- число независимых переменных, полностью определяющих положение системы в пространстве.
Число степеней свободы для различных моделей молекул
Газ |
Модель молекулы |
Число степеней свободы |
|||
Посту патель ные (iпост) |
Вращатель ные (iвращ) |
Колебатель ные (iколеб) |
всего |
||
Одноатомный |
М |
3 |
- |
- |
3 |
Двухатомный |
Д точки, жесткая связь |
3 |
2 |
- |
5 |
Двухатомный |
Д точки, нежесткая связь |
3 |
2 |
2 |
7 |
Трехатомный, многоатомный |
Т жесткая связь |
3 |
3 |
- |
6 |
Закон Больцмана о равномерном распределении энергии по степеням свободы
Независимо от общего числа степеней свободы молекул три степени свободы всегда поступательные. Ни одна из поступательных степеней свободы не имеет преимущества перед другими, поэтому на каждую из них приходится в среднем одинаковая энергия, равная 1/3 значения <ε0>:
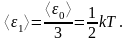
Закон Больцмана: для статистической системы, находящейся в состоянии термодинамического равновесия, на каждую поступательную и вращательную степени свободы приходится в среднем кинетическая энергия, равная kT/2, а на каждую колебательную степень свободы – в среднем энергия, равная kT. Колебательная степень «обладает» вдвое большей энергией потому, что на нее приходится не только кинетическая энергия (как в случае поступательного и вращательного движений), но и потенциальная, причем средние значения кинетической и потенциальной энергии одинаковы.
Таким образом, средняя энергия молекулы:
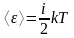 , (22)
, (22)
где i - сумма числа поступательных, числа вращательных и удвоенного числа колебательных степеней свободы молекулы:
i = iпост + iвращ + 2 iколеб.
Внутренняя энергия термодинамической системы
Внутренняя энергия U – это энергия хаотического (теплового) движения микрочастиц системы (молекул, атомов, электронов, ядер и т. д.) и энергия взаимодействия этих частиц.
К внутренней энергии не относятся кинетическая энергия движения системы как целого и потенциальная энергия системы во внешних полях.
Внутренняя энергия – однозначная функция термодинамического состояния системы, т. е. в каждом состоянии система обладает вполне определенной внутренней энергией. Она не зависит от того, что при переходе системы из одного состояния в другое изменение внутренней энергии определяется только разностью значений внутренней энергии этих состояний и не зависит от пути перехода.
В идеальном газе взаимная потенциальная энергия молекул равна нулю (молекулы не взаимодействуют), поэтому внутренняя энергия, отнесенная к 1моль газа, Um равна сумме кинетических энергий NA молекул:
 , (23)
, (23)
где k – постоянная Больцмана; R – молярная газовая постоянная; NA – постоянная Авогадро; i – число степеней свободы молекулы.
Внутренняя энергия произвольной массы m газа:
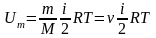 , (24)
, (24)
где m – масса вещества, M – молярная масса; ν – количество вещества.
Работа и теплота
Существуют качественно различные способы изменения внутренней энергии замкнутой термодинамической системы:
Работа, совершаемая над системой - энергия, передаваемая термодинамической системе внешними телами. Например, при движении поршня в цилиндр с газом газ сжимается, его температура повышается, т. е. изменяется (увеличивается) внутренняя энергия газа.
Сообщение теплоты - энергия, передаваемая термодинамической системе внешними телами путем теплообмена. Например, температуру газа и его внутреннюю энергию можно увеличить, сообщая системе некоторое количество теплоты (процесс обмена внутренними энергиями при контакте тел с различными температурами).
Первое начало термодинамики
Первое начало термодинамики — закон сохранения и превращения энергии применительно к термодинамическим процессам.
Первое начало термодинамики: теплота сообщаемая системе, расходуется на изменение ее внутренней энергии и на совершение ею работы против внешних сил:
 . (25)
. (25)
Опыт показывает, что в соответствии с законом сохранения энергии при любом способе перехода системы из первого состояния во второе изменение внутренней энергии ΔU = U2 – U1 будет одинаковым и равным разности между количеством теплоты Q, полученным системой, и работой А, совершенной системой против внешних сил: ΔU = Q - А или Q = ΔU + А.
Запись первого начала в дифференциальной форме:
 (26)
(26)
где dU — бесконечно малое изменение внутренней энергии системы; δА — элементарная работа; δQ — бесконечно малое количество теплоты.
В выражении (5) dU является полным дифференциалом, а δА – элементарная работа и δQ – элементарное количество теплоты таковыми не являются.
Если
система периодически возвращается в
первоначальное состояние, то изменение
ее внутренней энергии
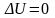 .
Тогда, согласно (25),
.
Тогда, согласно (25),
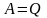 .
.
Вечный двигатель первого рода - периодически действующий двигатель, который совершал бы большую работу, чем сообщенная ему извне энергия.
Еще одна формулировка первого начала термодинамики: вечный двигатель первого рода невозможен.

 атериальная
точка
атериальная
точка ве
материальные
ве
материальные ве
материальные
ве
материальные
 ри
(много) атома,
ри
(много) атома,