
- •Закон Больцмана о равномерном распределении энергии по степеням свободы
- •Внутренняя энергия термодинамической системы
- •Работа и теплота
- •Первое начало термодинамики
- •Работа газа при изменении его объема
- •Графическое изображение работы
- •Теплоемкость
- •Молярные теплоемкости при постоянных объеме и давлении
- •Уравнение Майера
- •Температурная зависимость молярных теплоемкостей
- •Применение первого начала термодинамики к изопроцессам
- •Адиабатный процесс
- •Политропный процесс
- •Круговой процесс (цикл) Обратимые и необратимые процессы
- •Коэффициент полезного действия для кругового процесса
- •Энтропия
- •Неравенство Клаузиуса
- •Изменение энтропии в изотермическом и изохорном процессах
- •Второе начало термодинамики
- •Третье начало термодинамики
- •Тепловой двигатель. Теорема Карно
- •Принцип работы теплового двигателя
- •Термический кпд цикла Карно
Работа газа при изменении его объема
Рассмотрим газ, находящийся под поршнем в цилиндрическом сосуде. Газ расширяясь, передвигает поршень на бесконечно малое расстояние dl, производит над ним работу:
 ,
,
где
S – площадь поршня,
 - изменение объема системы.
- изменение объема системы.
Таким образом, работа газа при изменении его объема:
 . (27)
. (27)
Полная работа при изменении объема от V1 до V2:
 . (28)
. (28)
Выражение (28) справедливо при любых изменениях объема твердых, жидких и газообразных тел.
Графическое изображение работы
Графически можно изображать только равновесные процессы.
Равновесный процесс - процесс, в котором система проходит непрерывный ряд бесконечно близких термодинамически равновесных состояний (изменение термодинамических параметров за конечный промежуток времени бесконечно мало).
Все реальные процессы неравновесны (они протекают с конечной скоростью), но в ряде случаев неравновесностью реальных процессов можно пренебречь (чем медленнее процесс протекает, тем он ближе к равновесному).
И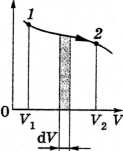 зменение
давления газа при его расширении задано
на рисунке произвольной кривой. При
увеличении объема на dV
совершаемая газом работа равна рdV,
т. е. определяется площадью заштрихованной
полоски. Полная работа, совершаемая
газом при расширении от объема V1
до объема V2,
определяется площадью, ограниченной
осью абсцисс, кривой p(V)
и прямыми V1
и V2.
зменение
давления газа при его расширении задано
на рисунке произвольной кривой. При
увеличении объема на dV
совершаемая газом работа равна рdV,
т. е. определяется площадью заштрихованной
полоски. Полная работа, совершаемая
газом при расширении от объема V1
до объема V2,
определяется площадью, ограниченной
осью абсцисс, кривой p(V)
и прямыми V1
и V2.
Рисунок 8 – Кривая изменения давления газа при его расширении
Теплоемкость
Теплоемкость - величина, определяемая количеством теплоты, которое необходимо сообщить телу (системе), чтобы повысить его температуру на один кельвин:
 [Дж/К]. (29)
[Дж/К]. (29)
Удельная теплоемкость - величина, определяемая количеством теплоты, необходимым для нагревания 1 кг вещества на 1 К
 [Дж/(кгК)]. (30)
[Дж/(кгК)]. (30)
Молярная теплоемкость - величина, определяемая количеством теплоты, необходимым для нагревания 1 моль вещества на 1 К
 [Дж/(мольК)]. (31)
[Дж/(мольК)]. (31)
Связь удельной и молярной теплоемкостей:
 ,
,
где М – молярная масса вещества.
Молярные теплоемкости при постоянных объеме и давлении
Молярная теплоемкость при постоянном объеме.
Запишим первое начало термодинамики для 1 моль газа:
δQ = dU + δА,
учтем, что
δA = рdV, и ,
получим:
Cm dT = dUm + p dVm . (32)
При V = const работа внешних сил равна нулю и сообщаемая газу извне теплота идет только на увеличение его внутренней энергии:
 . (33)
. (33)
Подставив выражение (23) в формулу (33), получим:
 . (34)
. (34)
Уравнение Майера
Если газ нагревается при постоянном давлении, то выражение (32) можно записать в виде:
 .
.
 не
зависит от вида процесса (внутренняя
энергия идеального газа не зависит ни
от р,
ни от V,
а определяется лишь температурой Т)
и всегда равна СV.
не
зависит от вида процесса (внутренняя
энергия идеального газа не зависит ни
от р,
ни от V,
а определяется лишь температурой Т)
и всегда равна СV.
Дифференцируя уравнение Клапейрона-Менделеева pVm = RT по Т (р = const), получаем уравнение Майера:
Ср = СV + R. (35)
Ср всегда больше CV на величину молярной газовой постоянной. Это объясняется тем, что при нагревании газа при постоянном давлении требуется еще дополнительное количество теплоты на совершение работы расширения газа, так как постоянство давления обеспечивается увеличением объема газа.
Учитывая,
что CV
= R,
из уравнения Майера Ср
=
СV
+ R
получим:
R,
из уравнения Майера Ср
=
СV
+ R
получим:
 . (36)
. (36)
 , (37)
, (37)
где
 - характерное для каждого газа отношение.
- характерное для каждого газа отношение.
