
- •Коллоквиум I химичесКая термодинамиКа
- •Коллоквиум I химическая термодинамика теоретическая часть
- •1.1. Химическая термодинамика
- •1.2. Термохимия
- •1.3. Калориметрические измерения
- •1.4. Определение теплоемкости калориметрической системы
- •1.5. Проведение калориметрического опыта и определение изменения температуры
- •1.6. Использование термохимических расчетов для энергетической характеристики биохимических процессов
- •1.7. Второй закон термодинамики
- •1.8. Термодинамические потенциалы
- •1.9. Организм как открытая система. Стационарное состояние организма
- •1.10. Химическое равновесие
- •Работа № 2 изучение равновесия гомогенной реакции в растворе
- •Объемы растворов, взятых для опыта
- •Данные, необходимые для расчета константы равновесия
- •Индивидуальные задания
- •Варианты индивидуальных заданий
1.3. Калориметрические измерения
Основной методикой экспериментальной термохимии является калориметрия. Данный метод позволяет проводить измерение теплоемкостей систем различного состава, тепловых эффектов химических реакций и физико-химических процессов, устанавливать зависимости тепловых эффектов от параметров состояния. Знание теплоемкости в пределах от 0 до T К и тепловых эффектов дает возможность производить все расчеты, относящиеся к равновесиям в технологических процессах. В основе калориметрических измерений лежат законы Гесса и Кирхгофа.
Для указанных измерений используют специальные приборы калориметры (калориметрические установки), в которых очень точно фиксируют изменение температуры (ΔТ) исследуемого процесса в определенном интервале времени.
Важнейшими частями калориметра являются калориметрическая система и защитная оболочка. Последняя уменьшает тепловое взаимодействие прибора с окружающей средой. Калориметрической системой называют совокупность тех частей калориметра, между которыми происходит перераспределение теплоты, подлежащей измерению. Чаще всего калориметрическая система включает: калориметрический стакан, калориметрическую жидкость (например, вода или раствор соли), мешалку, термометр и другие приборы, помещенные в калориметрическую жидкость.
Наиболее распространенными и простыми в обращении являются следующие калориметры:
а) адиабатические, в которых температуру оболочки изменяют так, чтобы она в любой момент времени совпадала с температурой калориметрического сосуда, что исключает теплообмен с окружающей средой;
б) изотермические, в которых оболочка обладает относительно большой удельной теплоемкостью и поэтому сохраняет почти постоянную температуру на протяжении всего опыта.
В практикуме используется калориметр с изотермической оболочкой, простейшая схема которого представлена на рис. 1.1.
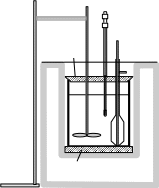
Рис.1.1. Калориметр с изотермической оболочкой.
1 – калориметрический стакан; 2 – изотермическая оболочка; 3 – подставка, 4 – крышка, 5 – мешалка, 6 – термометр, 7 – лапка, 8 – штатив, 9– сосуд для вещества, вносимого в калориметрический стакан.
Изменение температуры в калориметрической установке фиксируется с помощью специальных термометров. Можно использовать термометр Бекмана, который позволяет измерять разность температур в диапазоне 5–6 градусов с точностью до 0,002 градуса. Для того чтобы измерять разность температур в широком интервале (от –30 до 100 С) данный термометр, наряду с традиционным нижним резервуаром для ртути, имеет верхний запасной резервуар, позволяющий перекачивать ртуть из одного в другой, и тем самым увеличивать или уменьшать количество ртути в нижнем резервуаре. Настройку термометра на нужный диапазон температур проводит инженер (лаборант), обслуживающий занятия.
Изменение энтальпии процесса (ΔH°), изучаемого калориметрически в изобарных условиях, рассчитывают по формуле:
|
|
(1.29) |
где
![]() –
теплоемкость калориметрической системы;
Дж/(моль·К), ΔТ–
изменение температуры (°С) калориметрической
системы в результате процесса.
–
теплоемкость калориметрической системы;
Дж/(моль·К), ΔТ–
изменение температуры (°С) калориметрической
системы в результате процесса.
Следовательно, калориметрический опыт сводится к измерению двух величин: изменению температуры и теплоемкости системы.
