
5.4 Равновесия в растворах электролитов
Буферные растворы. Буферными растворами называются растворы, рН которых относительно мало изменяется при добавлении небольших количеств кислоты или основания. Буферные растворы - это смеси растворов слабой кислоты и ее соли, например СНзСООН + СНзСООNа или слабого основания и его соли, например NH4OH + NH4CI.
Рассмотрим процессы, которые протекают при добавлении к буферному раствору кислоты или основания.
В растворе слабой кислоты и ее соли идет диссоциация:
СНзСООН
 СН3СОО-
+ Н+
СН3СОО-
+ Н+
CH3COONa СНзСОО- + Na+
При добавлении кислоты в этот раствор происходит связывание ее ионов водорода ионами СНзСОО- в слабодиссоциирующую кислоту:
Н+ +СНзСОО- СНзСООН
При добавлении в раствор основания, его гидроксид ион связывается ионами Н+ в слабый электролит Н2О:
Н+ + ОН- Н20
Таким образом, при добавлении в буферный раствор кислоты или основания, образуются слабые электролиты, вследствие чего его рН практически не изменяется.
рН буферного раствора, состоящего из раствора слабой кислоты и ее соли рассчитывают по формуле:
pH=pK+lg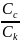
где К дк. - константа диссоциации кислоты,
Сс - концентрация соли,
Ск - концентрация кислоты.
Для буферного раствора, состоящего из раствора слабого основания и его соли, вычисляют рОН:
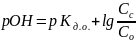
где Кд.о. - константа диссоциации основания,
Сс - концентрация соли,
С„ - концентрация основания.
Каждый буферный раствор имеет определенную буферную емкость. Буферной емкостью называется способность буферного раствора сохранять постоянной величину рН при добавлении к нему растворов кислоты или основания. Она определяется количеством эквивалентных масс кислоты или основания, при прибавлении которых к 1л буферного раствора, изменит величину его рН на единицу.
Реакции в растворах электролитов. Обменные реакции между электролитами практически необратимы и протекают до конца в случае образования осадков, слабодиссоциирующих веществ и газообразных соединений.
Уравнения реакций с участием электролитов записываются в виде системы двух уравнений: молекулярного и ионно-молекулярного. При записи ионно-молекулярных уравнений сильные электролиты записывают в виде сумм составляющих их ионов, формулы слабых электролитов, газообразных, твердых веществ оставляют в молекулярном виде. Составляют полное ионно-молекулярное уравнение, а затем сокращенное, показывая те ионы, которые принимают непосредственное участие в реакции. Например:
СаС03 + 2HCl = СаСl2 + Н20 + С02
СаСОз + 2Н+ + 2Сl- = Са2+ + 2Сl- + Н20 + С02
СаСОз + 2Н+ = Са2+ + Н20 + С02
Если исходными веществами являются слабо диссоциирующие или малорастворимые вещества, то протекают реакции постепенной диссоциации слабого электролита или перехода ионов малорастворимого электролита в раствор, а затем реакции связывания тех или иных ионов этих электролитов в еще более слабо диссоциирующее вещество.
Совокупная запись молекулярного и сокращенного ионного уравнения наглядно отображает химизм реакции. Однако, отдельно записанные сокращенные ионные уравнения отображают не одну реакцию, а множество подобных реакций. Например:
Ва2+ + S042- = BaS04
К данному сокращенному ионному уравнению можно подобрать несколько молекулярных уравнений:
ВаСl2 + H2S04 = BaS04 + 2HCl
BaBr2 + K2S04 = BaS04 + 2KBr
Произведение растворимости. Растворение твердой соли в воде происходит до образования насыщенного раствора. При этом устанавливается динамическое равновесие между твердой солью и перешедшими в раствор ионами. Например: MgS Mg 2+ + S2-
Поскольку в растворах электролитов состояние ионов определяется их активностями, то константа равновесия указанного процесса выразится следующим уравнением:
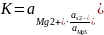
Так как активность твердого сульфида магния представляет собой постоянную величину, то константа равновесия этого процесса будет определяться только произведением активностей ионов в растворе:
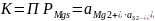
Произведение активностей ионов малорастворимого электролита, содержащихся в его насыщенном растворе, есть величина постоянная при данной температуре. Эта величина количественно характеризует способность электролита растворяться и называется произведением растворимости электролита ПР. Произведение растворимости зависит от природы растворенного вещества и растворителя, температуры и не зависит от активностей ионов в растворе.
Если электролит очень мало растворим, то ионная сила его насыщенного раствора близка к нулю, а коэффициенты активности мало отличаются от единицы. В подобных случаях произведение активностей ионов в выражении для ПР можно заменить произведением их концентраций. Введем это обозначение, получим: ПРMgS=CMg2+ CS2-
Знание произведения растворимости позволяет решать вопросы, связанные с образованием или растворением осадков. Условием образования осадка является превышение произведения концентраций ионов малорастворимого электролита над его произведением растворимости. Растворение осадка малорастворимого электролита происходит при условии, что произведение концентраций его ионов меньше значения ПР.
Задача. Произведение растворимости MnS при 25°С равно 5,6 10-16 . Образуется ли осадок MnS при смешении равных объемов 0,002Н Mg(NOз)2 и 0.0004Н Na2S растворов? Степени диссоциации этих электролитов принять равными единице.
Решение.
При смешении равных объемов растворов объем смеси стал в 2 раза больше, а концентрация каждого из растворенных веществ уменьшилась вдвое и оказалась равной СMg(NO3)2 = 0,001Н, CNa2S =0,0002H. Переведем нормальную концентрацию растворов в молярную:
СMn(NO3)2=0,001Н = 0,0005М, CNa2S= 0,0002Н = 0,0001М.
Концентрации ионов Мn2+ и S2- соответственно равны: СMn2+ = 5 10-4 моль/л, Cs2- =1 10-4 моль/л.
Произведение концентраций ионов Мn2+ и S2-
СMn2+ СS2- =5 10-4 1 -4 = 5 10-8
больше, чем ПРMnS , следовательно, осадок MnS образуется.
Гидролиз солей. Химическое обменное взаимодействие ионов растворенной соли с водой, приводящее к образованию слабодиссоциирующих веществ, называется гидролизом.
Различают следующие случая гидролиза.
Гидролиз соли, образованной слабым основанием и сильной кислотой; протекает по катиону. Реакция среды будет кислой рН < 7.
Пример.
Рассмотрим гидролиз соли NH4NO3. При составлении уравнения гидролиза в первую очередь необходимо определить ионы соли, связывающие ионы воды (Н+ и ОН-) в слабо диссоциирующие соединения, т.е. ионы, обуславливающие гидролиз. В данном случае ионы NH4+ связывают гидроксид-ион, образуя молекулы слабого основания NH4OH, и обуславливают гидролиз соли NH4NO3.
Молекулярно - ионное уравнение гидролиза:
NH4+ + НОН NH4OH + Н+
Уравнение гидролиза в молекулярной форме:
NH4N03 + НОН NH4OH + HNO3
Избыток ионов Н+ в растворе обуславливает кислую реакцию раствора, рН < 7.
Количественно гидролиз можно оценить по константе гидролиза Кг. Константа гидролиза Кг соли слабого однокислотного основания и сильной кислоты вычисляется по формуле:
Кг = КH2O/Косн
где КH2O - ионное произведение воды,
Косн. - константа диссоциации основания.
Например, константа гидролиза нитрата аммония NH4N03 равна
Кг = 10-14 /(1,77 10-5) = 5,65 10-10, где КNH40Н= 1,77 -5 Чем слабее основание, тем в большей степени подвергаются гидролизу образованные им соли.
Для соли, образованной слабым многокислотным основанием и сильной кислотой, число возможных стадий гидролиза определяет заряд катиона.
Пример.
При гидролизе соли СuСl2 ионы Сu2+ соединяются с ионами ОН- ступенчато, гидролиз соли СuСl2 протекает в две ступени:
Си2+ + Н20 СuОН+ + Н+
СuСl2 + Н20 CuOHCl + HCl
CuOH+ + H20 Cu(OH)2 + Н+
CuOHCl + H20 Cu(OH)2 + HCl
Практически гидролиз останавливается на первой стадии ввиду накопления в растворе ионов Н+ , что приводит к смещению гидролитического равновесия влево.
В константу гидролиза по первой ступени входит константа диссоциации слабого электролита по последней ступени, т.е. в данном примере вторая константа диссоциации Си(ОН)2. Таким образом
Kr1 = КН20/Косн.2
Константа гидролиза по второй ступени определяется значением первой константы диссоциации слабого электролита
Кr2 =К Н20 / Косн 1
Константа гидролиза по первой ступени значительно выше, чем по остальным ступеням. Поэтому при приближенных расчетах можно принимать во внимание только гидролиз по первой ступени.
2.Гидролиз соли, образованной слабой кислотой и сильным основанием; протекает по аниону. Реакция среды будет щелочной рН > 7.
Пример.
При растворении соли CH3COONa гидролизу подвергается анион СН3СОО- , связывая ионы Н+ воды в слабо диссоциирующую уксусную кислоту. Молекулярно - ионное уравнение гидролиза:
СНзСОО- + Н20 СНзСООН + ОН-
Уравнение гидролиза в молекулярной форме:
CH3COONa + Н20 СН3СООН + NaOH
Константа гидролиза связана с константой диссоциации одноосновной кислоты соотношением Кг = Кн2о / Ккисл.
Чем больше Кг., тем в большей степени протекает гидролиз.
Гидролиз соли, образованной слабой многоосновной кислотой и сильным основанием, протекает ступенчато, число ступеней определяет заряд аниона. Пример.
При гидролизе соли К2СОз анионы СО3- связывают водородные ионы воды, гидролиз протекает в две ступени:
С032- + Н20 HCO3- + OH-
К2С03 + Н20 КНСОз + КОН
HCO3- + Н20 Н2С03 + ОН
КНСОз + Н20 Н2СО3 + КОН
Практически гидролиз ограничивается первой ступенью.
3. Гидролиз
соли, образованной слабым
основанием и слабой
кислотой, протекает
одновременно по катиону и
аниону.
Реакция среды
может быть как
слабокислой, так и
слабо
щелочной в зависимости от
степени
диссоциации образовавшихся слабых
электролитов (рН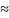 7).
Пример.
7).
Пример.
Гидролиз соли Zn(CH3COO)2 выражается уравнениями:
Zn2+ + 2 СНзСОО- + Н20 ZnOH+ + СН3СООН + СН3СОО-
Zn(CH3COO)2 + H20 ZnOHCH3COO + CH3COOH
ZnOH+ + СН3СОО- + Н20 Zn(OH)2 + СН3СООН
ZnOHCH3COO + H20 Zn(OH)2 + CH3COOH
Гидролиз соли, образованной слабым основанием и слабой кислотой протекает практически до конца.
Константу гидролиза соли слабого однокислотного основания и слабой одноосновной кислоты рассчитывают по формуле:
Кг = КH2O / Ккисл Косн
4. Гидролиз соли, образованной сильным основанием и сильной кислотой не протекает, т.к. в растворе не образуются слабые электролиты.
К+ + Сl- + Н20 К+ + ОН- + Н+ + Сl-
Гидролиз является обратимым процессом, поэтому, при разбавлении раствора водой, в соответствии с принципом Ле-Шателье, равновесие смещается вправо.
Гидролиз усиливается при повышении температуры и наиболее полно протекает для солей, образованных слабым основанием и слабой кислотой.
Количественно
гидролиз можно оценить также по степени
гидролиза
 .
Степень гидролиза - это отношение
концентрации гидролизо-ванных молекул
соли к исходной концентрации растворенной
соли. Степень гидролиза зависит от
природы соли, ее концентрации, температуры
раствора.
.
Степень гидролиза - это отношение
концентрации гидролизо-ванных молекул
соли к исходной концентрации растворенной
соли. Степень гидролиза зависит от
природы соли, ее концентрации, температуры
раствора.
Степень гидролиза связана с константой гидролиза Кг и концентрацией С соотношением: Кг = 2С /(1- )
Чаще всего концентрация гидролизованных молекул соли мала, тогда 1 и Кг = 2С. Отсюда следует, что
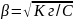
Из последнего уравнения следует, что степень гидролиза соли тем больше, чем меньше ее концентрация.
Для ослабления гидролиза, растворы следует хранить концентрированными и при низких температурах. Подавлению гидролиза способствует подкисление (для соли, образованной сильной кислотой и слабым основанием) или подщелачивание (для соли, образованной слабой кислотой и сильным основанием) раствора.
Задача.
При смешивании растворов Al2(S04)3 и Nа2СОз каждая из взятых солей гидролизуется необратимо до конца с образованием соответствующих основания и кислоты. Составьте ионно-молекулярное и молекулярное уравнение происходящего совместного гидролиза.
Решение.
Соль Al2(S04)3 гидролизуется по катиону, а Na2C03 - по аниону:
Аl3+ + Н20 АlН2+ + Н+
СОз2- + Н2O НСОз-+ ОН-
Если растворы этих солей смешать, то идет взаимное усиление гидролиза каждой из них, т.к. ионы Н+ и ОН- образуют молекулу слабого электролита Н20. При этом гидролитическое равновесие сдвигается вправо, и гидролиз каждой из солей идет до конца с образованием Аl(0Н)з и С02.
Ионно-молекулярное уравнение:
2 Аl3+ + З СО32- +З Н20 = 2Аl(0Н)3 +З С02.
Молекулярное уравнение:
Al2(S04)3 + 3 Na2C03 +3 Н20 = 2 Аl(0Н)3 + 3 С02 + 3 Na2SO4
Выводы.
Основным фактором, влияющим на смещение равновесия в растворах электролитов, является изменение концентраций ионов. Обменные реакции в растворах протекают в сторону образования малорастворимых или слабо диссоциирующих веществ.
Используя величину ПР, можно вычислить концентрацию сильного электролита, необходимого для осаждения малорастворимого электролита. При постоянной концентрации одного из ионов малорастворимого электролита, следует повысить концентрацию второго иона, добавляя сильный электролит с одноименным ионом. Например, это применяют для умягчения воды методом осаждения. При введении в воду реагентов, обогащающих ее анионами СО32-, ОН-, до концентрации превышающих ПРCaCO3 или ПРMg(OH)2 , происходит связывание ионов Са2+, Mg 2+ и вода становится менее жесткой.
Буферные растворы играют важную роль в природе и технике. При проведении многих технологических процессов рН среды поддерживают постоянным при помощи буферных растворов.
Гидролиз используется в технике, например, для получения спиртов, мыла и др. веществ. Реакции гидролиза протекают при расщеплении пищи в желудочно-кишечном тракте.
Влияние реакций гидролиза следует учитывать при эксплуатации судовых силовых установок.
