
5.2 Свойства растворов неэлектролитов
Влияние нелетучего растворенного вещества на свойства растворителя в разбавленных растворах проявляется в их коллигативных свойствах: понижение давления пара растворителя, повышение температуры кипения раствора, понижение температуры замерзания раствора, явление осмотического давления. Эти свойства называются коллигативными потому, что они зависят от количества имеющихся молекул или ионов растворенного вещества, а не от природы растворенных частиц.
Если взаимодействие между разносортными молекулами в растворе не отличается от взаимодействия между молекулами каждого из его компонентов, то раствор называется идеальным.
Понижение давления пара растворителя. Когда чистая жидкость В находится в равновесии со своим паром, свободная энергия жидкого и парообразного вещества В должна быть одинакова. Испарение и конденсация происходят с одинаковой скоростью. Если к жидкости добавляется небольшое количество нелетучего растворенного вещества А, свободная энергия или способность к испарению вещества В в растворе понижается, т.к. концентрация растворителя снижается и, следовательно, уменьшается способность его молекул покидать жидкую фазу. Однако, обратная тенденция, конденсация пара в жидкость, остается неизменной, потому что в паровой фазе отсутствуют молекулы вещества А.
К
этой ситуации можно применить принцип
Ле-Шателье. При разбавлении растворителя
нелетучим растворенным веществом,
положение равновесия смещается в таком
направлении, чтобы восстановить
концентрацию растворителя до его
первоначального значения. Равновесие
системы: Н2О(ж)
 Н20(пар)
смещается в направлении большей
конденсации пара.
Н20(пар)
смещается в направлении большей
конденсации пара.
Давление насыщенного пара растворителя над раствором всегда ниже, чем над чистым растворителем при той же температуре.
Закон Рауля. Относительное понижение давления насыщенного пара растворителя над раствором равно молярной доле растворенного вещества.
Понижение давления пара растворителя В, вызываемое присутствием растворенного вещества А, определяется соотношением:

Где N – молярная доля вещества A,
P0 - давление насыщенного пара над чистым растворителем,
Р - давление над раствором.
Задача. Давление пара воды при 30°С составляет 4245,2Па. Какую массу сахара С12Н22О11 следует растворить в 800 г воды для получения раствора, давление пара которого на 33,3 Па меньше давления пара воды?
Решение.
Относительное понижение давления пара растворителя над раствором равно:
По этой формуле вычислим молярную долю:

С другой стороны, молярную долю определяют по формуле (1)
где n1- число молей растворенного вещества,
п2 - число молей растворителя.
Число молей вычисляют по формуле: n = m/М, где m - масса вещества, М - молярная масса вещества.
Молярные масса сахара и воды соответственно равны 342 г/моль и 18 г/моль.
Вычислим число молей растворителя:n2 = 800 : 18 = 44,44 моль. Преобразуем формулу (1) относительно n1

После подстановки числовых значений, получим:

Вычислим массу сахара по формуле n1 = m/М, откуда m = n1 М, m = 0,349 342 = 119,48 г.
Повышение температуры кипения раствора. Жидкость начинает кипеть при той температуре, при которой давление ее насыщенного пара равно внешнему давлению.
Допустим, что давление пара чистого вещества В равно внешнему давлению (1) и точка Т кип. представляет собой температуру кипения чистой жидкости. Если добавить вещество А, то давление пара растворителя В уменьшится (2). Это давление меньше атмосферного, поэтому при температуре Т кип. раствор уже не кипит. Чтобы заставить его снова кипеть, необходимо повысить его температуру, давление пара снова станет равным атмосферному (3). См. рис.14.

Рис. 14.Влияние растворенного вещества на положение кривой равновесия жидкость
- пар для растворителя. Температура кипения раствора, Т'кн„ выше, чем
температура кипения чистого растворителя, Ткип
Закон Рауля. Для разбавленных растворов изменение температуры кипения прямо пропорционально моляльной концентрации раствора.

где Э - эбуллиоскопическая константа, зависящая от природы растворителя, но не зависящая от свойств растворенного вещества, Сm - моляльная концентрация раствора, моль/кГ.
Задача. Вычислите массовую долю водного раствора глюкозы СбН1206, зная, что этот раствор кипит при 100,26°С. Эбуллиоскопическая константа воды 0,52°.
Решение.
По
закону Рауля:
 =
= -Cm
-Cm
Моляльную концентрацию Сш вычисляют по формуле

где m - масса растворенного вещества,
М - его молярная масса,
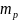 -
масса растворителя.
-
масса растворителя.
После подстановки, получим:

Вычислим массу m растворенного вещества в 1 кГ растворителя (mр = 1000 г)

MC6H12O6=
г/моль;



Массовую долю вычисляют по формуле:

где m - масса вещества, m2 - масса раствора;


Понижение температуры замерзания раствора. Пусть имеется чистая жидкость в равновесии с чистым кристаллическим веществом В, при этом молярная свободная энергия вещества В в обоих фазах одинакова. Однако, если растворитель В разбавлен некоторым количеством молекул растворенного вещества А, то не каждая молекула жидкой фазы, ударяющаяся о поверхность кристаллического вещества В, может достраивать кристалл. Скорость же перехода молекул вещества В из кристаллической фазы в жидкую остается без изменения. Свободная энергия перехода вещества В из одной фазы в другую оказывается ниже для жидкости, чем для кристалла, и равновесие смещается в сторону растворения кристаллического вещества. Новое равновесие достигается только при понижении температуры. См. рис.15. (Вот почему NaCl, разбрасываемый на скользких дорогах, расплавляет лед).
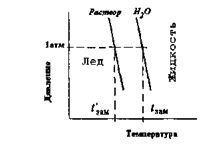
Рис.15, Понижение температуры замерзания раствора
Закон Рауля. Для разбавленных растворов понижение температуры замерзания пропорционально моляльной концентрации раствора.

где К - криоскопическая константа, зависящая от природы растворителя.
Эквимолекулярные количества различных веществ, растворенные в одном и том же количестве растворителя, повышают его точку кипения и понижают точку замерзания на одно и то же число градусов. Например, одномоляльные водные растворы глюкозы и мочевины дают одинаковое повышение температуры кипения раствора 0,52°С.
Указанные выше зависимости лежат в основе эбуллиоскопического и криоскопического методов определения молекулярных масс нелетучих растворимых веществ.
Индивидуальные вещества характеризуются строго определенными температурами кипения и замерзания. Растворы кристаллизуются и кипят в некотором температурном интервале, т.к. изменяется концентрация растворов. Температура кипения тем выше, чем концентрированнее раствор, а температуру начала кипения раствора считают его Т кип., (аналогично - замерзание).
Задача. Вычислите молекулярную массу неэлектролита, зная, что раствор, содержащий 2,25 г этого вещества в 250 г воды, кристаллизуется при -0,279°С. Криоскопическая константа воды 1,86°.
Решение.
Из
закона Рауля следует, что
 =
=

Моляльную концентрацию раствора Сmвычисляют по формуле:
После подстановки, получим:
=
Откуда молекулярная масса растворенного вещества равна:


M=
Осмотическое давление. Осмосом называется односторонняя диффузия через полупроницаемую перегородку, пропускающую, например, молекулы растворителя, а растворенное вещество - нет.
Трубку с полупроницаемыми стенками наполнили раствором сахара и погрузили в сосуд с водой. (См. рис.16) Вследствие осмоса, объем раствора увеличивается, и поднимается столб жидкости в трубке.

Рис.16. Опыт, демонстрирующий осмотическое давление При этом создается гидростатическое давление.
Когда гидростатическое давление станет равным так называемому осмотическому давлению, которое воспрепятствует дальнейшему переходу молекул растворителя, осмос прекратится.
Закон Вант - Гоффа. Осмотическое давление разбавленного раствора неэлектролита равно тому давлению, которое производило бы растворенное вещество, если бы оно при той же температуре находилось в газообразном состоянии и занимало бы объем, равный объему раствора:

где
 -
осмотическое давление,
-
осмотическое давление,
См - молярная концентрация раствора, моль/л;
R - универсальная газовая постоянная,
Т - температура, К.
Осмотическое давление растет с увеличением температуры и концентрации раствора и не зависит от природы растворителя и растворенного вещества.
Зависимость, установленная Вант-Гоффом используется для определения молекулярных масс растворенных веществ, включая и высокомолекулярные соединения.
В явлениях понижения температуры замерзания и повышения температуры кипения растворов, нарушение равновесия, вызываемое добавлением молекул растворенного вещества, компенсируется изменением температуры. При наличии осмотического давления равновесие восстанавливается повышением давления, а не повышением температуры.
Задача. Осмотическое давление раствора, содержащего в 1 л 3,2 г неэлектролита, равно 2,42 -105 Па при 20°С. Вычислите молекулярную массу неэлектролита. Решение. Осмотическое давление раствора определяют по закону Вант - Гоффа.

Молярную концентрацию раствора См вычисляют по формуле:

где m - масса растворенного вещества,
М - его молярная масса,
V - объем раствора.
После подстановки, получим:

Отсюда, молекулярная масса неэлектролита равна:

Осмотическое равновесие на границе «раствор - полупроницаемая перегородка - растворитель» лежит в основе регулирования водного баланса клеток и межклеточных структур, поэтому имеет большое значение в жизнедеятельности организмов и растений. Растворы с одинаковыми значениями осмотического давления называются изотоническими. Растворы с осмотическим давлением, большим, чем у внутриклеточного содержимого, называются гипертоническими, а с меньшим - гипотоническими.
В Морфлоте используется обратный осмос для очистки сточных вод и опреснения морской воды. Суть процесса - раствор под давлением 3 — 8 МПа подается на полупроницаемую мембрану, пропускающую растворитель (воду) и задерживающую полностью или частично молекулы или ионы растворенных веществ. Движущей силой процесса является разность значений внешнего давления над исходным раствором и осмотическими давлениями раствора и фильтрата.
