
Лекция 6.
Окислительно-восстановительные процессы.
Электродные потенциалы. Гальванические элементы. Электролиз.
6.1 Степень окисления. Окислители и восстановители.
Окислительно-восстановительными называются реакции, протекающие с изменением степеней окисления атомов элементов, входящих в состав реагирующих веществ.
Степень окисления - это тот условный заряд, который приобрел бы атом элемента, если предположить, что он принял или отдал то или иное число электронов. Степень окисления может быть положительной величиной (при отдаче электронов), отрицательной (электроны присоединяются), равной нулю, если атомы элемента образуют простое вещество.
При нахождении степени окисления атомов необходимо учитывать следующие положения:
алгебраическая сумма степеней окисления всех атомов в молекуле равна нулю;
степень окисления атомов в простом веществе равна нулю;
высшая степень окисления элемента совпадает с номером группы периодической системы, в которой он находится;
низшая степень окисления атома элемента определяется тем числом электронов, которое он может принять до образования устойчивой восьмиэлектронной оболочки;
s-элементы проявляют в соединениях постоянную степень окисления, равную номеру группы периодической системы, в которой они находятся;
водород в соединениях проявляет степень окисления +1, исключением являются гидриды СаН2, NaH, где его степень окисления —1;
кислород в соединениях проявляет степень окисления —2, исключениями, например, являются перекись водорода Н202, где кислород имеет степень окисления -1, и другие перекисные соединения; в OF2 кислород имеет степень окисления +2.
Атомы элемента в своей высшей степени окисления могут ее только понизить, принимая электроны, проявляют окислительные свойства.
Атомы элемента в своей низшей степени окисления могут ее только повысить, отдавая электроны, проявляют восстановительные свойства.
Атом же элемента, имеющий промежуточную степень окисления, может проявлять как окислительные, так и восстановительные свойства.
Окислителем является вещество, атомы которого принимают электроны, понижая свою степень окисления. Восстановитель - вещество, атомы которого отдают электроны, повышая свою степень окисления.
Окислителями могут быть неметаллы, ионы металлов в высших степенях окисления, кислородсодержащие кислоты, соли, кислород, водород в степени окисления +1. Например, S, F2, Сl2, Сr6+, КСlO3, КМn04, Н202.
К восстановителям относятся металлы, ионы металлов и неметаллов в низшей степени окисления, бескислородные кислоты, при определенных условиях неметаллы также могут проявлять восстановительные свойства. Например, Li, Al, Zn, Cr2+, Br-, H2, С.
Вещества, содержащие элементы в промежуточной степени окисления, могут проявлять как окислительные, так и восстановительные свойства в зависимости от партнера, с которым они взаимодействуют и от условий проведения реакции. Пример.
Исходя из степени окисления хлора, серы, фосфора в соединениях НСlO3, H2S, H3PO4, определите, какие из них могут быть только окислителями, только восстановителями или проявляют как окислительные, так и восстановительные свойства.
Решение.
Степень окисления хлора в соединении НСlO3 равна +5 (промежуточная), т.е. данное вещество может проявлять как окислительные, так и восстановительные свойства. Степень окисления серы в соединении H2S равна —2 (низшая), сера может только отдавать электроны, поэтому H2S является восстановителем. Степень окисления фосфора в соединении Н3Р04 равна +5 (высшая), фосфор может только принимать электроны, поэтому Н3РО4 является окислителем.
Пример.
Могут ли происходить окислительно-восстановительные реакции между веществами: а) РН3 и HN03, б) КСlO4 и H2S04 ?
Решение.
В соединении РН3 степень окисления фосфора равна -3, низшая, поэтому он проявляет восстановительные свойства. В соединении HNO3 степень окисления азота +5, высшая, он является окислителем. Реакция между этими веществами возможна.
В соединении КСlO4 степень окисления хлора +7, высшая, он является окислителем; в соединении H2S04 степень окисления серы +6, высшая, она также проявляет окислительные свойства, поэтому реакция между ними невозможна.
6.2 Методы составления уравнений окислительно-восстановительных реакций
Процессы окисления и восстановления - взаимосвязаны. Окисление - это отдача электронов, восстановление - их присоединение. Обычно изменения степеней окисления у окислителя и восстановителя отражают в виде электронных уравнений, где показывается переход электронов. Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которое присоединяет окислитель. Отсюда название одного из методов составления окислительно-восстановительных уравнений: метод электронного баланса.
Чтобы уравнять окислительно-восстановительную реакцию, с использованием метода электронного баланса, необходимо:
расставить степени окисления над элементами в соединениях, определить элементы, изменяющие в результате реакции степени окисления;
составить электронные уравнения, показав переход электронов, и получить основные коэффициенты;
расставить основные коэффициенты перед формулами окислителя, восстановителя и продуктов окисления и восстановления;
уравнять металлы, не попавшие в электронные уравнения;
уравнять кислотные остатки;
уравнять число атомов водорода;
уравнять число атомов кислорода.
Пример.
Составьте уравнение окислительно-восстановительной реакции, идущей по схеме:
K2S
+ KMn04
+ H2S04
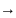 S
+ K2S04
+ MnS04
+ Н20
S
+ K2S04
+ MnS04
+ Н20
Укажите окислитель, восстановитель, процессы окисления и восстановления. Решение.
5
K2S-2
+2КМn+704
+8 H2S04
=5 S +6 K2S04
+2 Mn+2S04
+8 Н20
+6 K2S04
+2 Mn+2S04
+8 Н20
Составим электронные уравнения:
восстановитель S2- - 2е = S° | 5 окисление
окислитель Мп7+ + 5е = Mn2+ | 2 восстановление
Получили основные коэффициенты: для окислителя КМn04 и продукта его восстановления MnS04 это 2, для восстановителя K2S и продукта его окисления S - 5. Расставляем основные коэффициенты в уравнение реакции. Затем уравниваем металлы; так как слева калия 12, то в правой части уравнения возле K2S04 ставим 6; далее уравниваем кислотные остатки S042-. Затем уравниваем водород и последним - кислород.
Метод электронного баланса универсальный и применим ко всем окислительно-восстановительным реакциям - между газообразными, жидкими и твердыми веществами, а также между веществами в состоянии водного раствора. Однако молекулярные уравнения не полностью отражают ионный характер окисления и восстановления электролитов в водном растворе, и для подбора коэффициентов в уравнениях таких реакций используется метод ионно-электронного баланса.
В ионно-электронном методе в полуреакции включают не только ионы (молекулы), подвергшиеся окислительно-восстановительному изменению, но и ионы (молекулы), характеризующие среду: кислую – ионы водорода, щелочную - гидроксильные группы, нейтральную - молекулы воды.
Связывание избыточного кислорода и присоединение кислорода восстановителем происходит по-разному в кислой, щелочной и нейтральных средах.
В кислых средах избыток кислорода связывается ионами Н+ с образованием молекул воды,
Мn04- + 8Н+ + 5е = Мn2+ + 4Н20
а в нейтральных и щелочных - молекулами воды с образованием гидроксид -ионов.
Мn04-+2Н20+3е=Мn02+40H-
Присоединение кислорода восстановителем в кислой и нейтральной среде происходит за счет молекул воды с образованием ионов водорода, например:
N02- +Н20 -2е - N03- + 2Н+
В щелочной среде - за счет гидроксид-ионов с образованием молекул Н20, например:
Сr02 + 40Н- - 3е = CrO42- + 2 Н20
Порядок уравнивания:
расставить степени окисления элементов в молекулах, определить окислитель и восстановитель;
составить схемы полуреакций окисления и восстановления с учетом среды;
уравнять суммарное число зарядов, прибавляя или отнимая необходимое число электронов;
подобрать основные коэффициенты таким образом, чтобы число приобретаемых и отдаваемых электронов было одинаковым;
сложить уравнения полуреакций с учетом найденных основных коэффициентов;
на основании полученного сокращенного ионного уравнения, составить молекулярное уравнение.
Пример.
На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме:
КМnO4 + НВr Вr2 + КВr + МnВr2 + Н20
Укажите окислитель, восстановитель, процесс окисления, восстановления.
Решение.
+7 -1 0 -1 +2 -1
КМnO4 + НВr Вr2 + КВr + МnВr2 + Н20
Составим электронные уравнения:
окислитель Мn+7 + 5е- Mn+2 | 2 восстановление
восстановитель 2Вг-1 - 2е- Вr2° | 5 окисление
Получили основные коэффициенты: 2 - для окислителя КМnO4 и продукта его восстановления МnВr2; 5 - для восстановителя НВr и продукта его окисления Вr2. Расставляем основные коэффициенты в уравнение. Уравниваем калий, затем проверяем коэффициент перед НВг, т.к. кислота расходуется как на окисление, так и на солеобразование. Далее уравниваем водород: перед Н2O ставим 8; проверяем кислород в левой и правой частях уравнения.
2КМnO4 +16НВr = 5Вr2 + 2КВr + 2МnВr2 + 8Н20
Приведенные выше реакции относятся к реакциям межмолекулярного окисления-восстановления, т.к. меняются степени окисления атомов элементов в молекулах разных веществ.
Реакция диспропорционирования заключается в том, что молекулы одного и того же вещества реагируют друг с другом как окислитель и восстановитель, т.к. в них элемент находится в промежуточной степени окисления.
Пример.
Реакция диспропорционирования азотистой кислоты выражается схемой
HN02 HN03+NO+H20
Используя ионно-электронный метод, расставьте коэффициенты в уравнении этой реакции. Решение.
+3 +5 +2
HN02 HNO3 + NO + H20
Электронно-ионные уравнения:
N02- + 2H+ + e = NO + H20 | 2 восстановление
N02 +H20-2e= N03- + 2H+ | 1 окисление
Электронно-ионный баланс реакции:
2N02- + 4H+ + 2e + N02- + Н20 -2е = 2NO + 2Н20 + N03- + 2Н+
3N02- + 2Н+ = 2NO +N03- + Н20
Как видим, азотистая кислота содержит азот в промежуточной степени окисления, поэтому на каждые три ее молекулы две проявляют окислительные свойства, а одна - восстановительные. С учетом коэффициентов уравнение реакции имеет вид:
3HNO2 = HN03 +2NO + H20
В реакциях внутримолекулярного окисления-восстановления окислитель и восстановитель находятся в составе одной и той же молекулы.
Пример.
Схема реакции внутримолекулярного окисления-восстановления дихромата аммония: (NH4)2Cr207 N2 + Cr207 + Н20
Расставьте коэффициенты в предложенном уравнении.
Решение.
Применяем метод электронного баланса.
-3 +6 0 +3
(NH4)2Cr207 N2 + Сr2О3+ H20
окисление 2N-3 - 6е = N2°
восстановление 2Сr+6 +6е = 2Сr+3
Окончательно уравнение реакции имеет вид:
(NH4)2Cr207 = N2 + Cr203 + 4Н20
Выводы.
Окислительно-восстановительные реакции играют важную роль в природе и технике. Процессы фотосинтеза, дыхания, пищеварения - это звенья окислительно-восстановительных реакций. Процессы горения топлива, протекающие как в двигателях внутреннего сгорания, котлах, так и в ракетных двигателях являются примерами окислительно-восстановительных реакций.
Широко используются окислительно-восстановительные реакции для получения металлов и различных соединений; нанесения металлических покрытий; очищения веществ.
Окислительно-восстановительные реакции являются причиной пожаров, коррозии металлов и других нежелательных процессов.
