
5.2 Характеристика растворов. Способы выражения их концентрации.
Энергетика
растворения. Образование
раствора — самопроизвольный процесс,
сопровождающийся уменьшением свободной
энергии,
 G<0.
Если процесс растворения закончился
(насыщенный раствор), то система пришла
к состоянию равновесия,
G=0.
G<0.
Если процесс растворения закончился
(насыщенный раствор), то система пришла
к состоянию равновесия,
G=0.
Энергетической характеристикой процесса растворения является энтальпия образования раствора, которая при образовании растворов может, как возрастать, так и уменьшаться. Так, при растворении газов энтальпия уменьшается; растворение жидких и твердых веществ может протекать как с повышением, так и с уменьшением энтальпии.
Энтальпию образования раствора следует рассматривать как сумму энтальпий всех процессов, сопровождающих растворение. К ним относятся: эндотермические процессы разрушения кристаллической решетки, разрыва химических связей в растворяющихся веществах; экзотермические процессы сольватации - химического взаимодействия растворителя с растворяющимся, веществом; эндотермические процессы диффузии.
Образование растворов сопровождается изменением энтропии. Так, при растворении газов в жидкостях энтропия уменьшается, а при растворении твердых веществ - возрастает.
Если
процесс растворения протекает
экзотермически и с уменьшением
энтропии (
H<0,
S<0),
то самопроизвольному течению процесса
будут способствовать низкие температуры,
в соответствии с уравнением:
G
=
Н
- Т S
S
Таким образом, растворению газов в воде способствуют низкие температуры.
Растворение твердых веществ чаще идет с поглощением теплоты и увеличением энтропии ( Н>0, S>0). В этом случае процессу растворения будет способствовать повышение температуры.
Растворимость. Из составных частей раствора одно вещество считается растворителем, остальные - растворенными веществами. Растворитель - это вещество, в среде которого равномерно распределены растворенные вещества. Растворитель является основной составной частью раствора и обычно присутствует в нем в большем количестве.
Растворение вещества в растворителе происходит до образования насыщенного раствора. Раствор, в котором устанавливается динамическое равновесие между растворением вещества и его выделением из раствора, называется насыщенным. При этом изменение энергии Гиббса системы равно нулю.
Концентрация вещества в насыщенном растворе в данном растворителе и при данных условиях, называется его растворимостью. Численно растворимость может быть выражена также как и концентрация. Например, числом молей растворенного вещества содержащимся в 1 л насыщенного раствора или числом единиц массы безводного вещества, насыщающего при данных условиях 100 единиц массы растворителя. Если в 100 г воды растворяется более 10 г вещества, то такое вещество является хорошо растворимым; если менее 1 г вещества - малорастворимым; если менее 0,01 г - практически нерастворимым.
Раствор, концентрация которого меньше растворимости вещества для данных условий, является ненасыщенным. Если же концентрация вещества в растворе выше его растворимости, то он называется пересыщенным.
На растворимость веществ оказывает влияние температура. Так как растворение твердых веществ - процесс эндотермический, то при повышении температуры растворимость большинства солей растет. Растворение газов является экзотермическим процессом, поэтому их растворимость уменьшается с увеличением температуры. Взаимная растворимость жидкостей растет с повышением температуры, до температуры, при которой жидкости смешиваются в любых соотношениях.
Давление оказывает наибольшее влияние на растворимость газов. При постоянной температуре, растворимость газов в жидкости пропорциональна их парциальному давлению над жидкостью (закон Генри).
Способы выражения концентрации раствора. Концентрацией раствора называется содержание растворенного вещества в определенной массе или известном объеме раствора или растворителя.
Массовая
доля
 показывает, сколько единиц массы
растворенного вещества содержится
в 100 единицах массы раствора. Ее выражают
в долях единицы или в процентах.
показывает, сколько единиц массы
растворенного вещества содержится
в 100 единицах массы раствора. Ее выражают
в долях единицы или в процентах.

где - массовая доля (%) растворенного вещества;
m1- масса растворенного вещества, г (кг);
m2 - масса раствора, г (кг).
Задача. В какой массе воды следует растворить 30 г хлорида натрия для получения раствора, в котором массовая доля NaCl равна 6%?
Решение.
Раствор состоит из растворенного вещества и растворителя, поэтому масса раствора т2 может быть выражена следующим образом:
m2=m1+mв, где mв, - масса воды.
Тогда формула для расчета массовой доли будет иметь вид:

Отсюда:

После
подстановки числовых значений, получим:
 =
30(100-6)/6 = 470 г.
=
30(100-6)/6 = 470 г.
Мольно - объемная концентрация, или молярность См, показывает число молей растворенного вещества, содержащихся в 1 л раствора. Молярную концентрацию (моль/л) выражают формулой:

где m1 - масса растворенного вещества, г;
М - молярная масса, г/моль;
V - объем раствора, л.
Задача. Водный раствор содержит 577 г H2S04 в одном литре. Плотность раствора р = 1335 кг/м3 . Вычислите массовую долю H2S04 в растворе и его молярную концентрацию.
Решение. Масса раствора равна произведению объема раствора V на его плотность р, m2 = V р, тогда

m1 = 0,577 кг, V = 10 -Зм3, р = 1335 кг/м3, массовая доля H2SO4 в
растворе равна:

Молярную концентрацию выражают формулой:
Молярная масса серной кислоты равна 98 г/моль. Молярность раствора равна: См = 577 / 98 1 = 5,9 моль/л.
Эквивалентная концентрация, или нормальность раствора CN,
показывает число молярных масс эквивалентов растворенного вещества, содержащихся в одном литре раствора. Нормальность раствора (моль/л) вычисляют по формуле:

где m1 - масса растворенного вещества, г;
mэ - молярная масса эквивалента растворенного вещества, г/моль;
V - объем раствора, л.
Вещества взаимодействуют между собой в эквивалентных соотношениях, поэтому растворы равной нормальности реагируют в равных объемах. При разных нормальностях объемы растворов реагирующих веществ обратно пропорциональны их нормальностям:

Титр раствора показывает число граммов растворенного вещества в 1см3 (1мл) раствора. Титр вычисляют по формуле: где CN - нормальность раствора, моль/л;
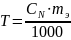
mэ - молярная масса эквивалента растворенного вещества, г/моль
Задача.
Рассчитайте молярную долю глюкозы С6Н12О6 и воды в растворе с массовой долей глюкозы 54%.
Решение. Молярную долю глюкозы можно вычислить по формуле:

где n1 - число молей глюкозы;
n2 - число молей воды.
Определяем количество глюкозы и воды: молярные массы глюкозы и воды соответственно равны 180 г/моль и 18 г/моль;
n1 = 54/180 = 0,3 моль, n2 = 46/18 = 25,9 моль. Молярная доля глюкозы равна:

Молярная доля воды равна:
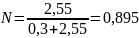
Задача. Вычислите моляльную, молярную, эквивалентную концентрацию раствора хлорида железа с массовой долей FeCl3 20%, плотностью раствора 1182 кг/м3.
Решение.
Массовая доля показывает, сколько грамм растворенного вещества содержится в 100 г. раствора.

где - массовая доля (%) растворенного вещества;
m1 - масса растворенного вещества, г;
m2 - масса раствора, г.
Масса раствора т2 равна произведению объема раствора V на его плотность р, m2 = p V, тогда:

Вычислим массу FeCl3 в одном литре раствора по данной массовой доле и плотности.

Молярность СM, показывает количество растворенного вещества, содержащихся в 1 л раствора. Молярную концентрацию (моль/л) выражают формулой:
где m1 - масса растворенного вещества, г;
М - молярная масса, г/моль;
V - объем раствора, л.
Молярная масса FeCl3 = 162,5 г/моль. Подставляем значения величин в формулу:

Нормальность раствора СN, показывает число эквивалентов растворенного вещества, содержащихся в одном литре раствора. Нормальность раствора (моль/л) вычисляют по формуле:
где m1 - масса растворенного вещества, г;
mэ - молярная масса эквивалента растворенного вещества, г/моль;
V - объем раствора, л.
Эквивалентная масса FeCl3: mэ= 162,5 / 3 = 54,17 г/моль. Подставляем значения величин в формулу:

Молялъность Сm (моль/кг), показывает число молей растворенного вещества, содержащихся в 1 кг растворителя:

где Сm - моляльность раствора, моль/кг;
m1 - масса растворенного вещества, г;
М - молярная масса, г/моль;
mз - масса растворителя, г.
В 1182 г раствора содержится 236,4 г FeCl3 , следовательно, масса воды:
m3= 1182 -236,4 =945,6 г.
Подставляем значения величин:

Растворение вещества происходит до образования насыщенного раствора, при этом G=0. На растворимость веществ оказывает влияние температура; давление в большей степени влияет на растворимость газов.
Процессы растворения сопровождаются энергетическими эффектами.
Растворы состоят из растворенного вещества и растворителя. Количественно состав раствора можно выразить через его концентрацию. Способы выражения концентрации раствора: молярность, нормальность, титр, моляльность, массовая доля, молярная доля.
