
5.3 Водные растворы электролитов
Электролитическая диссоциация. Электролиты - это вещества, которые подвергаются электролитической диссоциации и вследствие чего их расплавы или растворы проводят электрический ток.
Вещества, построенные из молекул с неполярными или слабо полярными ковалентными связями, в водном растворе не диссоциируют на ионы, а остаются в нем в виде гидратированных молекул.
Неэлектролиты - это вещества, которые не подвергаются электролитической диссоциации и вследствие чего их расплавы или растворы не проводят электрический ток.
Настоящие (истинные) электролиты находятся в виде ионов уже в индивидуальном состоянии до того, как они будут расплавлены или растворены.
Потенциальные электролиты - вещества с сильно полярными ковалентными связями в молекулах, образуют ионы в растворах или расплавах.
Процесс диссоциации можно представить в виде реакции образования сольватированных ионов в растворе либо гидратированных ионов, если растворителем является вода. Причиной образования сольватов является физико-химическое взаимодействие между молекулами и ионами растворенного вещества и полярными молекулами растворителя. В зависимости от структуры растворяющегося вещества типичны два случая процесса диссоциации.
Диссоциация истинных электролитов происходит за счет ион-ди-польного взаимодействия. Например, при попадании соли NaCl в воду внешние ионы Na+ и Сl- притягивают к себе полярные молекулы воды. Толчки других молекул, тепловые колебания ионов в кристалле оказываются достаточными для растворения кристалла.
При растворении потенциальных электролитов диполи воды, за счет сил диполь-дипольного взаимодействия притягиваются к концам полярной молекулы, вызывают расхождение ее полюсов, поляризуют молекулу. Такая поляризация в сочетании с броуновским движением окружающих ее молекул воды приводит к распаду полярной молекулы на ионы. Так, в частности, ионизируются в воде все галогеноводороды. Схематически процесс можно выразить уравнением:
НСl + Н20 = Н30+ + Сl-
Особенностью сольватов, как химических соединений, является то, что число молекул растворителя, связанных с ионами, изменяется с изменением концентрации, температуры, и других условий.
Для растворов электролитов наблюдается отклонение от законов Рауля и Вант-Гоффа. Вследствие диссоциации электролита увеличивается число частиц в растворе, что и обусловливает отклонение от этих законов. Чтобы применить вышеуказанные законы для растворов электролитов Вант-Гофф ввел поправочный коэффициент i - изотонический коэффициент. Тогда уравнение для расчета осмотического давления будет иметь вид: P=iCRT. Аналогично изотонический коэффициент вводится и в математическое выражение законов Рауля.
Изотонический коэффициент показывает, во сколько раз увеличивается общее число частиц в растворе, вследствие диссоциации электролита. Значение изотонического коэффициента для растворов электролитов больше 1, а для растворов неэлектролитов равно 1.
Степень диссоциации электролитов. Для количественной характеристики электролитической диссоциации используются степень и константа диссоциации.
Степень
диссоциации (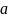 )
-
это отношение числа молекул, распавшихся
на ионы, к общему числу молекул,
растворенного вещества. Выражается а
в долях, либо в процентах. По степени
диссоциации все электролиты делятся
на сильные
)
-
это отношение числа молекул, распавшихся
на ионы, к общему числу молекул,
растворенного вещества. Выражается а
в долях, либо в процентах. По степени
диссоциации все электролиты делятся
на сильные
 30%,
средней силы
от 3 до 30% и слабые
30%,
средней силы
от 3 до 30% и слабые
 30%,
Сильные электролиты практически
полностью диссоциированы на ионы. К
ним относятся большинство солей, щелочи,
некоторые кислоты (НСl,
НВг, HNO3,
H2SO4).
Электролиты частично диссоциирующие
на ионы называются слабыми. К ним
относятся: вода, основания р,
d,f-
элементов,
ряд кислот ( H2S,
HCN,
H2SiO3
).
30%,
Сильные электролиты практически
полностью диссоциированы на ионы. К
ним относятся большинство солей, щелочи,
некоторые кислоты (НСl,
НВг, HNO3,
H2SO4).
Электролиты частично диссоциирующие
на ионы называются слабыми. К ним
относятся: вода, основания р,
d,f-
элементов,
ряд кислот ( H2S,
HCN,
H2SiO3
).
Степень диссоциации а возрастает при увеличении разбавления раствора, при повышении температуры раствора. Увеличение кинетической энергии растворенных частиц способствует распаду молекул на ионы.
Степень диссоциации и изотонический коэффициент электролита связаны между собой соотношением
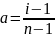
где n - число ионов, образующихся при диссоциации молекул вещества.
Не следует ставить в зависимость одно от другого силу электролита и его растворимость. Утверждение, что чем выше растворимость электролита, тем он диссоциирует в большей степени - неверно. Между растворимостью вещества, т.е. его способностью в большей или меньшей мере растворяться в данном растворителе, и его силой как электролита нет прямой связи. Вещество может очень хорошо растворяться в воде и одновременно быть неэлектролитом, как например, сахар.
Диссоциация кислот, оснований, солей. С точки зрения теории электролитической диссоциации, кислоты - это вещества, диссоцииру ющие в водном растворе с образованием катионов одного вида - катио нов водорода Н+.
Например: HN03
 Н+
+ N03
Н+
+ N03
Многоосновные кислоты, содержащие в молекулах по два или не сколько атомов водорода, обычно являются слабыми электролитами и диссоциируют ступенчато, причем каждая следующая стадия протекает в значительно меньшей степени, чем предыдущая.
Например:
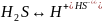
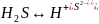
Основания - это вещества, диссоциирующие в водном растворе с образованием анионов одного вида - гидроксид-ионов OH-
Например:

Многокислотные основания в водном растворе диссоциируют ступенчато:

Соли - это вещества, которые в водном растворе диссоциируют с образованием катионов металла и анионов кислотного остатка. Например: ВаСl2 Ва2+ + 2Сl-
При растворении кислых солей в растворе образуются катионы металла, сложные анионы, а также небольшое количество ионов, являющихся продуктами диссоциации этого сложного аниона.
Например:
 -
-
 2-
2-
Основные соли диссоциируют также ступенчато. Вначале происходит диссоциация на гидрооксокатион металла и анион кислотного остатка, а в последующем происходит, хотя и в незначительной степени, диссоци ация гидрооксокатиона на катион металла и гидроксильную группу. Например.

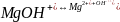
Слабые электролиты. Константа диссоциации. Закон Оствальда. В растворе слабых электролитов устанавливается динамическое равновесие между недиссоциированными молекулами и ионами. Например, в растворе уксусной кислоты существует равновесие:

Следовательно, к нему может быть применен закон действия масс:

Константу равновесия для процесса диссоциации называют константой диссоциации Kд
Чем меньше Кд, тем слабее диссоциирует вещество на ионы. Константа диссоциации зависит от природы диссоциирующего вещества и растворителя, а также температуры. С повышением температуры значение Кд уменьшается, так как процесс диссоциации является экзотермическим.
Для растворов сильных электролитов константа диссоциации не остается постоянной, а возрастает с увеличением концентрации раствора.
Связь между степенью диссоциации , константой диссоциации Кд и концентрацией С устанавливает закон разбавления Оствальда.
Рассмотрим приведенную выше реакцию диссоциации уксусной кислоты. Если исходную молярную концентрацию раствора принять равной С, а степень диссоциации кислоты , то концентрация ионов СНзСОО- будет равна концентрации ионов Н+ и составит С. Концентрация не распавшихся молекул уксусной кислоты будет равна (1- )С. Введем эти обозначения в уравнение константы диссоциации уксусной кислоты, при этом получим:

Это уравнение представляет собой закон разбавления Оствальда. Оно
позволяет вычислить степень диссоциации при различных концентрациях, если известна константа диссоциации электролита, либо наоборот. В случае очень слабых электролитов степень диссоциации мала и ею в знаменателе можно пренебречь, тогда выражение закона Оствальда упрощается:
K= C
C
Сильные электролиты. В растворах слабых электролитов взаимодействие ионов друг с другом относительно невелико вследствие их незначительной концентрации. В растворах сильных электролитов, вследствие их полной диссоциации, концентрация ионов велика. Свойства растворов будут зависеть от степени взаимодействия ионов.
Степень диссоциации а определяют по данным измерения электропроводности раствора, которая прямо пропорциональна концентрации свободно движущихся ионов. При этом для сильных электролитов получают не истинные , а «кажущиеся» значения. Они всегда меньше истинных значений , т.к. ионы при движении к электродам сталкиваются и частично уменьшают свою подвижность, особенно при высокой концентрации их в растворе.
Кроме того, в концентрированных растворах ионы не свободны, поскольку каждый ион как бы окружен противоположно заряженными ионами («ионной атмосферой»). При приложении постоянного электрического поля, заряженные ионы и его «ионная атмосфера» притягиваются в различных направлениях, вследствие чего перемещение ионов замедляется.
Строго говоря, для настоящих электролитов понятие о степени диссоциации не применимо, т.к. они не поставляют молекулы в водный раствор (построены из ионов).
Состав концентрированных растворов сильных электролитов следует характеризовать не аналитической концентрацией электролита, а так называемой действующей концентрацией или активностью электролита.
Активность электролита а связана с его аналитической концентрацией в растворе С соотношением:

где f - коэффициент активности, равный частному от деления действующей концентрации на аналитическую концентрацию.
В очень разбавленных растворах значения активности и аналитической концентрации электролита достаточно близки. Поэтому для проведения не очень точных расчетов в первом приближении для разбавленных растворов можно использовать значения концентрации вместо значений активности.
В области разбавленных растворов коэффициенты активности зависят в основном от концентрации и заряда всех присутствующих в растворе ионов, и мало зависят от природы растворенных веществ. В соответствии с правилом ионной силы, ионы одинаковой зарядности независимо от их природы в разбавленных растворах с одинаковой ионной силой имеют равные коэффициенты активности. Ионная сила раствора I численно равна полусумме произведений концентрации С каждого иона на квадрат его заряда z:

Зная ионную силу раствора, можно вычислить коэффициент активности ионов по уравнению Дебая- Гюккеля:

Задача. Рассчитайте активную концентрацию иодида бария в водном растворе, содержащем 0,315 г BaJ2 в 200 г воды
Решение.
Для определения активной концентрации электролита необходимо знать его моляльность. Так как по условию задачи в 200 г воды содержится 0,315 г иодида бария, тогда в 1000 г воды его будет содержаться 1,575 г. Молярная масса BaJ2 равна 391 г/моль. Вычислим моляльность раствора:
C=1,575/391=0,004 моль/к г
Определим ионную силу раствора:
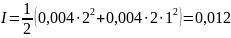
По значению ионной силы раствора находим коэффициенты активности ионов, используя табличные данные: fва2+=0,744, fJ.=0,925.
Определим активность ионов Ва2+ и J-
 =0,744
=0,744 =0,00298
=0,00298

Активность электролита равна произведению активностей его ионов, следовательно активная концентрация иодида бария равна:
 2=0,00298(0,0037)2=4
2=0,00298(0,0037)2=4 -8
-8
Электролитическая
диссоциация воды. Водородный показатель.
Вода
является слабым электролитом. Процесс
диссоциации воды может быть записан в
виде: H2O
Константа диссоциации этого процесса:
По
данным измерения электропроводности
воды Кд = 1,86 .
Концентрацию молекул Н20,
в виду их незначительной диссоциации,
можно рассчитать, разделив массу 1л воды
на молярную массу воды: 1000/18 = 55,5 моль/л.
.
Концентрацию молекул Н20,
в виду их незначительной диссоциации,
можно рассчитать, разделив массу 1л воды
на молярную массу воды: 1000/18 = 55,5 моль/л.

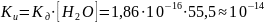

Константу Ки называют ионным произведением воды. Ки возрастает с повышением температуры. Зная концентрацию ионов водорода или концентрацию ионов ОН- и используя Ки можно определить концентрацию другого иона. При равенстве концентраций [Н+] = [ОН- ] = 10-7 моль/л среда нейтральная. При [Н+] >10-7 моль/л, а [ОH-] < 10-7 реакция среды будет кислой. Если [Н+] <10-7 моль/л, а [ОН-] > 10-7 , тогда реакция среды будет щелочной.
При более точных расчетах используют не концентрации, а активности ионов:

Для характеристики кислотности (щелочности) среды используется водородный показатель рН.
Водородным показателем рН называется взятый со знаком минус десятичный логарифм значения молярной концентрации Н+:
pH=-lg[H+]
При рН = 7 реакция раствора нейтральная; при рН < 7 реакция раствора кислая; при рН > 7 - щелочная.
Аналогично рассчитывается рОН: рОН = - lg[OH-]. Зная рН, можно легко рассчитать рОН, и наоборот, по известному значению рОН легко определяется рН: рН + рОН=14.
Величина рН может служить критерием силы кислоты или основания. В ряду кислот более сильной будет та, у которой при одинаковой молярности рН ниже.
Задача. Определите рН раствора, в котором концентрация гидроксид-ионов равна 1 (Г моль/л).
Решение.
Так как [ОН-] = 10-5 моль/л, то рОН = - lg10-5 = 5. Тогда рН = 14 – 5 = 9 (среда щелочная).
В растворах, под воздействием полярных молекул растворителя, может произойти электролитическая диссоциация. Наиболее широкое распространение получили водные растворы электролитов. Поведение растворов слабых электролитов описывается законом Оствальда. Свойства растворов сильных электролитов, вследствие высокой концентрации ионов, зависят от степени их взаимодействия.
Вода является слабым электролитом. Ионное произведение воды позволяет определить активности ионов Н+ и ОН- в растворе.
Водородный показатель рН характеризует кислотность (щелочность) среды. Этим показателем интересуются в медицине, в сельском хозяйстве, в промышленности. Поддержание определенного уровня рН крови, желудочного сока и т.д. важно для нормальной деятельности человеческого организма. В агротехнике учитывают рН почвы. Многие технологические процессы протекают при определенном значении рН. Степень коррозии металлов также зависит от рН среды.
