
- •Термодинамика и теплопередача. Учебное пособие
- •Раздел I. Техническая термодинамика
- •Содержание
- •Раздел I
- •Тема 1. Газ, как рабочее тело термодинамических систем
- •Тема 2. Первый закон термодинамики
- •Тема 3. Термодинамические процессы
- •Тема 4. Второй закон термодинамики
- •Тема 5. Идеальные циклы тепловых двигателей
- •Основные условные обозначения
- •Основные сечения потока
- •Сокращения
- •Используемые индексы
- •Предисловие
- •Введение
- •Раздел I техническая термодинамика
- •Тема 1. Газ, как рабочее тело термодинамических систем
- •1.1. Структура основных понятий термодинамики авиационных гтд
- •1.2. Основные понятия и определения термодинамики
- •1.3. Реальный и идеальный газы. Параметры состояния рабочего тела
- •1.3.1. Давление
- •1.3.2. Температура
- •1.3.3. Удельный объём, плотность
- •1.4. Уравнение состояния идеального и реального газов
- •1.4.1. Уравнение состояния идеального газа
- •1.4.2. Уравнение состояния реального газа
- •1.5. Понятие о термодинамическом процессе. Равновесные (обратимые) и неравновесные (необратимые) процессы
- •1.5.1. Равновесные (обратимые) процессы
- •1.5.2. Графическое изображение термодинамического процесса
- •1.5.3. Неравновесные (необратимые) процессы
- •Примеры решения задач
- •Решение
- •Решение
- •Решение
- •Проверьте, как Вы усвоили материал
- •Тема 2. Первый закон термодинамики
- •2.1. Внутренняя энергия рабочего тела. Изменение внутренней энергии
- •2.2. Работа газа, как форма передачи энергии в термодинамическом процессе
- •2.3. Теплота, как форма передачи энергии в термодинамическом процессе
- •2.4. Энтропия. Энтропийная “t-s” диаграмма
- •2.5. Зависимость количества работы и теплоты от характера термодинамического процесса
- •2.6. Теплоёмкость газа. Уравнение Майера. Показатель адиабаты
- •2.7. Энтальпия
- •2.8. Техническая работа (работа движущегося газа)
- •2.9. Содержание и уравнение первого закона термодинамики
- •2.10. Чистые вещества и смеси газов
- •Примеры решения задач
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Проверьте, как Вы усвоили материал
- •Тема 3. Термодинамические процессы
- •3.1. Последовательность и объём расчёта термодинамических процессов
- •3.2. Изохорный процесс: определение, осуществление и исследование
- •3.2.1. Исследование изохорного процесса
- •3.3. Изобарный процесс: определение, осуществление и исследование
- •3.3.1. Исследование изобарного процесса
- •3.4. Изотермический процесс: определение, осуществление, исследование
- •3.4.1. Исследование изотермического процесса
- •3.5. Адиабатный (изоэнтропический) процесс: определение, осуществление, исследование
- •3.5.1. Исследование адиабатного процесса
- •3.6. Сравнение адиабаты и изотермы
- •3.7. Обобщающее значение политропных процессов
- •3.8. Энтальпийная “I-s” диаграмма (“I-s” координаты)
- •Примеры решения задач
- •Решение
- •Решение
- •Решение
- •Решение
- •Проверьте, как Вы усвоили материал
- •Тема 4. Второй закон термодинамики
- •4.1. Понятие о круговых процессах (циклах). Прямой цикл (цикл тепловой машины)
- •4.2. Полезная работа цикла. Термический кпд цикла
- •4.3. Цикл Карно и теорема Карно
- •4.4. Обратные циклы (циклы холодильных машин)
- •4.5. Второй закон термодинамики. Формулировки второго закона термодинамики
- •4.6. Второй закон термодинамики и энтропия
- •4.7. Статистическая интерпретация второго закона термодинамики
- •Примеры решения задач
- •Решение
- •Решение
- •Решение
- •Решение
- •Информация к размышлению
- •Проверьте, как Вы усвоили материал
- •Тема 5. Идеальные циклы тепловых двигателей
- •5.1. Особенности термодинамического метода исследования циклов тепловых двигателей
- •5.2. Схема устройства и принцип работы авиационного газотурбинного двигателя (гтд)
- •5.3. Идеальный цикл гтд (цикл Брайтона – Стечкина)
- •5.4. Работа и термический кпд цикла гтд
- •5.6. Сравнение циклов Брайтона и Гемфри
- •5.7. Цикл с регенерацией тепла
- •5.8. Цикл со ступенчатым подводом тепла
- •5.9. Эксергетический метод термодинамического анализа
- •5.10. Идеальные циклы двигателей внутреннего сгорания (двс)
- •5.10.1. Идеальный цикл двс с подводом тепла
- •5.10.2. Идеальный цикл двс с подводом тепла при постоянном
- •5.10.3. Сравнение циклов Отто и Дизеля
- •5.10.4. Цикл двс со смешанным теплоподводом
- •Примеры решения задач
- •Решение
- •Решение
- •4. Эффективность цикла оцениваем по величине термического кпд цикла
- •Решение
- •Проверьте, как Вы усвоили материал
- •Заключение
- •Список использованной литературы
- •Приложение
- •Международная стандартная атмосфера (мса) гост 4401–81 (фрагмент)
- •Теплофизические величины
- •Соблюдайте гост 8.417 – 2002
3.4. Изотермический процесс: определение, осуществление, исследование
Термодинамический процесс, протекающий при постоянной температуре рабочего тела называется изотермическим (от греческих слов изос – равный, терме – тепло, жар). Примером изотермического процесса может служить процесс сжатия воздуха в компрессоре ГТД при условии, что в него производится впрыск легкоиспаряющейся жидкости. В компрессоре жидкость испаряется за счёт теплоты, выделившейся при сжатии воздуха. Тем самым обеспечивается постоянство температуры. Такой способ иногда используется для увеличения тяги (мощности) ГТД.
3.4.1. Исследование изотермического процесса
1. Условие протекания и есть уравнение процесса
T = const. (3.23)
Поскольку T = const, значит dT = 0, а dq ≠ 0, то теплоёмкость изотермического процесса равна: CT = dq/dT = ± ∞.
Воспользовавшись условием протекания процесса и уравнением состояния идеального газа (p·υ = R·T), получим уравнение изотермического процесса через параметры состояния
p·υ = p1·υ1 = p2·υ2 = const . (3.24)
2. Из уравнения (3.24) очевидно, что давление в изотермическом процессе изменяется обратно пропорционально изменению удельного объёма
![]() .
(3.25)
.
(3.25)
3 .
Графическое построение процесса.
.
Графическое построение процесса.
Рис. 3.5. Изотермический процесс: а – рабочая диаграмма процесса, б – тепловая диаграмма процесса, в – осуществление процесса
4. Определение величин входящих в первый закон термодинамики.
а) Сначала получим формулу для вычисления работы газа в изотермическом процессе. Для этого выразим текущее значение давления p через объём из уравнения процесса (3.24):
![]() ;
(3.26)
;
(3.26)
Далее проведя ряд преобразований, получим выражение для определения работы в изотермическом процессе:
LТ
=
 (3.27)
(3.27)
или
LТ
=
![]() (3.28)
(3.28)
б) В изотермическом процессе внутренняя энергия системы сохраняется неизменной, т.е. отсутствует изменение внутренней энергии
∆UТ = = 0. (3.29)
в) Согласно первому закону термодинамики, количество теплоты определяется по формуле:
qТ = ∆UТ + LТ, т.к. ∆UТ = 0 и учитывая (3.28) получаем
qТ
= LТ
=
![]() (3.30)
(3.30)
Таким образом, в изотермическом процессе всё подведённое тепло расходуется на совершение работы против внешних сил. Теплоту qТ в изотермическом процессе в координатах “T-s” определяют по площади прямоугольника а12в (рис. 3.5.)
пл. а12в = а1·ав или
qТ = T·∆s1-2.
г) Зная величину теплоты, участвующей в процессе всегда можно определить изменение энтропии для данного процесса по формуле
∆s1-2
=
![]() .
(3.31)
.
(3.31)
5. Распределение энергии в изотермическом процессе представлено на рис. 3.6., а коэффициент распределения энергии α = 0.
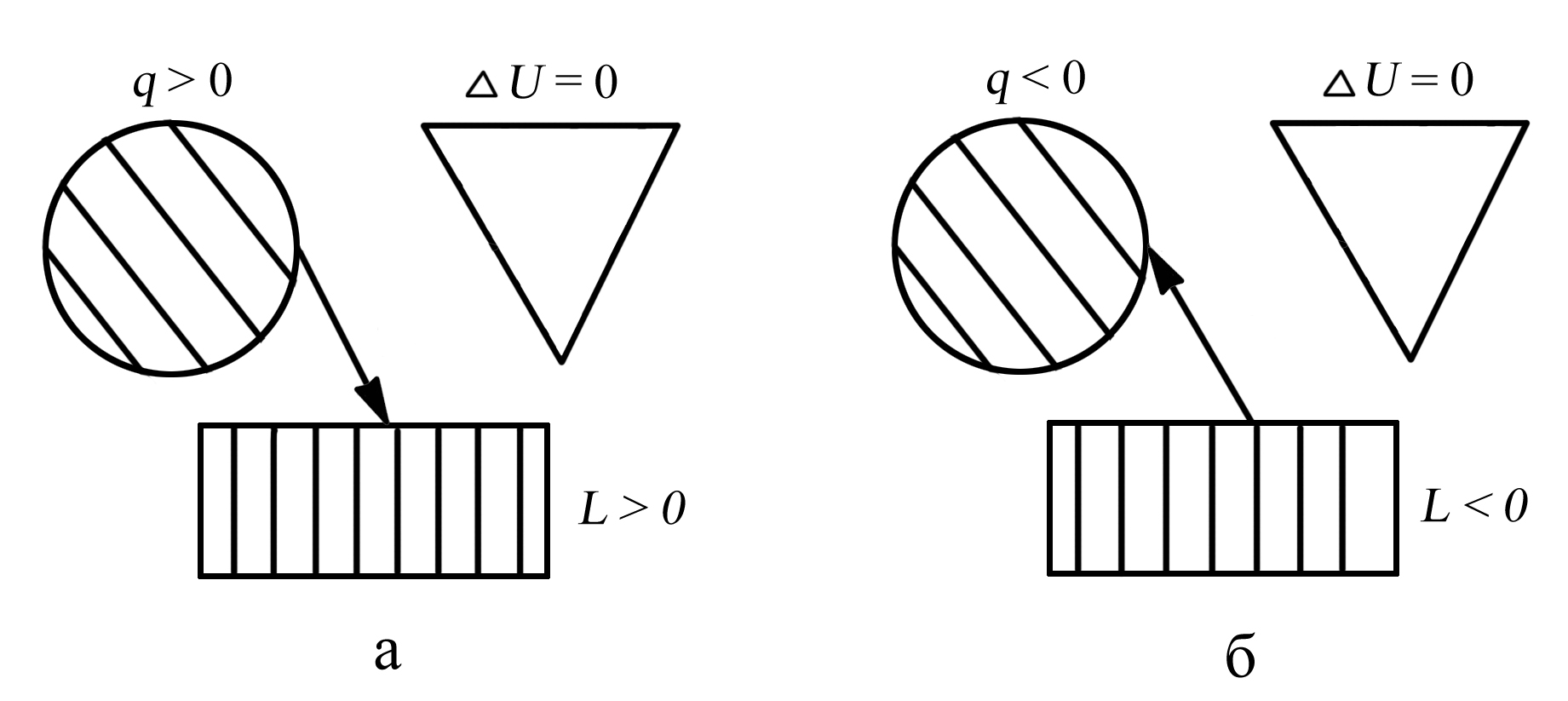
Рис. 3.6. Распределение энергии в изотермическом процессе: а – при расширении рабочего тела (процесс 1–2), б – при сжатии рабочего тела (процесс 2–1)
