
- •Термодинамика и теплопередача. Учебное пособие
- •Раздел I. Техническая термодинамика
- •Содержание
- •Раздел I
- •Тема 1. Газ, как рабочее тело термодинамических систем
- •Тема 2. Первый закон термодинамики
- •Тема 3. Термодинамические процессы
- •Тема 4. Второй закон термодинамики
- •Тема 5. Идеальные циклы тепловых двигателей
- •Основные условные обозначения
- •Основные сечения потока
- •Сокращения
- •Используемые индексы
- •Предисловие
- •Введение
- •Раздел I техническая термодинамика
- •Тема 1. Газ, как рабочее тело термодинамических систем
- •1.1. Структура основных понятий термодинамики авиационных гтд
- •1.2. Основные понятия и определения термодинамики
- •1.3. Реальный и идеальный газы. Параметры состояния рабочего тела
- •1.3.1. Давление
- •1.3.2. Температура
- •1.3.3. Удельный объём, плотность
- •1.4. Уравнение состояния идеального и реального газов
- •1.4.1. Уравнение состояния идеального газа
- •1.4.2. Уравнение состояния реального газа
- •1.5. Понятие о термодинамическом процессе. Равновесные (обратимые) и неравновесные (необратимые) процессы
- •1.5.1. Равновесные (обратимые) процессы
- •1.5.2. Графическое изображение термодинамического процесса
- •1.5.3. Неравновесные (необратимые) процессы
- •Примеры решения задач
- •Решение
- •Решение
- •Решение
- •Проверьте, как Вы усвоили материал
- •Тема 2. Первый закон термодинамики
- •2.1. Внутренняя энергия рабочего тела. Изменение внутренней энергии
- •2.2. Работа газа, как форма передачи энергии в термодинамическом процессе
- •2.3. Теплота, как форма передачи энергии в термодинамическом процессе
- •2.4. Энтропия. Энтропийная “t-s” диаграмма
- •2.5. Зависимость количества работы и теплоты от характера термодинамического процесса
- •2.6. Теплоёмкость газа. Уравнение Майера. Показатель адиабаты
- •2.7. Энтальпия
- •2.8. Техническая работа (работа движущегося газа)
- •2.9. Содержание и уравнение первого закона термодинамики
- •2.10. Чистые вещества и смеси газов
- •Примеры решения задач
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Проверьте, как Вы усвоили материал
- •Тема 3. Термодинамические процессы
- •3.1. Последовательность и объём расчёта термодинамических процессов
- •3.2. Изохорный процесс: определение, осуществление и исследование
- •3.2.1. Исследование изохорного процесса
- •3.3. Изобарный процесс: определение, осуществление и исследование
- •3.3.1. Исследование изобарного процесса
- •3.4. Изотермический процесс: определение, осуществление, исследование
- •3.4.1. Исследование изотермического процесса
- •3.5. Адиабатный (изоэнтропический) процесс: определение, осуществление, исследование
- •3.5.1. Исследование адиабатного процесса
- •3.6. Сравнение адиабаты и изотермы
- •3.7. Обобщающее значение политропных процессов
- •3.8. Энтальпийная “I-s” диаграмма (“I-s” координаты)
- •Примеры решения задач
- •Решение
- •Решение
- •Решение
- •Решение
- •Проверьте, как Вы усвоили материал
- •Тема 4. Второй закон термодинамики
- •4.1. Понятие о круговых процессах (циклах). Прямой цикл (цикл тепловой машины)
- •4.2. Полезная работа цикла. Термический кпд цикла
- •4.3. Цикл Карно и теорема Карно
- •4.4. Обратные циклы (циклы холодильных машин)
- •4.5. Второй закон термодинамики. Формулировки второго закона термодинамики
- •4.6. Второй закон термодинамики и энтропия
- •4.7. Статистическая интерпретация второго закона термодинамики
- •Примеры решения задач
- •Решение
- •Решение
- •Решение
- •Решение
- •Информация к размышлению
- •Проверьте, как Вы усвоили материал
- •Тема 5. Идеальные циклы тепловых двигателей
- •5.1. Особенности термодинамического метода исследования циклов тепловых двигателей
- •5.2. Схема устройства и принцип работы авиационного газотурбинного двигателя (гтд)
- •5.3. Идеальный цикл гтд (цикл Брайтона – Стечкина)
- •5.4. Работа и термический кпд цикла гтд
- •5.6. Сравнение циклов Брайтона и Гемфри
- •5.7. Цикл с регенерацией тепла
- •5.8. Цикл со ступенчатым подводом тепла
- •5.9. Эксергетический метод термодинамического анализа
- •5.10. Идеальные циклы двигателей внутреннего сгорания (двс)
- •5.10.1. Идеальный цикл двс с подводом тепла
- •5.10.2. Идеальный цикл двс с подводом тепла при постоянном
- •5.10.3. Сравнение циклов Отто и Дизеля
- •5.10.4. Цикл двс со смешанным теплоподводом
- •Примеры решения задач
- •Решение
- •Решение
- •4. Эффективность цикла оцениваем по величине термического кпд цикла
- •Решение
- •Проверьте, как Вы усвоили материал
- •Заключение
- •Список использованной литературы
- •Приложение
- •Международная стандартная атмосфера (мса) гост 4401–81 (фрагмент)
- •Теплофизические величины
- •Соблюдайте гост 8.417 – 2002
Тема 3. Термодинамические процессы
3.1. Последовательность и объём расчёта термодинамических процессов
В тепловых двигателях при их работе протекают разнообразные термодинамические процессы. Целью изучения термодинамических процессов является установление закономерностей изменения параметров состояния ТДС и особенностей преобразования энергии в этих процессах.
Знание указанных закономерностей имеет важное значение для понимания процессов, протекающих в элементах ГТД и ДВС.
Анализ (или расчёт) термодинамических процессов производится обычно в следующей последовательности:
1. Определяют уравнение процесса: исходя из условий протекания процессов и используя уравнение состояния идеального газа, находят уравнения процесса в виде зависимостей
p = f (υ); T = f (υ); T = f (p).
2. Определяют закон изменения параметров на основании уравнения процесса и уравнения состояния, используя известные по условиям задачи значения параметров состояния в начале процесса (p1, υ1, T1), в конце процесса (p2, υ2, T2), а если требуется – то и в промежуточных состояниях.
3. Осуществляют графическое построение процесса в рабочей “p-υ” диаграмме и тепловой “T-s” диаграмме.
4. Определяют величины, входящие в первый закон термодинамики.
q = ∆U + L; T∙∆s = ∆U + pdυ
а) q
=
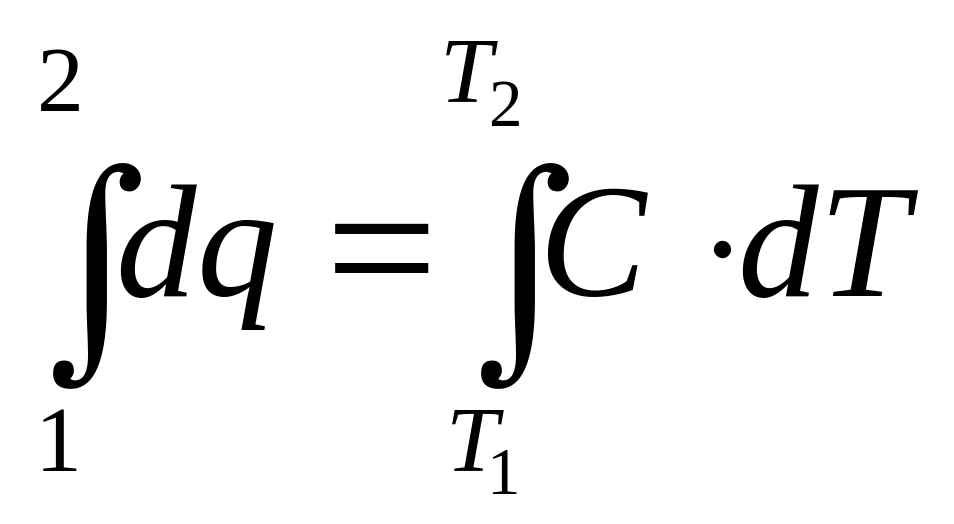 ;
;
б) ∆U
=
 ;
;
в) L
=
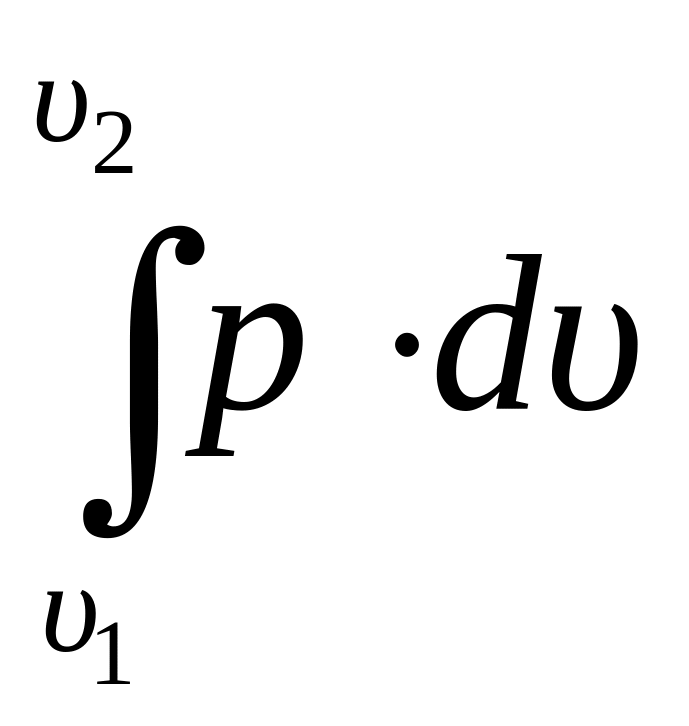 ;
;
г) ∆s1-2
=
![]() =
s2
– s1.
=
s2
– s1.
5. Определяют закон распределения энергии (α) для данного процесса по формуле α = ∆U/q.
Все величины, указанные в пунктах 2 и 4 могут, найдены как аналитически по уравнениям, так и графически с помощью рабочей “p-υ” диаграммы и тепловой “T-s” диаграммы. Поэтому любой расчёт процесса всегда сопровождается графическим построением процесса в этих координатах.
3.2. Изохорный процесс: определение, осуществление и исследование
Термодинамический процесс, протекающий при постоянном объёме (удельном объёме) рабочего тела, называется изохорным (от греческих слов изос – равный и хора – пространство).
В авиационной технике, процессы близкие к изохорным протекают:
- в кислородной и воздушных системах воздушного судна при изменении высоты полёта;
- в отдельных элементах конструкции самолётов и вертолётов: в пневматиках колёс, в амортизационных стойках, в бортовых баллонах со сжатыми газами при изменении температуры окружающей среды;
- в камерах сгорания поршневых двигателей.
3.2.1. Исследование изохорного процесса
1. Условие протекания процесса и есть уравнение процесса
υ = const. (3.1)
Используя уравнение состояния идеального газа, получим уравнение изохорного процесса через параметры состояния
p
=
![]() =
(const)·T
или
p
= f
(T).
(3.2)
=
(const)·T
или
p
= f
(T).
(3.2)
2. Из уравнения (3.2) очевидно, что давление в изохорном процессе изменяется прямопропорционально абсолютной температуре
![]() .
(3.3)
.
(3.3)
3. Графическое построение процесса
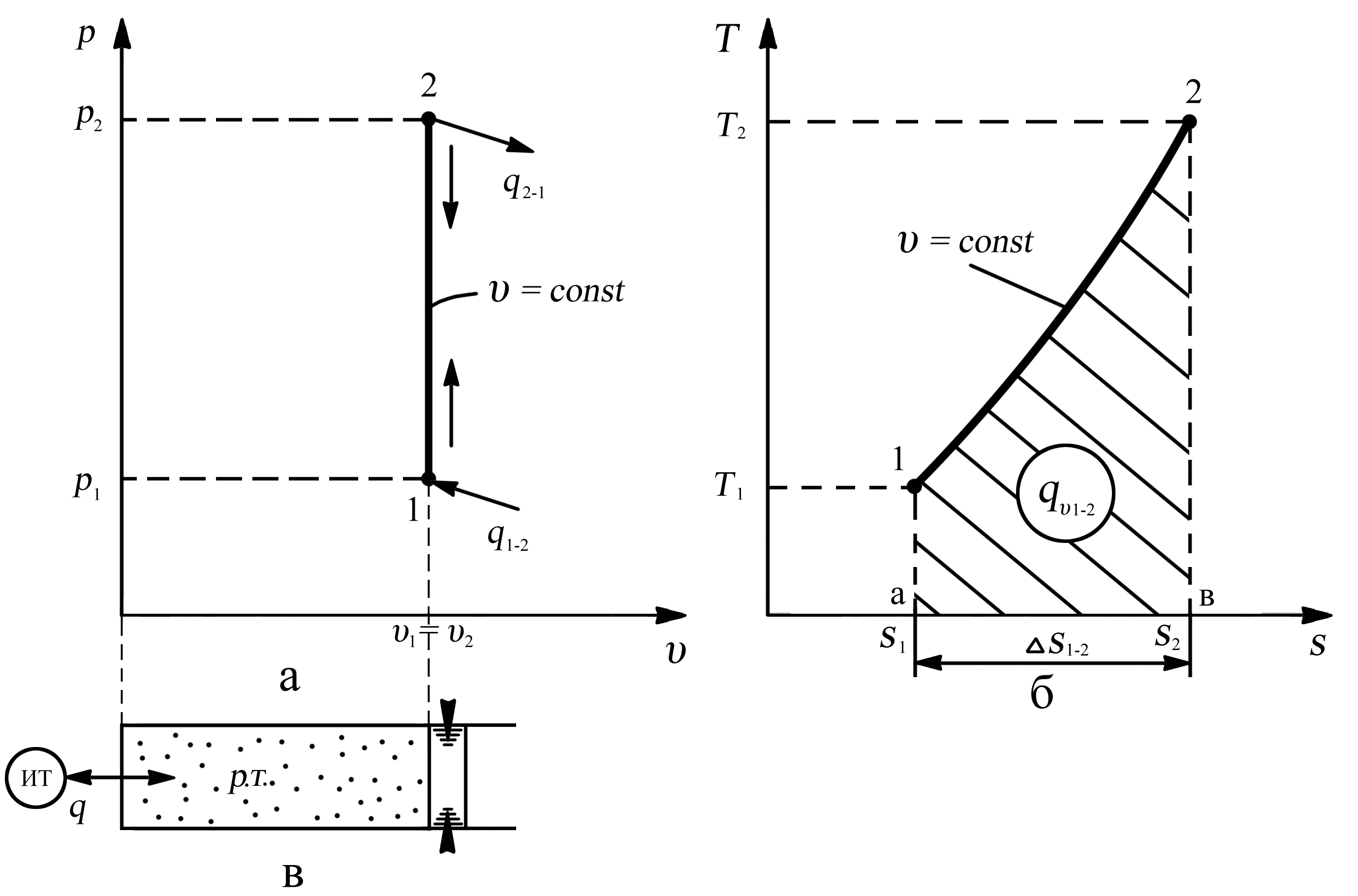
Рис. 3.1. Изохорный процесс: а – рабочая диаграмма процесса, б – тепловая диаграмма процесса, в – осуществление процесса
4. Определение величин входящих в первый закон термодинамики
а) qυ
=
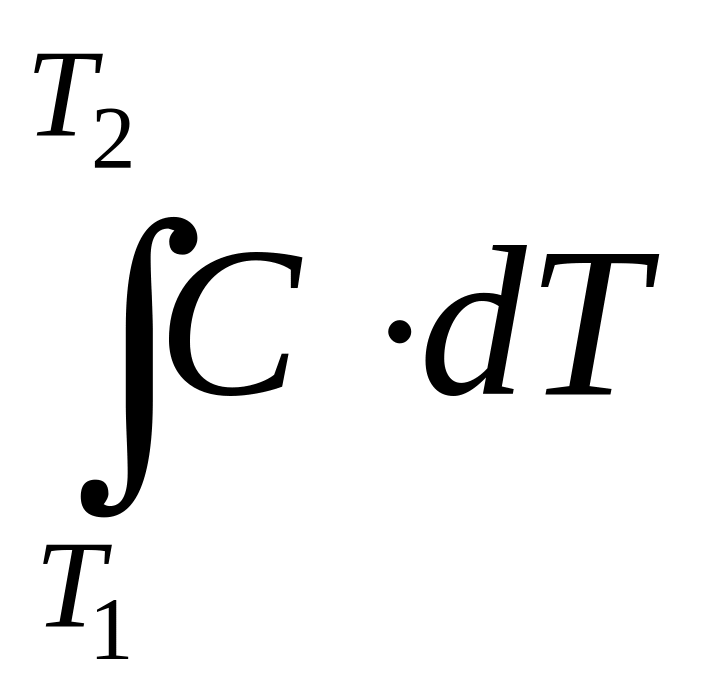 =
Cυ·(T2
– T1);
(3.4)
=
Cυ·(T2
– T1);
(3.4)
б) ∆Uυ
=
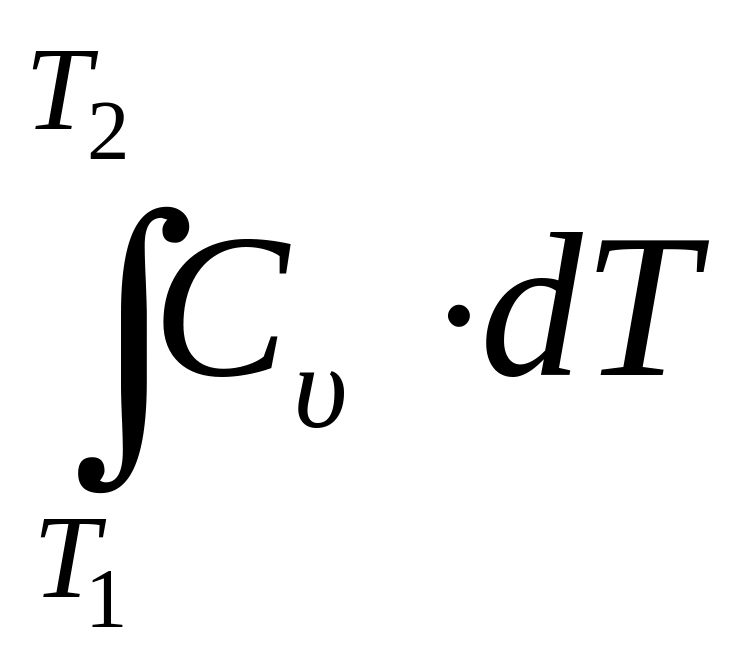 = Cυ·(T2
– T1);
(3.5)
= Cυ·(T2
– T1);
(3.5)
в) Lυ = = p·(υ2 – υ1) = 0, (3.6)
т.к. υ2 = υ1, т.е. газом в изохорном процессе работа не совершается.
Таким образом, в изохорном процессе согласно первому закону термодинамики вся теплота, подводимая к рабочему телу, расходуется только на увеличение внутренней энергии (увеличение температуры), при этом по уравнению (3.3) происходит увеличение давления. При отводе теплоты внутренняя энергия рабочего тела уменьшается, соответственно уменьшается и температура и давление. Поэтому для изохорного процесса первый закон термодинамики будет иметь следующий вид:
qυ = ∆Uυ = Cυ·∆T . (3.7)
Используя графическое построение изохорного процесса в тепловой “T-s” диаграмме (рис. 3.1,б) определим количество теплоты qυ1-2, участвующего в изохорном процессе. Площадь под линией изохорного процесса в тепловой “T-s” диаграмме даёт количество тепла qυ1-2. Если кривизна линии 1–2 не очень значительна (что бывает, если изменение температуры невелико), то приближённо можно считать, что площадь под кривой 1–2 равна площади прямолинейной трапеции а12в:
пл. а12в =
![]() .
.
Заменяя длины отрезков а1 и в2 значениями температур, а отрезка ав – изменением энтропии, получим приближённую формулу для вычисления количества теплоты:
qυ
1-2 =
![]() (3.8)
(3.8)
или из первого закона термодинамики, и определения энтропии имеем:
qυ 1-2 = ∆U = T·∆s1-2 . (3.9)
Знак количества теплоты определяется знаком изменения энтропии. Если ∆s1-2 > 0, то это значит, что теплота подводится и qυ 1-2 > 0. Если ∆s1-2 < 0, то теплота отводится и qυ 1-2 < 0.
г) Определим изменение энтропии, для изохорного процесса используя аналитическое выражение первого закона термодинамики (2.43)
dU = T·ds – p·dυ,
т.к. для изохорного процесса υ = const, и учитывая, что dυ = 0, dU = Cυ·dT имеем Cυ·dT = T·ds и получаем:
ds
= Cυ·![]() . (3.10)
. (3.10)
Чтобы найти изменение энтропии ∆s1-2 при конечном изменении температуры T проинтегрируем выражение (3.10)
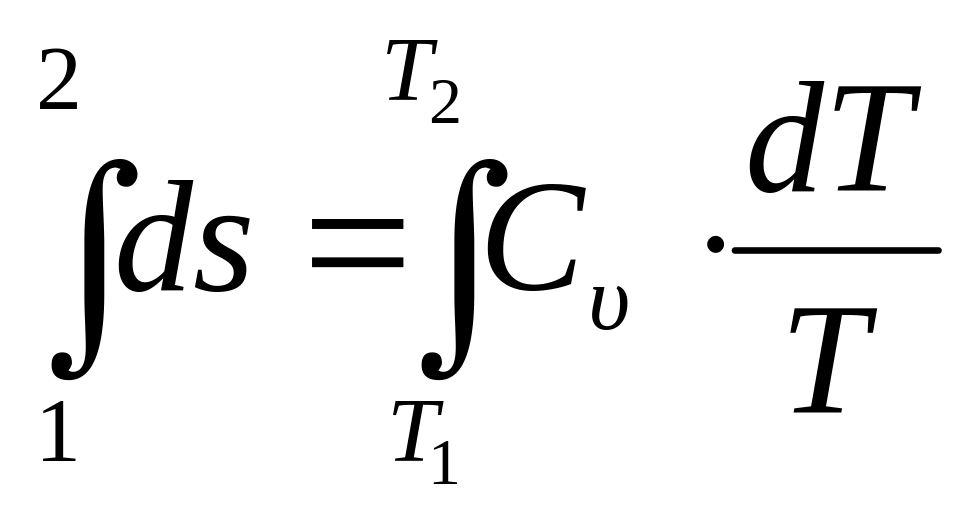 ,
,
при интегрировании считаем, что Cυ не зависит от T и окончательно получаем
∆s1-2
= s2
– s1
= Cυ·ln![]() = Cυ·ln
= Cυ·ln![]() = Cυ·2,3·lg
. (3.11)
= Cυ·2,3·lg
. (3.11)
5. Распределение энергии в изохорном процессе изобразим в виде схем, представленных на рис. 3.2,а и 3.2,б. Коэффициент распределения энергии α = ∆U/q = 1.

Рис. 3.2. Распределение энергии в изохорном процессе: а – при подводе теплоты к рабочему телу (процесс 1–2), б – при отводе теплоты от рабочего тела (процесс 2–1)
