
- •Термодинамика и теплопередача. Учебное пособие
- •Раздел I. Техническая термодинамика
- •Содержание
- •Раздел I
- •Тема 1. Газ, как рабочее тело термодинамических систем
- •Тема 2. Первый закон термодинамики
- •Тема 3. Термодинамические процессы
- •Тема 4. Второй закон термодинамики
- •Тема 5. Идеальные циклы тепловых двигателей
- •Основные условные обозначения
- •Основные сечения потока
- •Сокращения
- •Используемые индексы
- •Предисловие
- •Введение
- •Раздел I техническая термодинамика
- •Тема 1. Газ, как рабочее тело термодинамических систем
- •1.1. Структура основных понятий термодинамики авиационных гтд
- •1.2. Основные понятия и определения термодинамики
- •1.3. Реальный и идеальный газы. Параметры состояния рабочего тела
- •1.3.1. Давление
- •1.3.2. Температура
- •1.3.3. Удельный объём, плотность
- •1.4. Уравнение состояния идеального и реального газов
- •1.4.1. Уравнение состояния идеального газа
- •1.4.2. Уравнение состояния реального газа
- •1.5. Понятие о термодинамическом процессе. Равновесные (обратимые) и неравновесные (необратимые) процессы
- •1.5.1. Равновесные (обратимые) процессы
- •1.5.2. Графическое изображение термодинамического процесса
- •1.5.3. Неравновесные (необратимые) процессы
- •Примеры решения задач
- •Решение
- •Решение
- •Решение
- •Проверьте, как Вы усвоили материал
- •Тема 2. Первый закон термодинамики
- •2.1. Внутренняя энергия рабочего тела. Изменение внутренней энергии
- •2.2. Работа газа, как форма передачи энергии в термодинамическом процессе
- •2.3. Теплота, как форма передачи энергии в термодинамическом процессе
- •2.4. Энтропия. Энтропийная “t-s” диаграмма
- •2.5. Зависимость количества работы и теплоты от характера термодинамического процесса
- •2.6. Теплоёмкость газа. Уравнение Майера. Показатель адиабаты
- •2.7. Энтальпия
- •2.8. Техническая работа (работа движущегося газа)
- •2.9. Содержание и уравнение первого закона термодинамики
- •2.10. Чистые вещества и смеси газов
- •Примеры решения задач
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Проверьте, как Вы усвоили материал
- •Тема 3. Термодинамические процессы
- •3.1. Последовательность и объём расчёта термодинамических процессов
- •3.2. Изохорный процесс: определение, осуществление и исследование
- •3.2.1. Исследование изохорного процесса
- •3.3. Изобарный процесс: определение, осуществление и исследование
- •3.3.1. Исследование изобарного процесса
- •3.4. Изотермический процесс: определение, осуществление, исследование
- •3.4.1. Исследование изотермического процесса
- •3.5. Адиабатный (изоэнтропический) процесс: определение, осуществление, исследование
- •3.5.1. Исследование адиабатного процесса
- •3.6. Сравнение адиабаты и изотермы
- •3.7. Обобщающее значение политропных процессов
- •3.8. Энтальпийная “I-s” диаграмма (“I-s” координаты)
- •Примеры решения задач
- •Решение
- •Решение
- •Решение
- •Решение
- •Проверьте, как Вы усвоили материал
- •Тема 4. Второй закон термодинамики
- •4.1. Понятие о круговых процессах (циклах). Прямой цикл (цикл тепловой машины)
- •4.2. Полезная работа цикла. Термический кпд цикла
- •4.3. Цикл Карно и теорема Карно
- •4.4. Обратные циклы (циклы холодильных машин)
- •4.5. Второй закон термодинамики. Формулировки второго закона термодинамики
- •4.6. Второй закон термодинамики и энтропия
- •4.7. Статистическая интерпретация второго закона термодинамики
- •Примеры решения задач
- •Решение
- •Решение
- •Решение
- •Решение
- •Информация к размышлению
- •Проверьте, как Вы усвоили материал
- •Тема 5. Идеальные циклы тепловых двигателей
- •5.1. Особенности термодинамического метода исследования циклов тепловых двигателей
- •5.2. Схема устройства и принцип работы авиационного газотурбинного двигателя (гтд)
- •5.3. Идеальный цикл гтд (цикл Брайтона – Стечкина)
- •5.4. Работа и термический кпд цикла гтд
- •5.6. Сравнение циклов Брайтона и Гемфри
- •5.7. Цикл с регенерацией тепла
- •5.8. Цикл со ступенчатым подводом тепла
- •5.9. Эксергетический метод термодинамического анализа
- •5.10. Идеальные циклы двигателей внутреннего сгорания (двс)
- •5.10.1. Идеальный цикл двс с подводом тепла
- •5.10.2. Идеальный цикл двс с подводом тепла при постоянном
- •5.10.3. Сравнение циклов Отто и Дизеля
- •5.10.4. Цикл двс со смешанным теплоподводом
- •Примеры решения задач
- •Решение
- •Решение
- •4. Эффективность цикла оцениваем по величине термического кпд цикла
- •Решение
- •Проверьте, как Вы усвоили материал
- •Заключение
- •Список использованной литературы
- •Приложение
- •Международная стандартная атмосфера (мса) гост 4401–81 (фрагмент)
- •Теплофизические величины
- •Соблюдайте гост 8.417 – 2002
1.5.2. Графическое изображение термодинамического процесса
Наглядное представление о состоянии рабочего тела термодинамической системы удобно изобразить графически в координатах “p-υ” (рис. 1.5).
1.5.3. Неравновесные (необратимые) процессы
Обратимые процессы предполагают отсутствие трения. В самом деле, если в процессе расширения рабочего тела имеется трение, то на это затрачивается часть совершаемой работы, которая переходит в эквивалентное количество тепла, воспринимаемое самим рабочим телом. Поэтому работа расширения при наличии трения будет меньше, чем при его отсутствии. Если сжимать теперь рабочее тело с целью возврата его в исходное состояние, то затрата работы на сжатие по абсолютной величине будет больше, чем при отсутствии трения, т.к. на преодоление трения затрачивается работа. Таким образом, при наличии трения работа расширения будет меньше работы сжатия до первоначального состояния. Следовательно, процесс при наличии трения является необратимым.
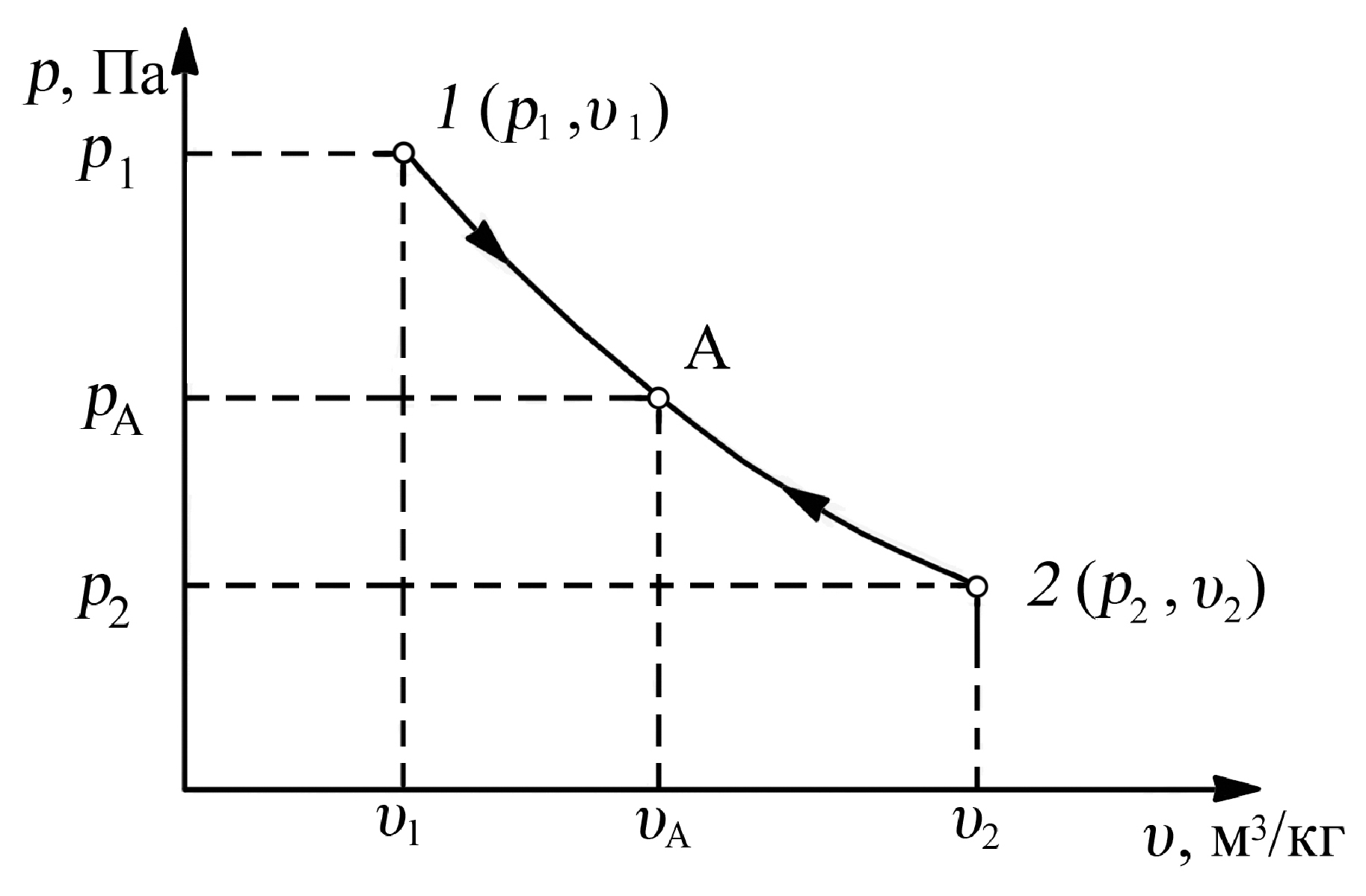
Рис. 1.5. Состояние рабочего тела в координатах “p-υ”
Точка 1 (p1 , υ1) – начальное равновесное состояние;
Точка 2 (p2 , υ2) – конечное равновесное состояние;
Точка А (pА , υА) – промежуточное равновесное состояние;
Линия 1–2 – равновесный термодинамический процесс;
Линия 2–1 – обратимый термодинамический процесс
Потеря работы при необратимых процессах, связанная с их необратимостью, называется диссипацией (рассеянием) энергии. Следует заметить, что согласно первому закону термодинамики общее количество энергии при этом не уменьшается, однако работоспособность системы из-за необратимости процесса меньше.
Трение вызывает необратимость любых механических процессов. В качестве примера можно привести течение газа или жидкости с трением; трение в потоке всегда приводит к диссипации энергии: хотя трение не уменьшает общий запас энергии потока (работа трения переходит в тепло), величина полезной работы, которую газ способен совершить при этом, становится меньше. Эффект (например, трение), делающие процессы необратимыми, называются диссипативными.
Процессы, происходящие под действием больших разностей температур и давлений, называются неравновесными или необратимыми.
Процессы, связанные с самопроизвольным переходом системы из неравновесного в равновесное состояние, также являются необратимыми. Вот некоторые примеры необратимых процессов: переход теплоты от нагретого тела к холодному; взаимное перемешивание двух различных газов, попавших в один объём; расширение газа в пустоту и др. Следует подчеркнуть, что всякий необратимый процесс характеризуется определённой направленностью. Он развивается в каком-то одном направлении и не развивается в обратном.
В течение неравновесного процесса состояние системы невозможно характеризовать определёнными значениями параметров состояния. Поэтому неравновесный процесс невозможно изображать в диаграмме состояний.
Отметим еще одну особенность неравновесных процессов. Количество энергии, переданное окружающей (внешней) средой в виде работы, не соответствует количеству энергии, воспринятому термодинамической системой в виде работы, так как в неравновесном процессе, часть работы неизбежно самопроизвольно превращается в теплоту из-за трения, которое всегда сопровождает такого рода процесс.
Подчеркнем, что при неравновесном процессе невозможно выразить количество теплоты и работы через параметры состояния, так как часть энергии, переданной внешней средой термодинамической системе в одном виде, воспринимается системой в ином виде.
Реальные процессы, протекающие в природе, технических устройствах в принципе являются неравновесными. Это объясняется тем, что изменение состояния системы, представляющее собой термодинамический процесс, может быть осуществлено только посредством внешнего воздействия путём нарушения равновесия. Однако можно представить такие условия протекания реальных процессов, когда они становятся практически равновесными (квазистатическими). Любые нарушения в равновесии системы должны быть бесконечно малыми, это может быть достигнуто медленным изменением состояния системы, т.е. медленным протеканием процесса.
Таким образом, равновесный процесс является предельным случаем неравновесного при стремлении скорости протекания последнего к нулю. Замена реального процесса равновесным позволяет для его исследования использовать термодинамические уравнения и методы анализа, что даёт весьма плодотворные результаты и часто очень точные.
В механике самопроизвольные обратимые процессы могут осуществляться в идеальных случаях. Пример – механические колебания в системах без трения. Особенность самопроизвольных термодинамических процессов состоит в том, что даже в идеальном случае они оказываются необратимыми. Например, можно представить диффузию двух идеальных газов. После их перемешивания никогда не удастся вернуть газы в исходное состояние. Или представьте себе два идеальных газа имеющих в начальном состоянии разную температуру, которые находятся в разных частях замкнутой термодинамической системы. Пусть эти части разделены абсолютно теплопроводной перегородкой. Между этими частями возникнет теплообмен, в результате которого газ, имеющий более низкую температуру, нагреется, а другой газ охладится. Однако самопроизвольно никогда не произойдёт обратного процесса – охлаждение более холодного газа и нагревание более горячего.
В заключение следует заметить, что все процессы, протекающие в природе или в технических устройствах, в той или иной мере являются необратимыми из-за конечной скорости их протекания (ведущей к неравновесности) или из-за наличия диссипативных эффектов, например – трения. Поэтому обратимые процессы по отношению к реальным необратимым являются в некотором смысле идеальными, обладающими наибольшим совершенством и отсутствием потерь работы из-за необратимости. Обратимые процессы можно рассматривать как предельные, по которым оценивается качество реальных процессов.
