
Неметаллы лекция 4
.pdf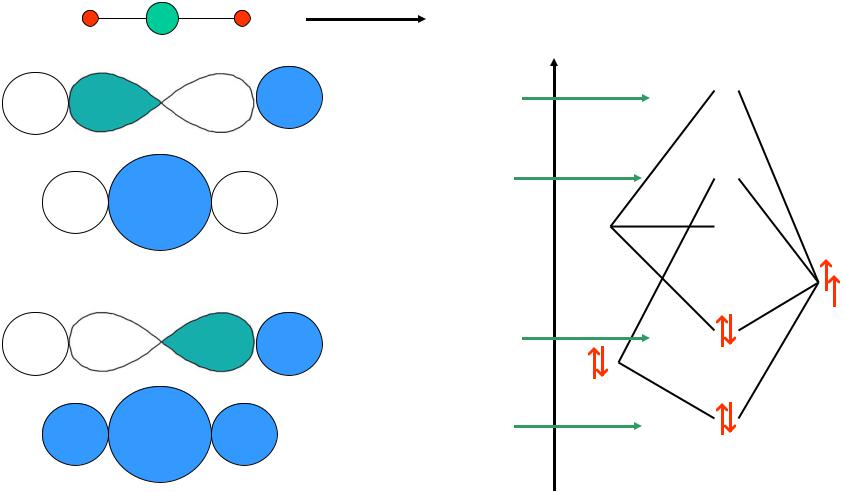
vk.com/club152685050 | vk.com/id446425943
МО трехатомной молекулы
BeH2
z
|
E |
|
|
|
|
|
Be |
BeH2 |
2H |
||||||||||||
1s |
– 2pz + 1s |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
2σu |
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
1s |
– 2s + 1s |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2σg |
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2p |
1πu |
|
|
|
|
|
|
1s |
|||||||||||
1s |
+ 2pz + 1s |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(x2) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
1σu |
|
|
|
|
|
|
|
|
|||||||
|
|
2s |
|
|
|
|
|
|
|
1σg |
|||||||||||
1s |
+ 2s + 1s |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
vk.com/club152685050 | vk.com/id446425943
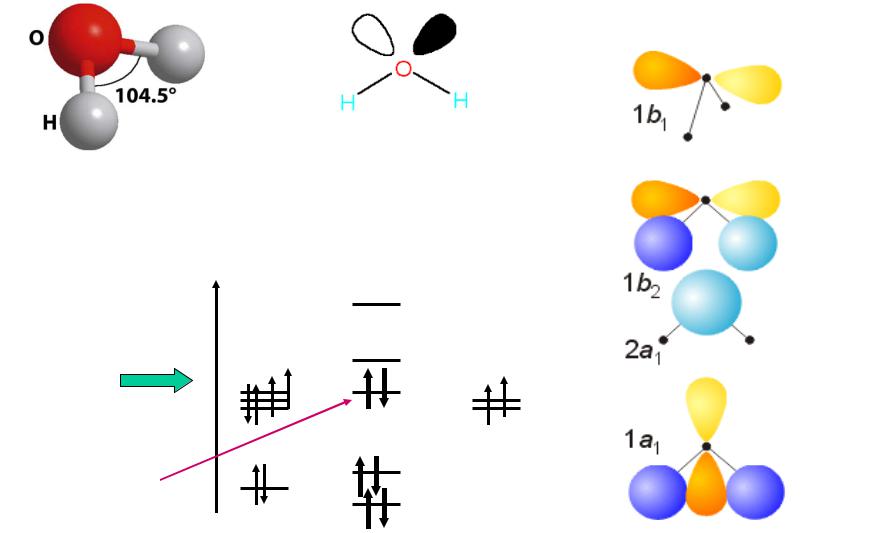
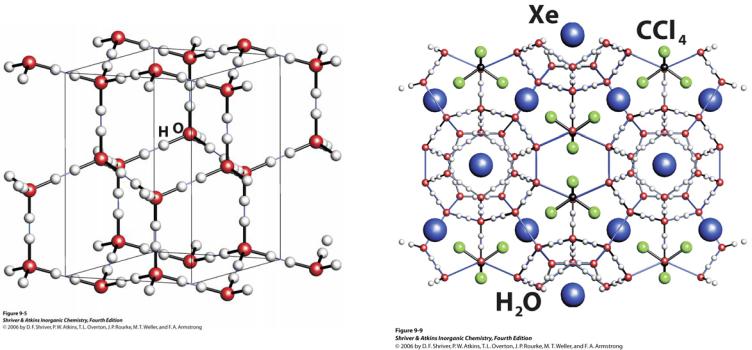
Вода
d(H-O) = 96 pm
E
МО (H2O)
Определяет
донорные
свойства
sp3 – гибридизация АВ2Е2 по Гиллеспи
O H2O H 3a1
2b2
1b1
 1b2
1b2
2a1 1a1
vk.com/club152685050 | vk.com/id446425943
Структура воды
Лед-1 |
Клатрат (Xe)2(CCl4)6· 46(H2O) |
vk.com/club152685050 | vk.com/id446425943
Свойства воды
1. |
G0 |
= –237.1 кДж/моль ε |
298 |
= 78.39 |
μ = 1.84 D |
||
f |
298 |
|
|
|
|
|
|
|
d |
ж |
= 1 г/см3 |
d = 0.92 г/см3 |
|
||
|
|
|
тв |
|
|
|
|
2. 2H2O H3O+ + OH–
kW = 1·1014
основание H2O + HCl H3O+ + Cl– кислота NH3 + H2O NH4+ + OH–
3. Окислитель
2H2O(ж) + 2Al(тв) = 2Al(OH)3 + H2
H2O(г) + 3FeO(тв) Fe3O4 + H2
4. Восстановитель
2H2O + 4CoF3(р-р) = 4CoF2 + O2 + 4HF
vk.com/club152685050 | vk.com/id446425943
Пероксид водорода
Н2О2 бледно-голубая жидкость
Тпл. = -0.4 оС
Ткип = 152 оС (с разложением) fG0298 = -120.5 кДж/моль
μ = 1.57 D
Получение:
BaO2 + H2SO4 = BaSO4↓ + H2O2
Разложение:
Н2О2 (ж) = Н2О (ж) + 1/2 О2 (г)
149 пм
95о
95 пм
rH0298 = -98 кДж/моль
Кислота:
Н2О2 + Н2О Н3О+ + НО2- pKa = 11.65 H2O2 + 2NaOH Na2O2 + 2H2O
vk.com/club152685050 | vk.com/id446425943
Red/OX свойства Н2О2
1. Сильный окислитель в кислой среде
2NaI + Na2O2 + 2H2SO4 = I2 + 2Na2SO4 + 2H2O E0 (H2O2/H2O) = +1.78 В
2. Восстановитель в кислой среде
2KMnO4 + 5H2O2 + 3H2SO4 = 2MnSO4 + 5O2 + K2SO4 + 8H2O E0 (O2/H2O2) = +0.68 В
3.Окислитель в щелочной среде
2Cr(OH)3 + 3H2O2 + 4KOH = 2K2CrO4 + 8H2O E0 (H2O2/OH-) = +1.14 В
4.Восстановитель в щелочной среде
2KOH + Cl2 + H2O2 = 2KCl + O2 + 2H2O
E0 (O2/H2O2) = +0.15 В
5. Гетерогенный окислитель
PbS (тв) + 4H2O2 = PbSO4 (тв) + 4H2O
vk.com/club152685050 | vk.com/id446425943
Элементы 17 группы
F – фтор, Cl – хлор, Br – бром, I – йод, At – астат
vk.com/club152685050 | vk.com/id446425943
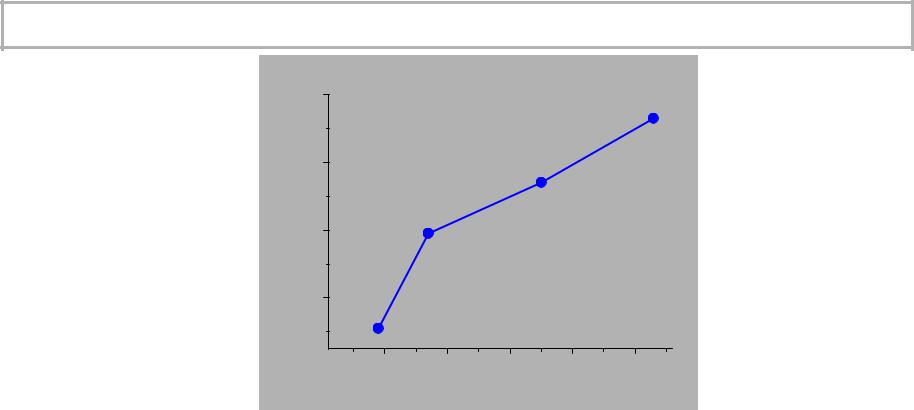
Свойства элементов
F |
Cl |
Br |
I |
Ат. Номер |
9 |
17 |
35 |
53 |
|
Эл. Конф. |
2s22p5 |
3s23p5 |
3d104s24p5 |
4d105s25p5 |
|
Радиус (пм) |
71 |
99 |
114 |
133 |
|
I1 |
(эВ) |
17.46 |
13.01 |
11.82 |
10.30 |
I2 |
(эВ) |
34.71 |
23.85 |
21.47 |
19.11 |
I7 |
(эВ) |
184.2 |
113.8 |
103.5 |
90.2 |
Ae (эВ) |
3.5 |
3.6 |
3.5 |
3.3 |
|
χP |
4.0 |
3.2 |
3.0 |
2.7 |
|
χAR |
4.10 |
2.83 |
2.48 |
2.21 |
|
С.О. |
-1,0 |
-1,0,1,3,(4),5,(6),7 |
-1,0,1,3,5,(7) |
-1,0,(1),3,5,7 |
|
vk.com/club152685050 | vk.com/id446425943 |
|
|
|
|
|
|||
|
|
Свойства элементов |
|
|||||
|
F |
|
|
Cl |
|
|
Br |
I |
Ат. Номер |
9 |
|
|
17 |
|
|
35 |
53 |
Эл. Конф. |
2s22p5 |
|
|
3s23p5 |
|
|
3d104s24p5 |
4d105s25p5 |
Радиус (пм) |
71 |
|
|
99 |
|
|
114 |
133 |
I1 (эВ) |
17.46 |
140 |
r, пм |
13.01 |
|
|
11.82 |
10.30 |
I2 (эВ) |
34.71 |
23.85 |
|
|
I |
19.11 |
||
|
|
Br |
21.47 |
|||||
I7 (эВ) |
184.2 |
120 |
|
113.8 |
103.5 |
90.2 |
||
|
|
|
||||||
Ae (эВ) |
3.5 |
100 |
|
Cl |
|
|
3.5 |
3.3 |
|
3.6 |
|
|
|||||
χP |
4.0 |
80 |
|
3.2 |
|
|
3.0 |
2.7 |
χAR |
4.10 |
F |
2.83 |
|
|
2.48 |
2.21 |
|
|
|
|
||||||
С.О. |
-1,0 |
|
10 |
20 |
30 |
40 |
50 |
-1,0,(1),3,5,7 |
|
-1,0,1,3,(4),5,(6),7 |
-1,0,1,3,5,(7) |
||||||
|
|
|
|
n |
|
|
|
|
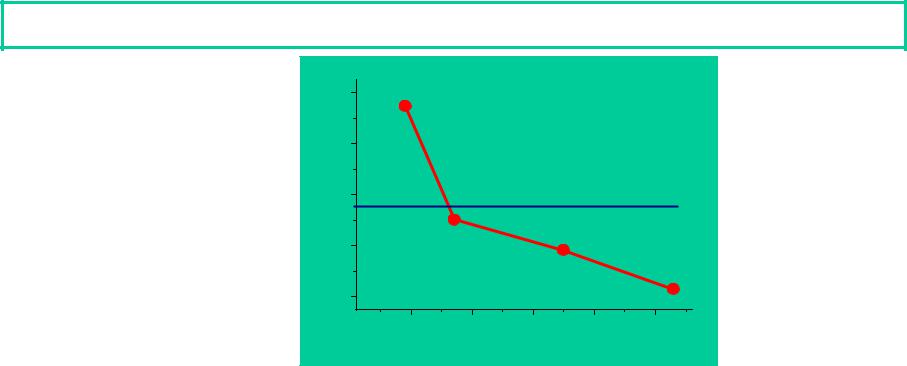
vk.com/club152685050 | vk.com/id446425943 |
|
|
|
|
|
|||||
|
|
Свойства элементов |
|
|||||||
|
F |
|
|
|
Cl |
|
|
|
Br |
I |
Ат. Номер |
9 |
|
|
|
17 |
|
|
|
35 |
53 |
Эл. Конф. |
2s22p5 |
|
|
|
3s23p5 |
|
3d104s24p5 |
4d105s25p5 |
||
Радиус (пм) |
71 |
|
|
|
99 |
|
|
|
114 |
133 |
I1 (эВ) |
17.46 |
|
|
|
13.01 |
|
|
11.82 |
10.30 |
|
I2 (эВ) |
34.71 |
|
I |
1 |
(эВ) |
|
|
|
21.47 |
19.11 |
18 |
|
23.85 |
|
|
||||||
I7 (эВ) |
184.2 |
|
|
113.8 |
|
|
103.5 |
90.2 |
||
16 |
|
|
|
|
||||||
Ae (эВ) |
3.5 |
|
|
3.6 |
|
|
|
3.5 |
3.3 |
|
|
|
|
|
|
|
|||||
χP |
4.0 |
14 |
|
|
3.2 |
|
|
|
Н |
2.7 |
12 |
|
|
|
|
|
3.0 |
||||
χAR |
4.10 |
|
|
2.83 |
|
|
|
2.48 |
2.21 |
|
|
|
|
|
|
|
|||||
С.О. |
-1,0 |
10 |
|
|
|
|
|
-1,0,1,3,5,(7) |
-1,0,(1),3,5,7 |
|
-1,0,1,3,(4),5,(6),7 |
||||||||||
|
|
|
|
|
10 |
20 |
n 30 |
40 |
50 |
|
