
Неметаллы лекция 4
.pdfvk.com/club152685050 | vk.com/id446425943
Свойства элементов
F |
Cl |
Br |
I |
Ат. Номер |
9 |
17 |
35 |
53 |
|
Эл. Конф. |
2s22p5 |
3s23p5 |
3d104s24p5 |
4d105s25p5 |
|
Радиус (пм) |
71 |
99 |
114 |
133 |
|
I1 |
(эВ) |
17.46 |
13.01 |
11.82 |
10.30 |
I2 |
(эВ) |
34.71 |
23.85 |
21.47 |
19.11 |
I7 |
(эВ) |
184.2 |
113.8 |
103.5 |
90.2 |
Ae (эВ) |
3.5 |
3.6 |
3.5 |
3.3 |
|
χP |
4.0 |
3.2 |
3.0 |
2.7 |
|
χAR |
4.10 |
2.83 |
2.48 |
2.21 |
|
С.О. |
-1,0 |
-1,0,1,3,(4),5,(6),7 |
-1,0,1,3,5,(7) |
-1,0,(1),3,5,7 |
|
vk.com/club152685050 | vk.com/id446425943
Свойства элементов
F
Ат. Номер |
9 |
|
Эл. Конф. |
2s22p5 |
|
Радиус (пм) |
71 |
|
I1 |
(эВ) |
17.46 |
I2 |
(эВ) |
34.71 |
I7 |
(эВ) |
184.2 |
Ae (эВ) |
3.5 |
|
χ |
Cl |
|
|
|
Br |
I |
|
|
|
|
|
|
|
||
4,0 |
17 |
|
|
|
35 |
53 |
|
3,5 |
3s23p5 |
|
3d104s24p5 |
4d105s25p5 |
|||
3,0 |
99 |
|
|
|
114 |
133 |
|
|
|
|
|
χP |
|
||
2,5 |
13.01 |
|
11.82 |
10.30 |
|||
23.85 χA-R |
21.47 |
19.11 |
|||||
|
|||||||
2,0 |
113.8 |
30 |
103.5 |
90.2 |
|||
|
10 |
20 |
40 |
50 |
|
||
|
3.6 |
|
n |
|
3.5 |
3.3 |
|
χP |
4.0 |
3.2 |
3.0 |
2.7 |
χAR |
4.10 |
2.83 |
2.48 |
2.21 |
С.О. |
-1,0 |
-1,0,1,3,(4),5,(6),7 |
-1,0,1,3,5,(7) |
-1,0,(1),3,5,7 |
vk.com/club152685050 | vk.com/id446425943
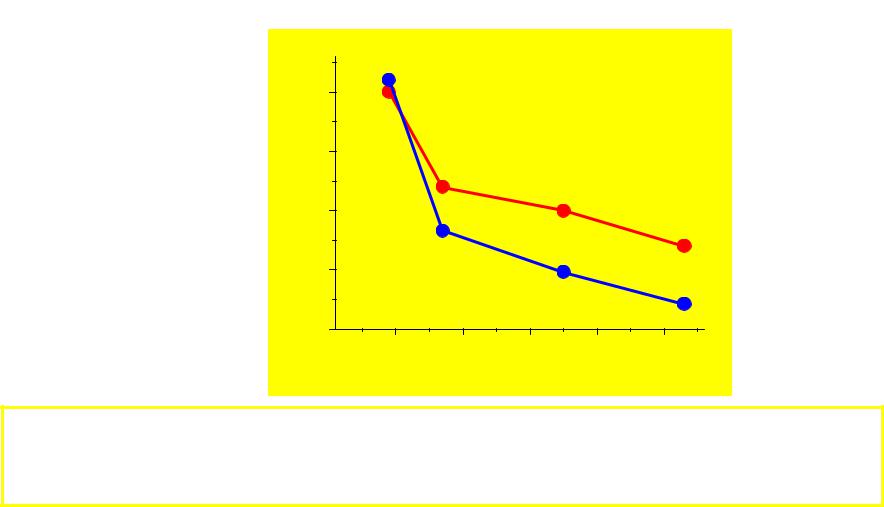
Молекулярные галогены
|
F2 |
Cl2 |
Br2 |
I2 |
Т.кип. (оС) |
-188.1 |
-34.0 |
59.5 |
192.8 (субл.) |
Т.пл. (оС) |
-219.6 |
-101.0 |
-7.2 |
– |
Внешний вид |
бледно- |
желто- |
бурая |
черные |
при н.у. |
желтый |
зеленый |
жидкость |
кристаллы |
|
газ |
газ |
|
|
Н0 дисс., |
158.8 |
242.6 |
192.8 |
151.1 |
кДж/моль |
|
|
|
|
E0 (X /X0), В |
2.869 |
1.358 |
1.065 |
0.535 |
2 |
|
|
|
|
vk.com/club152685050 | vk.com/id446425943
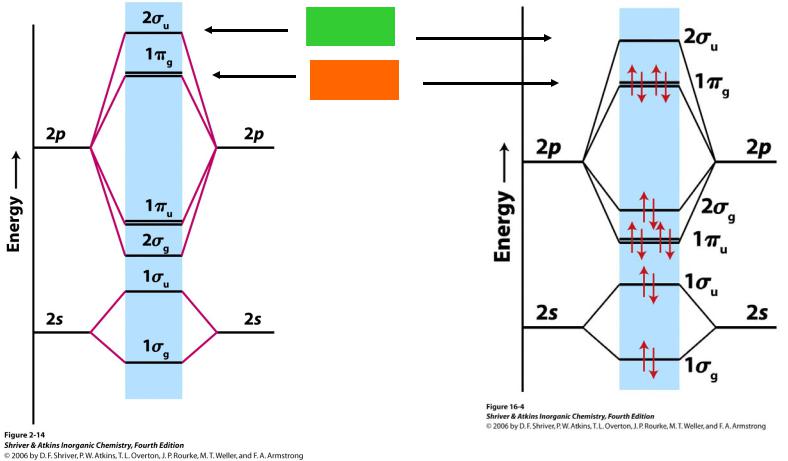
Строение галогенов
В газовой фазе: двухатомные молекулы
F2 Cl2, Br2, I2
НВМО
ВЗМО
Окраска галогенов связана с электронными переходами
vk.com/club152685050 | vk.com/id446425943
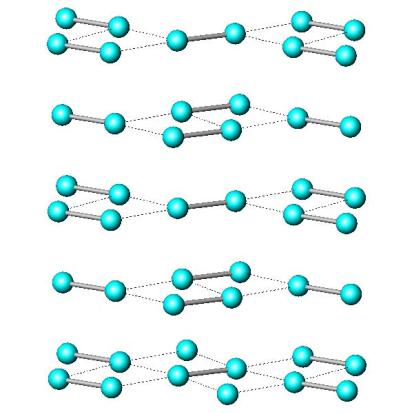
Строение галогенов
В твердой фазе: упаковка двухатомных молекул
|
|
|
|
Cl2 |
Br2 |
I2 |
|
a |
|
a, pm |
198 |
227 |
272 |
|
|
b |
b, pm |
332 |
332 |
350 |
|
|
|
|
|
|
|
c |
|
|
c, pm |
374 |
399 |
427 |
|
||||||
|
|
|
|
|
|
|
|
|
|
b/a |
1.68 |
1.46 |
1.29 |
|
|
|||||
|
|
|
|
|
|
|
Только дипольные взаимодействия !

vk.com/club152685050 | vk.com/id446425943
Химические свойства галогенов
|
|
F2 |
Cl2 |
Br2 |
I2 |
|
1. |
Окислители |
|
ослабление окислительных свойств |
|
||
|
|
|||||
2. |
Взаимодействие |
Н+ + F- |
8.2 г/л |
35 г/л |
0.15 г/л |
|
|
с водой |
+ [O] |
|
|
|
|
3. |
Реакция с Н2 |
взрыв |
очень |
бурно |
обратимо |
|
|
|
при 20К |
бурно |
|
|
|
|
|
= HF |
= HCl |
= HBr |
HI |
|
4. |
Взаимодействие |
бурное |
бурное |
спокойное |
не все |
|
|
с металлами |
|
|
|
|
реагируют |
5. |
Взаимодействие |
кроме |
кроме |
галогены |
только |
|
|
с неметаллами |
He, Ne, |
N2, C, |
халькогены |
галогены |
|
|
|
Ar, O2 |
O2, Ng |
P, As, H2 |
P, As, H2 |
|
6. |
Реакции с |
― |
F2 |
F2, Cl2 |
HNO3 (б/в) |
|
|
окислителями |
|
|
|
|
|
vk.com/club152685050 | vk.com/id446425943
Реакции галогенов
1.F2 + Xe = XeF2 (+ XeF4 + XeF6)
2. |
5Cl2 + 2Sb = 2SbCl5 |
горение |
||
|
2Cl2 + Zr = ZrCl4 |
горение при 250 оС |
||
|
Cl2 + Cu = CuCl2 |
(но не CuCl) |
||
|
Br2 |
(ж) + Hg (ж) = HgBr2 (тв) |
||
|
2I2 + Sn = SnI4 |
CCl4/60oC |
||
3. |
Br2 |
+ H2 |
= 2HBr |
цепная реакция |
|
Br2 |
2Br• |
инициация |
|
|
Br• + H2 |
= HBr + H• |
|
|
|
H• + Br2 |
= HBr + Br• |
развитие |
|
|
HBr + H• = Br• + H2 |
|
||
2Br• = Br2 |
рекомбинация |
|
2H• = H2 |
||
|
4.H2 + I2 2HI обратимая реакция
fG0298 = +1.8 кДж/моль
vk.com/club152685050 | vk.com/id446425943
Реакции галогенов
5. |
2F + 2H O = 4HF + O |
2 |
20oC |
|||
|
|
|
2 |
2 |
|
|
|
X + H |
O H+ + X- + HOX |
20oC |
|||
|
|
2 |
2 |
K = 4.2·10-4 |
X = Cl |
|
|
|
|
|
|
||
|
|
|
|
K = 7.2·10-9 |
X = Br |
|
|
|
|
|
K = 2.0·10-13 |
X = I |
|
|
X |
2 |
+ 2OH- X- + OX- H O |
20oC |
||
|
|
|
K = 7.5·1015 |
2 |
|
|
|
|
|
|
X = Cl |
|
|
|
|
|
|
K = 2·103 |
X = Br |
|
|
|
|
|
K = 30 |
X = I |
|
Для X = Br, I:
3OX- 2X- + XO3-
очень быстрая реакция
vk.com/club152685050 | vk.com/id446425943
Особенности астата
Астат имеет порядковый номер 85,
не имеет стабильных изотопов, почти не встречается в природе, мало изучен химически
209Bi + 4He = 211At + 21n |
получение |
Наиболее устойчивый изотоп 210At, t1/2 = 8 часов, 6 минут
Свойства:
At2 менее летуч, чем I2
At2 + SO2 + 2AgNO3 + 2H2O = 2AgAt↓ + H2SO4 + 2HNO3
At2 окисляется с помощью S2O82- или Br2
vk.com/club152685050 | vk.com/id446425943
Получение галогенов
Фтор получают электролизом HF в расплаве KHF2 или разложением высших фторидов
2CeF4 = 2CeF3 + F2
Хлор получают окислением HCl (в лаборатории) …
KMnO4(тв) + 16HCl(к) + 2KCl = K3MnCl6 + 2Cl2 + 4H2O
… и в хлорщелочном производстве (в промышленности)
2NaCl + 2H2O = Cl2 + 2NaOH + H2 |
электролиз |
||||
|
Анод |
|
Катод |
|
|
Бром и йод получают вытеснением хлором из солей
2KBr + Cl2 = 2KCl + Br2
2KI + Cl2 = 2KCl + I2
