
Неметаллы лекция 4
.pdfvk.com/club152685050 | vk.com/id446425943
Общие закономерности
1.В группе усиливается «металлический» характер элементов. Висмут – типичный металл.
2.Вниз по группе увеличиваются координационные числа от 3 для азота до 9 для висмута.
3.Все элементы, кроме азота полиморфны. Для азота характерны кратные связи, для других элементов – катенация (P>As>Sb>Bi).
4.Вниз по группе уменьшается термическая устойчивость гидридов, ослабевают их основные свойства. Резко уменьшается устойчивость отрицательных с.о.
5.Вниз по группе уменьшается кислотность оксидов и сила кислородных кислот, увеличивается ионность галогенидов.
6.В ряду P – As – Sb – Bi уменьшается устойчивость оксоанионов, увеличивается устойчивость катионов.
7.Окислительная способность в высшей с.о. изменятеся по ряду
Bi>>N>Sb=As>>P.

vk.com/club152685050 | vk.com/id446425943
ВОДОРОД
Лекция № 13
vk.com/club152685050 | vk.com/id446425943
Водород в ПС

vk.com/club152685050 | vk.com/id446425943
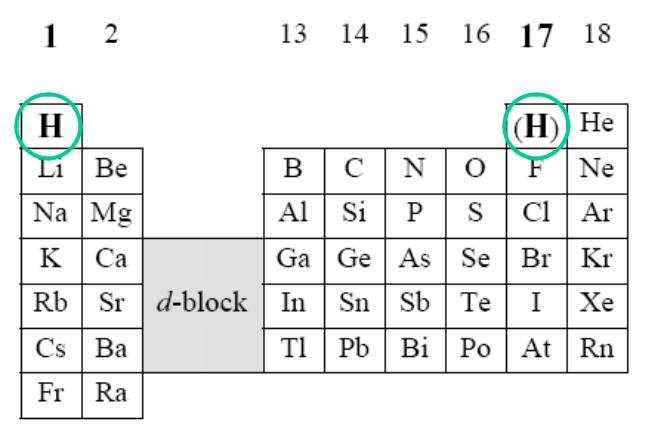
Водород – общие сведения
Простейший атом: 1 протон, 1 электрон
1s1
Двойственное положение в ПС
1 группа |
17 группа |
Имеет 1 валентный |
Требуется 1 валентный |
электрон – аналогия с |
электрон до достижения |
щелочными металлами |
оболочки инертного газа – |
|
аналогия с галогенами |
Самый распространенный элемент во Вселенной – 90% атомов, 75% массы
vk.com/club152685050 | vk.com/id446425943
Изотопы водорода
31T = 32He + β-
распад трития
Есв(Н-Н) – Есв(D-D) = 7.76 кДж/моль |
В.И. Горшков |
|
|
|
(1930-2008) |
D2O
“тяжелая” вода
vk.com/club152685050 | vk.com/id446425943
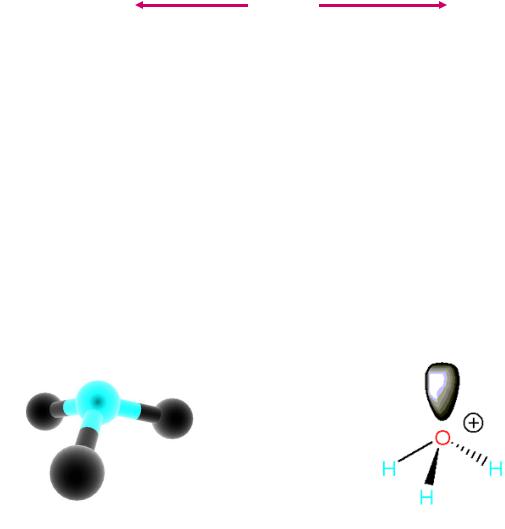
Свойства атомарного водорода
|
|
H+ |
–e– |
H |
|
+e– |
|
|
|
|
|
|
H– |
||
Радиус |
21 pm |
|
37 pm |
|
133 pm |
||
Эл. конф. 1s0 |
|
1s1 |
|
|
1s2 |
||
H – e– = H+ (протон) |
|
I1 = 13.6 эВ (1312 кДж/моль) |
|||||
H + e– = H– (гидрид) |
|
A = 0.75 эВ (72.35 кДж/моль) |
|||||
|
|
|
|
|
e |
||
H+ + H |
O = H O+ |
(гидроксоний) |
h |
H0(298) = –1091 кДж/моль |
|||
2 |
|
3 |
|
|
|
||
H3O+
vk.com/club152685050 | vk.com/id446425943
Молекулярный водород
H2 газ без цвета, запаха и вкуса
Плохо растворим во всех растворителях Т.пл. = –259.3 оС (13.7 К); Т.кип. = –252.7 оС (20.3 К)
атН0298 = 435 кДж/моль |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
МО (Н2) |
Молекулярные ионы: |
||||||||||||||||||||||||||||
|
Н2 |
+ |
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
Е |
|
|
|
|
|
|
σ* |
|
: (σсв) к.с. = 1/2 |
|||||||||||||||||||||
|
|
|
|
|
|
Н |
-: (σ |
св |
)2(σ*)1 |
к.с. = 1/2 |
||||||||||||||||||||
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
σсв |
|
|
+ |
|
Е |
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
Н |
|
Н2 Н |
Н3 |
|
|
|
|
|
|
|
|
|
|
|
|
e' |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
d(H-H) = 74 pm |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
a1' |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
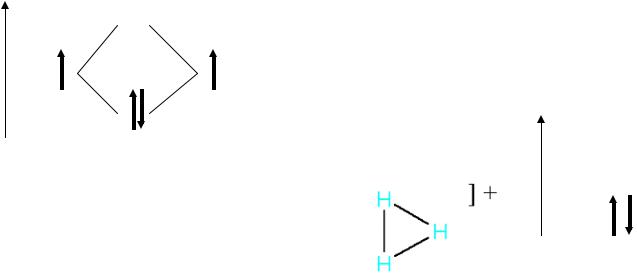
3с-2e– связь
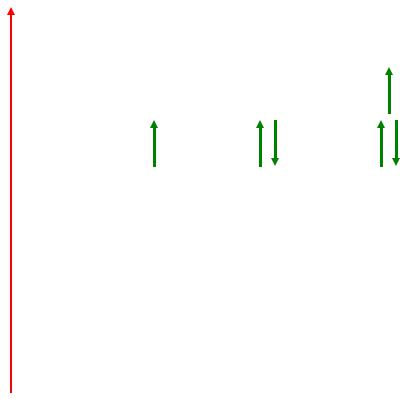
vk.com/club152685050 | vk.com/id446425943
Двухатомные молекулы и ионы
|
Е |
Н2 |
|
|
Н2- |
||||||||||||||
|
|
Н2+ |
|
|
|||||||||||||||
2σ (σ*) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1σ (σсв) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
К.С. |
½ |
|
|
|
1 |
|
|
½ |
|||||||||||
d, Å |
1.06 |
|
0.74 |
1.12 |
|||||||||||||||
E, |
255 |
|
435 |
142 |
|||||||||||||||
кДж/моль |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
vk.com/club152685050 | vk.com/id446425943
Получение и свойства водорода
1. Получение в лаборатории
CaH2 + 2H2O = Ca(OH)2 + 2H2↑
Zn + H2SO4(р) = ZnSO4 + H2↑
2Al + 10H2O + 2NaOH = 2Na[Al(OH)4(H2O)2] + 3H2↑
2. Получение в промышленности
CH4 + H2O(газ) |
Ni |
CO + 3H2 |
(риформинг) |
|||||
1250 K |
||||||||
C(тв) + H2O(газ) |
1300 K |
CO + H2 |
(генераторный газ) |
|||||
|
||||||||
|
|
Fe3O4 |
|
|
|
rH0298 = 131 кДж/моль |
||
СO + H |
O(газ) |
CO + H |
|
|
H0 |
|
= –41 кДж/моль |
|
|
2 |
r |
298 |
|||||
2 |
|
675 K |
2 |
|
|
|||
|
|
|
|
|
|
|
|
|

vk.com/club152685050 | vk.com/id446425943
Получение и свойства водорода
3. Электролиз воды
2H2O |
|
2H2 + O2 |
|
|
|
|
|
|
|
|
|
|
|
4. Низкая реакционная способность |
|
|
|
||||||||||
Тат = 2000 К. |
На холоду в темноте реагирует только с F2 |
||||||||||||
H2 + F2 = 2HF |
(очень бурно) |
|
|
|
|||||||||
5. Активация гетеролитической диссоциации |
|
|
|
||||||||||
CO + 2H |
ZnO, 5 атм |
CH |
OH |
|
|
|
|||||||
2 |
500 К |
3 |
|
|
|
|
|
δ+ |
δ– |
||||
CuO + H2 |
|
Cu + H2O |
|
|
|
|
|
|
H |
H |
|||
|
|
Zn – O – Zn – O – Zn – O – Zn – O |
|||||||||||
TiO2 + H2 |
|
TiO + H2O |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|||
N2 + 3H2 |
Al2O3, Fe2O3 2NH3 |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
||||
