
Методы нейтрализации
.pdfvk.com/club152685050 | vk.com/id446425943
Лекция 2
МЕТОДЫ КИСЛОТНО-ОСНОВНОГО ТИТРОВАНИЯ, ИЛИ МЕТОДЫ НЕЙТРАЛИЗАЦИИ
2.1. Характеристика метода
Методы нейтрализации основаны на применении реакций нейтрализации. Основным уравнением процесса нейтрализации в водных растворах
является взаимодействие ионов гидроксония (или водорода) с ионами гидроксила, сопровождающееся образованием слабо диссоциированных молекул воды:
|
Н3О+ + ОН 2Н2О |
или |
Н+ + ОН Н2О |
Методы нейтрализации позволяют количественно определять кислоты (с помощью титрованных растворов щелочей), основания (с помощью титрованных растворов кислот) и другие вещества, реагирующие в стехиометрических соотношениях с кислотами и основаниями в водных растворах (например, соли аммония, реагирующие со щелочами; карбонаты, реагирующие с кислотами, и т. п.).
Применяя специальные приемы титрования, методами нейтрализации можно определять содержание многих солей, дифференцированно (раздельно) титровать смеси сильных, слабых и очень слабых кислот, а также смеси оснований и солей в неводных растворах.
Титрование кислотами и основаниями. Пользуясь каким-либо титрованным раствором, содержащим ионы гидроксония (например, раствором НС1), можно титровать основания; титрованными растворами оснований титруют кислоты.
Техника определения состоит в том, что к определенному количеству раствора основания (или кислоты) постепенно приливают из бюретки титрованный раствор кислоты (или основания) до наступления точки эквивалентности. Количество основания (или кислоты), содержащееся в исследуемом растворе, вычисляют по объему титрованного раствора кислоты (или основания), израсходованного на нейтрализацию определенного объема раствора анализируемого образца или навески исследуемого продукта.
2.2. Установление точки эквивалентности
Определение точки эквивалентности с помощью индикаторов. Точное установление точки эквивалентности, т. е. того момента, когда количество прибавленного реактива В станет эквивалентно количеству реагирующего с ним определяемого вещества А, имеет очень важное значение в титриметрическом анализе вообще и в методе нейтрализации в особенности.
Практически момент эквивалентности (точку эквивалентности) устанавливают индикаторным методом по изменению окраски индикатора, 1—2 капли раствора которого добавляют в титруемый раствор.

vk.com/club152685050 | vk.com/id446425943
Физико-химические, или инструментальные, методы установления точки эквивалентности. В связи с тем, что цветные индикаторы оказываются непригодными для установления точки эквивалентности при титровании сильно окрашенных или мутных растворов, разработаны и широко применяются другие способы установления точки эквивалентности, основанные на наблюдении свойств раствора, резко меняющихся в момент эквивалентности. Большое значение приобрели физические и физико-химические, или инструментальные, методы установления точки эквивалентности, основанные на измерении при помощи специальных приборов некоторых величин, характеризующих какоенибудь свойство раствора (например, электропроводность), которое меняется в процессе титрования постепенно, а в точке эквивалентности — резко. К этим методам титрования относятся кондуктометрические, высокочастотные, потенциометрические, амперометрические и некоторые другие.
3.3. Графический метод изображения процесса нейтрализации Принцип построения кривых, изображающих ход изменения рН в
процессе нейтрализации.
В ходе нейтрализации рН титруемого раствора меняется в зависимости от объема прибавленного стандартного раствора (VВ) и от его титра (ТВ). Следовательно, если на оси абсцисс откладывать процентное содержание остающейся в растворе в разные моменты титрования кислоты или щелочи или количество прибавленного стандартного раствора в миллилитрах, а на оси ординат—отвечающие им значения рН раствора, то получается ряд точек, соединив которые, можно представить ход изменения рН в процессе нейтрализации. Кривые титрования различных кислот и оснований представлены на рис. 2.1.-2.7.
Процесс нейтрализации можно представить графически в виде кривой титрования, изображающей изменение рН титруемого раствора по мере приливания к нему стандартного (титрованного) раствора кислоты или щелочи.
Построение кривой титрования ведут с таким расчетом, чтобы показать значения рН раствора, соответствующие главнейшим моментам титрования.
Значения рН растворов, соответствующие различным моментам титрования, вычисляют по формулам, выражающим значения концентраций ионов водорода в воде, в водных растворах кислот, оснований, гидролизующихся солей и, наконец, в буферных смесях.
Значение кривых нейтрализации. Кривые титрования дают возможность проследить изменение рН раствора в различные моменты титрования, изучить влияние температуры и концентрации реагирующих веществ на процесс нейтрализации, установить конец титрования и, как будет показано в дальнейшем, сделать правильный выбор индикатора.
2.4. Титрование сильной кислоты сильным основанием
Вычисления рН раствора в различные моменты титрования кислоты сильным основанием.

vk.com/club152685050 | vk.com/id446425943
Предположит, что для титрования взято 100 мл 0,1 н. раствора НС1, который титруется 0,1 н. раствором NaOH.
Концентрация ионов водорода в предельно разбавленных растворах водных растворах сильных кислот (типа НСl) практически равняется концентрации этих кислот.
[H+] CHAn
pH = - lg[H+]= -lgCHAn
Концентрация ионов гидроксила в предельно разбавленных растворах сильных оснований (типа NaОН) практически равняется концентрации этих оснований.
[OH ] CKtOH
pOH = - lg[OH ] = -lgCKtOH pH = 14-pOH = 14 + lgCKtOH
Рассмотрим, что произойдет с 0,1 н. раствором НС1, если прилить к нему 50; 90; 99, 99,9 мл 0,1 н. раствора NaOH. При приливании 50 мл 0,1 н. раствора NaOH останется не нейтрализованным 50% НС1; при приливании 90 мл
NaOH—10% НС1; 99 мл NaOH—1% НС1; 99,9 мл NaOH—0,1% НС1.
Тогда, соответственно прибавленному количеству NaOH, объем титруемого раствора увеличится при прибавлении 50 мл NaOH до 150 мл; 90 мл NaOH до 190 мл, 99 мл NaOH до 199 мл и 99,9 мл NaOH до 199,9 мл. Изменятся также концентрация ионов водорода и рН раствора.
Для вычисления концентрации СА определяемого вещества (СHCI) в процессе титрования можно пользоваться формулой:
|
|
|
V |
V |
|
|
|
|
|
|
V |
V |
|
|
|
C |
A |
|
A |
B |
N |
A |
или |
C |
HCl |
|
HCl |
NaOH |
N |
HCl |
|
V |
V |
V |
V |
||||||||||||
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
A |
B |
|
|
|
|
|
|
HCl |
NaOH |
|
|
где VА — первоначальный объем (в мл) раствора определяемого вещества, нормальность которого NА;
VВ — объем (в мл) стандартного (титрованного) раствора реактива, прибавленный в титруемый раствор вещества А. Нормальность стандартного раствора реактива (Мв) тоже равиа NА.
При нейтрализации половины НС1 концентрация хлористоводородной кислоты уменьшится во столько раз, во сколько 50 меньше 150, т. е.:
СHCl= [H+] = 50/150 0,1 = 3,3 10-2 моль/л pH = -lgCHCl = -lg[H+] = 2- lg3,3 = 1,5
Для других случаев значение рН, предшествующее точке эквивалентности, выражают следующим образом:
СHCl= [H+] = 10/190 0,1 = 5,3 10-3 моль/л pH = -lgCHCl = -lg[H+] = 3- lg5,3 = 2,3 СHCl= [H+] = 1/199 0,1 = 5,0 10-4 моль/л pH = -lgCHCl = -lg[H+] = 4- lg5 = 3,3
vk.com/club152685050 | vk.com/id446425943
СHCl= [H+] = 0,1/199,9 0,1 = 5,0 10-5 моль/л pH = -lgCHCl = -lg[H+] = 5- lg5 = 4,3
Если к 100 мл 0,1 н. раствора НС1 прилить 100 мл 0,1 н. раствора NaOH, то будет достигнута точка эквивалентности и рН = рОН раствора станет равным 7. Заметим, что для перехода от рН=4,3 к рН = 7 (т.е. для изменения рН на 2,7 единицы) потребовалось всего 0,1 мл 0,1 н. раствора NaOH. Между тем в начале титрования для перехода от рН = 1 до рН = 3,3 (2,3 единицы рН) потребовалось
99,0 мл 0,1 н. раствора NaOH, т. е. в 1000 раз больше (99,9/0,1).
Если прилить к 100 мл 0,1 н. раствора НС1 100,1 мл, 101 мл, 110 мл 0,1 ,н. раствора NaOH, то раствор станет щелочным вследствие прибавления избытка щелочи. Концентрация ионов гидроксила в этом случае будет равна концентрации избытка едкого натра и может быть вычислена.
Прибавление 100,1 мл 0,1 н. раствора NaOH ведет к разбавлению раствора до 200,1 мл. Такой раствор содержит 0,1 мл избытка 0,1 н. раствора NaOH. Следовательно:
СNaOH= [OH ] = 0,1/200,1 0,1 = 5,0 10 5 моль/л pOH =5 -lg5 = 4,3
pH = 14 - pOH = 14 - 4,3 = 9,7
При добавлении 101 и 110 мл раствора NaOH соответственно будем иметь:
СNaOH= [OH ] = 1/201 0,1 = 5,0 10 4 моль/л pOH =4 -lg5 = 3,3
pH = 14 - pOH = 14 - 3,3 = 10,7
СNaOH= [OH ] = 10/210 0,1 = 4,8 10-3 моль/л pOH =3 -lg4,8 = 2,3
pH = 14 - pOH = 14 - 2,3 = 11,7
На основании полученных данных, которые вносят в таблицу (табл. 2.1.), строят кривую титрования.
Для уменьшения размеров кривой и большей наглядности вычерчивают наиболее характерную часть кривой, лежащую в пределах 10% остатка кислоты и 10% избытка щелочи. В результате получают кривую нейтрализации, показанную на рис. 2.1.
vk.com/club152685050 | vk.com/id446425943
Таблица 2.1.
Титрование 100 мл 0,1 н. раствора НС1 0,1 н. раствором NaOH (с учетом разбавления титруемого раствора)
Прибавле |
Осталось |
[Н"], моль/л |
рН • |
[ОН-], |
|
рОН |
рН/ С |
но 0,1 н. |
НС1, мл |
|
|
моль/л |
|
|
|
раствора |
|
|
|
|
|
|
|
NaOH, мл |
|
|
|
|
|
|
|
|
|
До точки эквивалентности |
|
|
|||
0 |
100 |
10-1 |
1 |
10-13 |
|
13 |
- |
50 |
50 |
3,3•10-1 |
1,5 |
3,0•10-13 |
|
12,5 |
0,5/50=0,01 |
90 |
10 |
5,3 •10-2 |
2,3 |
1,9•10-12 |
|
11,7 |
0,8/40=0,02 |
99,0 |
1 |
5,0 •10-3 |
3,3 |
2,0•10-11 |
|
10,7 |
1/9=0,11 |
99,9 |
0,1 |
5,0 • 10-4 |
4,3 |
2,0 •10-10 |
|
9,7 |
1/0,9=1,1 |
|
|
|
|
|
|
|
|
|
|
В точке эквивалентности |
|
|
|||
100 |
0 |
1 •10-7 |
7 |
1 •10-7 |
|
7 |
2,7/ 0,1=27 |
|
|
|
|
|
|
|
|
|
|
После точки эквивалентности |
|
|
|||
100,1 |
0,1 |
2,0 •10-10 |
9,7 |
5,0•10-5 |
|
4,3 |
2,7/0,1=27 |
|
изб. Na(OH) |
|
|
|
|
|
|
101 |
1 |
2,0 •10-11 |
10,7 |
5,0•10-4 |
|
3,3 |
1/0,9=1,1 |
|
(изб. NaOH) |
|
|
|
|
|
|
110 |
10 |
2,1•10-12 |
11,7 |
4,8•10-3 |
|
2,3 |
1/9=0,11 |
|
(изо. NaOH) |
|
|
|
|
|
|
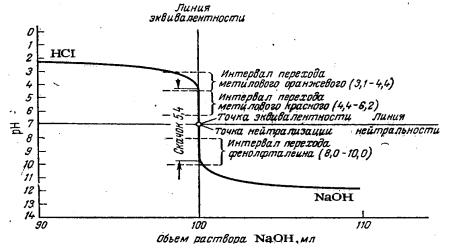
Рис. 2.1. Кривая титрования 0,1 н. раствора НС1 0,1 н. раствором NaOH.
vk.com/club152685050 | vk.com/id446425943
Анализ кривой нейтрализации. В начале титрования рН раствора изменяется медленно; вблизи точки эквивалентности—очень быстро, после точки эквивалентности—опять медленно. Другими словами, если в начале титрования прибавление титрованного раствора основания в количествах, измеряемых миллилитрами, мало изменяет значение рН раствора, то под конец титрования, вблизи точки эквивалентность, большое значение приобретают уже небольшие количества (капли и доли капли) титрованного раствора NaOH, быстро (скачкообразно) изменяющие рН титруемого раствора.
Изменение показателя иона водорода может быть выражено величинойрН/ С, которая означает среднее изменение показателя ионов водорода при добавлении 1 мл титрованного раствора (в данном случае раствора NaOH). Здесь рН—приращение показателя иона водорода, наблюдаемое на данном отрезке титрования; С — количество прибавленного титрованного раствора (в данном случае 0,1 н. раствора NaOH в мл или в %).
Как видно из табл. 2.1., это отношение достигает максимума в точке эквивалентности.
Следует иметь в виду, что чем больше значение рН/С на участке вблизи
точки эквивалентности, тем точнее титрование.
Скачок рН. Особенно резкое изменение рН наблюдается в интервале, когда осталось 0,1% неоттитрованной НС1 или когда прилито 0,1% избытка щелочи. В этом интервале рН быстро изменяется от 4,3 до 9,7, а концентрация [Н+] от 5,0 10-5 до 5,0 10-10 моль/л. Резкое изменение рН раствора, наблюдающееся вблизи точки эквивалентности, т. е. в конце титрования, называют скачком рН. Скачок рН (или скачок титрования) измеряют высотой вертикального участка кривой титрования. Чем больше скачок рН, тем точнее можно оттитровать определяемое вещество.
Влияние концентрации растворов кислот и оснований на характер кривой титрования. Рассмотрим пример титрования 100 мл 1 н. раствора НС1 1 н. раствором NaOH. В этом случае
pH= -lgCHl = — lgl = 0
Изменение рН в процессе титрования до и после точки эквивалентности приведено в табл. 2.2.
В момент достижения точки эквивалентности рН = 7. Для сравнения в таблице показаны изменения рН, наблюдающиеся при нейтрализации 100 мл 1 н., 0,1 н. и 0,01 н. растворов НС1 растворами NaOH такой же концентрации, вычисленные с учетом разбавления раствора.
Данные этой таблицы представлены графически на рис. 2.2.
Анализ кривой (рис. 2.2) и данных табл. 2.2 дает возможность заключить,
что чем выше концентрация титруемого и стандартного растворен, тем больше скачок рН: для 1 н. растворов он составляет 10,7—3,3=7,4 единицы рН,
для 0,1 н растворов он составляет 9,7—4,3=5,4 единицы рН, для 0,01 н. растворов он составляет 8,7-5,3=3,4 единицы рН.

vk.com/club152685050 | vk.com/id446425943
Таблица 2.2.
Влияние концентрации раствора НС1 на изменение рН при титровании (титруется 100 мл раствора различной нормальности с учетом разбавления)
Прибавлено раствора |
Осталось HCI |
|
рН раствора |
|
|
NаОН такой же |
или NaOH, мл |
|
|
|
|
1 н. |
0,1н |
0,01 н. |
|||
концентрации, мл |
|
||||
|
|
|
|
||
|
|
|
|
|
|
|
До точки эквивалентности |
|
|
||
|
|
|
|
|
|
0 |
100 |
0 |
1 |
2 |
|
50 |
50 |
0,5 |
1,5 |
2,5 |
|
90 |
10 |
1,3 |
2,3 |
3,3 |
|
99 |
0,1 |
2,3 |
3,3 |
4,3 |
|
99,9 |
|
3,3 |
4,3 |
5,3 |
|
|
В точке эквивалентности |
|
|
||
100 |
0 |
7,0 |
7,0 |
7,0 |
|
|
После точки эквивалентности |
|
|
||
100,1 |
0,1 (изб. NaOH) |
10,7 |
9,7 |
8,7 |
|
101 |
1 (изб. NaOH) |
11,7 |
10,7 |
9,7 |
|
110 |
10 (изб. NaOH) |
12,7 |
11,7 |
10,7 |
|
Рис. 2.2. Влияние концентрации растворов кислот и оснований на характер кривод титрования:, 1—1 н. раствор НС1; 2— 0,1 н. раствор НС1; 3— 0,01 н. раствор НС1.
Следует, однако, заметить, что скачок рН достаточно велик и при титровании 0,1 н. раствора. Поэтому без особой необходимости не следует прибегать к титрованию растворов более высокой концентрации, чем 0,1 н. Ошибки титрования за счет неточности измерений при пользовании более концентрированными растворами значительно возрастают по сравнению с ошибками при титровании менее концентрированных растворов.
Влияние температуры водного раствора на изменения рН в процессе
vk.com/club152685050 | vk.com/id446425943
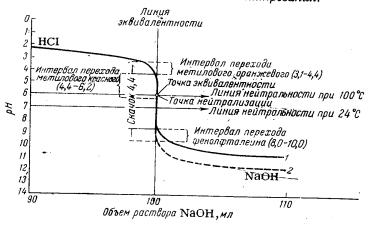
титрования. Ионное произведение воды Кw сильно возрастает с повышением температуры и при 100 °С увеличивается почти в 100 раз по сравнению с KW при 18 °С. При 100 °С величина Kw становится приблизительно равной 10-12. Поэтому повышение температуры оказывает сильное влияние на скачок рН. В точке нейтрализации величина изменения рН зависит от значения KW. Если KW =10-14, то точке нейтрализации соответствует рН==7; если KW =10-12 (как это имеет место при 100 °С), то точке нейтрализации соответствует рН=6, т. е. скачок рН изменяется. Для сравнения приводим кривую титрования 0,1 н. раствора НС1 0,1 н. раствором NaOH при температуре 100 °С (рис. 2.3.). Данные, соответствующие этой кривой, приведены в табл. 2.3.
Таблица 2.3.
Изменение рН в процессе титрования 100 мл 0,1 н. раствора НС1 0,1 н. раствором NaOH при температуре 100 °С
(с учетом разбавления титруемого раствора)
Прибавле |
Оста- |
рН |
рН / C |
Прибавлено |
Осталось НС1, |
рН |
рН/ C |
но 0,1 н. |
лось |
|
|
0,1 н |
мл |
|
|
раствора |
НС1, |
|
|
раствора |
|
|
|
NаOH. мл |
мл |
|
|
NaOH, мл |
|
|
|
0 |
100 |
1 |
- |
100* |
0 |
6 |
1,7 /0,1=17 |
50 |
50 |
1,5 |
0,5/50=0,01 |
100,1 |
0,1 (изб. NaOH) |
7,7 |
1,7/0,1=17 |
90 |
10 |
2,3 |
0,8/40=0,02 |
101 |
1 (изб. NaOH) |
8,7 |
l/0,9=1,1 |
|
|
|
|
|
|
|
|
99 |
1 |
3,3 |
1/9=0,ll |
110 |
10 (изб. NaOH) |
9,7 |
1/9=0,ll |
|
|
|
|
|
|
|
|
99,9 |
0,1 |
4,3 |
1/0,9=1,1 |
|
|
|
|
|
|
|
|
|
|
|
|
Анализ кривой (рис. 2.3.) и данные табл. 2.3. показывают, что при титровании горячих растворов скачок рН уменьшается; чем выше
температура титруемого раствора, тем меньше скачок титрования.
Рис. 2.3. Кривые нейтрализации 0,1 н. раствора НС1 0,1 н. раствором NaOH: 1—кривая титрования при 100 °С; 2— кривая титрования при 24 °С
vk.com/club152685050 | vk.com/id446425943
Отсюда следует, что титрование по методу нейтрализации лучше проводить на холоду (без нагревания).
Влияние разбавления раствора в процессе титрования на точность расчета.
При расчете рН мы учитывали разбавление титруемого раствора, вызываемое постепенным прибавлением раствора щелочи к раствору кислоты. Поэтому в конце титрования, когда вся кислота нейтрализована, объем раствора увеличивается вдвое и становится равным 200 мл. Однако, как показывает опыт, точность расчета мало уменьшается, если пренебречь наблюдающимся разбавлением и считать объем титруемого раствора достоянным. Ошибки в расчете, допускаемые в данном случае, небольшие и не отражаются на принципиальных выводах, вытекающих из теории нейтрализации, поэтому с ними можно не считаться.
Покажем на примере титрования 0,1 н. раствора НС1 0,1 н. растворим NaOH, какая разница получается между значениями рН, вычисляемыми с учетом и без учета разбавления.
До начала титрования рН=1. Если прилить к 0,1 н. раствору НС1 50; 90; 99; 99,9 мл 0,1 н. раствора NaOH, то соответственно будет нейтрализовано 50, 90, 99, 99,9% и останется не нейтрализованным 50, 10, 1. 0,1% НС1. Изменится также концентрация ионов водорода и рН раствора:
при нейтрализации 50 мл НС1 (рН =1,3). . . [Н+] =50/100 0,1=5,0 10-2 моль/л при нейтрализации 90 мл НС1 (рН = 2) . . . [Н+] =10/100 0,1= 10-2 моль/л при нейтрализации 99 мл НС1 (рН=3) . . . [Н+] =1/100 0,1=10-3 моль/л при нейтрализации 99,9 мл НС1 (рН=4) . . . [Н+] =0,1/100 0,1=10-4 моль/л
Другими словами, если пренебречь изменением объема титруемого раствора, то в первом случае не нейтрализованной НС1 останется в 2 раза меньше, чем ее было до начала титрования. Следовательно, ее концентрация станет в два раза меньше первоначальной:
0,1/2 = 5,0 10-2 моль/л
Когда к раствору соляной кислоты будет прилито до 90 мл 0,1 н. раствора NaOH, ее концентрация уменьшится в 10 раз и станет равной 0,1/10=10-2 моль/л. Когда к титруемому раствору прибавят 99 мл NaOH, то концентрация НС1 уменьшится еще в 10 раз (или в 100 раз по сравнению с первоначальной) и будет равна 0,1/100=10-3 моль/л и т. д.
В точке эквивалентности количество прибавленного 0,1 н. раствора NaOH должно составлять 100 мл. В этот момент:
[Н+] = [ОН-] = 10-7 г-ион/л, рН = рОН = 7
Именно в этот момент заканчивается титрование. Если прилить 0,1; 1 и 10 мл избытка 0,1 н. раствора NaOH, то соответственно будет возрастать [ОН-]:
vk.com/club152685050 | vk.com/id446425943
впервом случае (рОН=4: рН=10) . . .[ОН-]=0,1/100•0,1=10-4 моль/л во втором случае (рОН=3: рН=11) . . . .[ОН-]=1/100•0,1=10-3 моль/л
втретьем случае (рОН=2; рН=12) . . . .[ОН-]=10/100•0,1=10-2 моль/л Полученные результаты сведены в табл. 2.4.
Таблица 2.4.
Титрование 100 мл 0,1 н раствора НС1 0,1 н раствором NaOH (без учета разбавления титруемого раствора)
Прибавлено |
Осталось HCI, |
[H+] |
рН |
[OH-] |
рОН |
рН/ С |
раствора NaOH, мл |
мл |
г-ион/л |
|
г-ионОН/л |
|
|
|
|
|
|
|
|
|
0 |
100 |
10-1 |
1 |
10-13 |
13 |
- |
50 |
50 |
5,0 10-2 |
1,3 |
2,1 10-13 |
12,7 |
0,3/50 =0,006 |
90 |
10 |
10-2 |
2 |
10-12 |
12 |
0,7/40=0.0175 |
99 |
1 |
10-3 |
3 |
10-11 |
11 |
1/9=0,11 |
99,9 |
0,1 |
10-4 |
4 |
10-10 |
10 |
1/0,9=1,1 |
100* |
0 |
10-7 |
7 |
10-7 |
7 |
3/0,1=30 |
100,1 |
0,1 (изб. NaOH) |
10-10 |
10 |
10-4 |
4 |
3/0,1=30 |
101 |
1 (изб. NaOH) |
10-11 |
11 |
10-3 |
3 |
1/0,9=1,1 |
110 |
10 (изб. NaOH) |
10-12 |
12 |
10-2 |
2 |
1/9=0,011 |
Сопоставляя данные табл. 2.1. и 2.4., можно видеть, что:
во-первых, при титровании 0,1 н. раствора НС1 0,1 н. раствором NaOH порядок и характер получаемых цифр одинаковы в обоих случаях расчета, т. е. с учетом и без учета разбавления раствора во время титрования;
во-вторых, характер наблюдаемых кривых идентичен; в-третьих, наибольшее расхождение в значении рН не превышает 0,3,
например, значениям рН раствора, равным 2,3; 3,3, 4,3; 9,7; 10,7 и 11,7 (табл. 2.1.), соответствуют следующие значению рН: 2; 3; 4; 10; и 12 (табл. 2.4.). Такое ничтожно малое расхождение не отражается на принципиальных выводах, которые можно сделать на основании данных табл. 2.4. и анализа кривых.
Простота и удобство метода расчета рН без учета разбавления титруемого раствора представляют некоторые преимущества по сравнению с методом расчета с учетом разбавления раствора. В дальнейшем все приводимые расчеты, применяемые для построения кривых титрования, выполнены без учета изменения объемов растворов во время титрования. Это, конечно, не соответствует действительности и приводит к известным ошибкам опыта. Однако изменения рН в точке эквивалентности, т. е. именно тогда, когда нужно заканчивать титрование, обычно настолько значительны, что ошибки опыта при таком допущении оказываются ничтожными.
Все приведенные рассуждения с одинаковым успехом применимы при рассмотрении процесса титрования сильных оснований сильными кислотами.
2.5. Титрование слабой кислоты сильным основанием
Вычисление рН раствора в различные моменты титрования кислоты щелочью. Предположим, что для титрования взято 100 мл 0,1 н. раствора
