
Неметаллы лекция 4
.pdf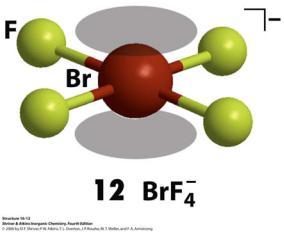
vk.com/club152685050 | vk.com/id446425943
Свойства МГС
3. |
Образование солей |
|
|
|
|||
|
ClF + CsF = Cs[ClF2] |
|
|
||||
|
I2 + 3Cl2 + KCl + 2H2O = 2K[ICl4]·2H2O↓ |
||||||
|
2KClO3 + 3KI + 12HCl = 3K[ICl4]·2H2O↓ + 2KCl |
||||||
4. |
Галогенирование |
|
|
|
|||
|
W + 6ClF = WF6 + 3Cl2 |
|
|
||||
|
2Co3O4 + 6ClF3 = 6CoF3 + 3Cl2 + 4O2 |
||||||
5. |
Автоионизация |
|
|
|
|
||
|
2BrF |
3 |
(ж) BrF |
+ + BrF |
- |
|
|
|
|
|
2 |
4 |
|
||
|
BrF |
+ AsF |
= [BrF +][AsF -] |
основание |
|||
|
3 |
|
5 |
|
2 |
6 |
|
|
NOF + BrF |
= [NO+][BrF |
-] |
кислота |
|||
|
|
|
3 |
|
4 |
|
|
vk.com/club152685050 | vk.com/id446425943
Строение МГС
Описание по методу Гиллеспи
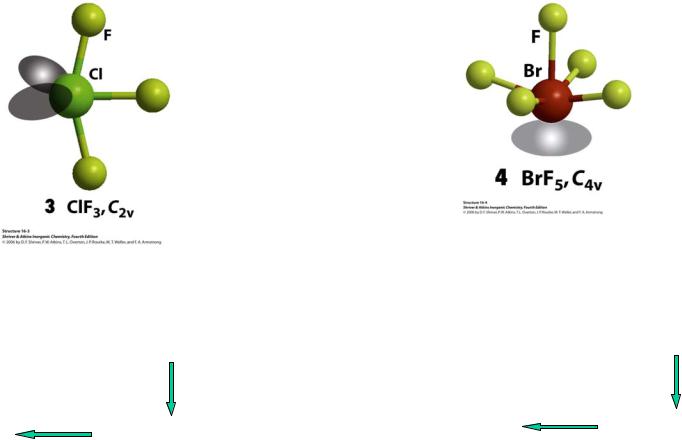
ClF3 |
BrF5 |
|
|
7e- (Cl) + 3e- (F) = 10e- |
7e- (Br) + 5e- (F) = 12e- |
АВ3Е2 |
5е--пар |
АВ5Е |
6е--пар |
Т-образная молекула, |
Квадратная пирамида, |
||
псевдо-тригональная бипирамида |
псевдо-октаэдр |
||
vk.com/club152685050 | vk.com/id446425943
Строение МГС
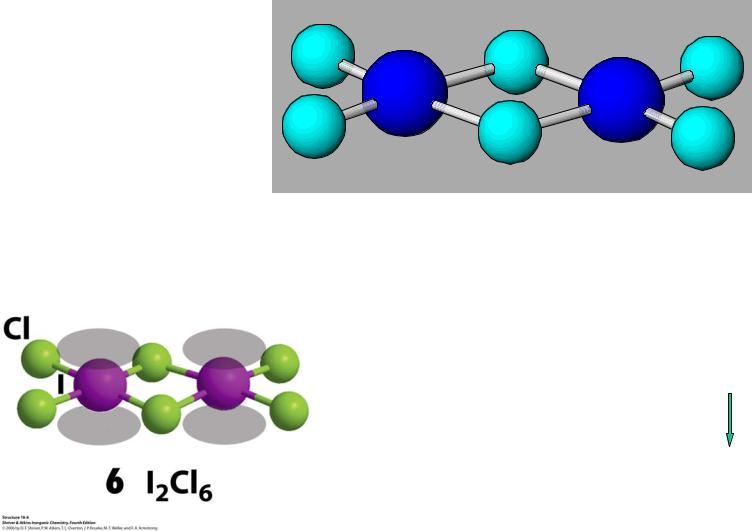
Строение I2Cl6
Всегда димер !
Описание по методу Гиллеспи:
7e- (I) + 2e- (Cl) + ½·2e- (μ-Cl) = 10e-
АВ4Е2  (4+1)е--пар квадрат, псевдо-октаэдр
(4+1)е--пар квадрат, псевдо-октаэдр
vk.com/club152685050 | vk.com/id446425943
Полигалогенид-анионы
Полигалогенид-анионы:
• наибольшее количество известно для I
I3-, I42-, I5-, I7-, I82-, I9-, I104-, I123-, I162-, I164-, I224-, I293-
•родственны МГС
•образуются Cl, Br, I, но не F Образование:
KI (aq) + I2 KI3 (aq) (+KI9)
I- + I |
I - |
K ≈ 100 при 25 оС |
2 |
3 |
|
d(I-I) = 283 и 303 пм в CsI3 = 290 пм в [Ph4P]I3
Гипервалентный анион I3-
vk.com/club152685050 | vk.com/id446425943
Кислородные соединения галогенов
Оксиды фтора → фториды кислорода |
|
|
|
|
|
||
|
OF2 |
O F , O F , O F |
2 |
||||
Т.пл. |
-223.8 оС |
2 |
2 |
3 |
2 |
4 |
|
Разлагаются ниже 0 оС |
|||||||
Т.кип. |
-145.3 оС |
|
|
|
|
|
|
Т.разл. +201 оС |
|
|
|
|
|
|
|
0oC
NaOH (разб) + F2 → 2NaF + OF2 + H2O
 141 пм
141 пм
Сильнейший фторокислитель !
to
OF2 + H2O → O2 + HF |
103о |
vk.com/club152685050 | vk.com/id446425943
Обзор оксидов Cl, Br, I
с.о. |
Cl |
Br |
+1 |
Cl2O |
Br2O |
+2 |
|
|
+3 |
Cl2O3 |
Br2O3 |
+4 |
ClO2 |
BrO2 |
+5 |
|
Br2O5 |
+6 |
Cl2O6 |
|
+7 |
Cl2O7 |
|
I
I2O4 I2O5 I2O6
Cl2O6 |
Cl2O7 |
vk.com/club152685050 | vk.com/id446425943
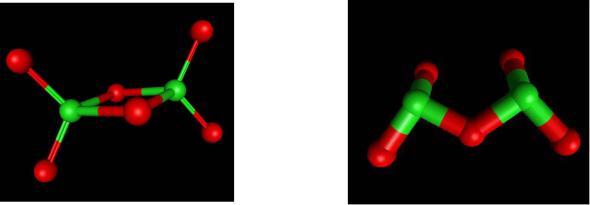
Оксиды хлора
|
Cl2O |
ClO2 |
Cl2O6 |
Cl2O7 |
С.о. |
+1 |
+4 |
+6 |
+7 |
Т.пл., оС |
-120.6 |
-59 |
3.5 |
-91.5 |
Т.кип., оС |
2 |
11 |
203 |
81 |
Внешний |
желто- |
желто- |
красная |
бесцв. |
вид |
коричн. |
зеленый |
жидкость |
жидкость |
|
газ |
газ |
|
|
Cl2O
2Cl2 |
+ 3HgO = Hg3O2Cl2 + Cl2O |
получение |
2Cl2 |
+ Bi2O3 = 2BiOCl + Cl2O |
|
Cl2O + 2KOH = 2KOCl + H2O |
ангидрид |
|
vk.com/club152685050 | vk.com/id446425943
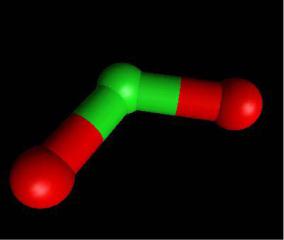
Оксиды хлора
ClO2
2KClO3 + 2H2C2O4 = 2ClO2 + 2CO2 + K2C2O4 + 2H2O |
(лаб.) |
|||||||||
2NaClO3 + SO2 + H2SO4 = 2NaHSO4 + ClO2 |
(пром.) |
|||||||||
2ClO |
+ H O = HClO |
2 |
+ HClO |
3 |
|
(2Cl4+ |
→ Cl3+ + Cl5+) |
|||
2 |
2 |
|
|
|
|
|
|
|
||
2ClO |
+ 2NaOH = NaClO |
2 |
+ NaClO |
3 |
(2Cl4+ |
→ Cl3+ |
+ Cl5+) |
|||
2 |
|
|
|
|
|
|
|
|
||
2ClO2 |
+ Na2O2 = 2NaClO2 |
+ O2 |
|
окислитель |
|
|||||
|
Парамагнитная молекула |
|
Единственный неспаренный электрон |
|
находится на разрыхляющей орбитали |
ClO2 |
нет димеризации |
vk.com/club152685050 | vk.com/id446425943
Оксиды хлора
Cl2O6 (ClO3)
ClO2 + O3 = ClO3 + O2
Димерен в жидкой фазе Очень сильный окислитель, но легко диспропорционирует
ClO3 + H2O = HClO3 + HClO4
Cl2O7
2HClO4 + P2O5 = Cl2O7 + 2HPO3 |
получение |
|
Cl2O7 + H2O = HClO4 |
ангидрид |
|
Очень взрывоопасен ! |
|
|
vk.com/club152685050 | vk.com/id446425943
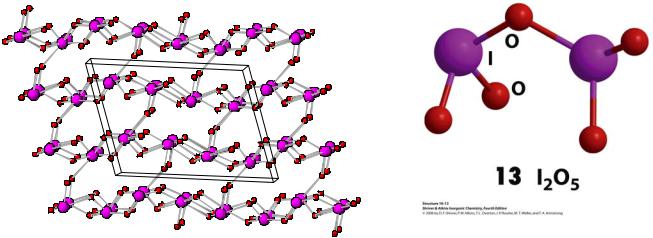
«Пентаоксид» йода
I2O5
2HIO3 I2O5 + H2O |
|
|
|
ангидрид |
||||
2I |
2 |
+ 5O |
2 |
= 2I O |
f |
H0 |
298 |
= -158.1 кДж/моль |
|
|
2 5 |
|
|
||||
Единственный термодинамически стабильный оксид галогена, но: реакция обратима, I2O5 разлагается при 350 0С
I2O5 + 5CO = I2 + CO2 |
окислитель |
||||||||||||||
3I2O5 + H2O = 2HI3O8 |
гигроскопичен |
||||||||||||||
HI3O8 + H2O = 3HIO3 |
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
