
Неметаллы лекция 4
.pdfvk.com/club152685050 | vk.com/id446425943
Red/Ox способность кислот и оснований
4.В с.о. +7 производные брома самые сильные окислители и при рН=0, и при рН=14
5HBrO4 + 2MnSO4 + 3H2O = 2HMnO4 + 5HBrO3 + 2H2SO4 H5IO6 + 2HCl = HIO3 + 3H2O + Cl2
HClO4 + HCl =
Причина: r(Br)>r(Cl) уменьшается экранирование для к.ч.=4, но для I к.ч.=6
5.В с.о. +5 окислительная способность меняется по ряду
Cl ≈ Br > I
2KBrO3 + I2 = 2KIO3 + Br2
2KClO3 + I2 = 2KIO3 + Cl2
vk.com/club152685050 | vk.com/id446425943
Соли кислородных кислот Cl, Br, I
1. Гипохлориты: |
|
|
|
|
2KOH + Cl |
2 |
= KClO + KCl + H O |
20оС |
|
|
|
2 |
|
|
CaO + Cl2 = CaoCl2 |
[Ca(OCl)2·CaCl2] |
20oC |
||
сильные окислители
4NaOH + 3NaOCl + 2Fe(OH)2 = 2Na2FeO4 + 3NaCl + 5H2O
2. Хлориты
Na2O2 + 2ClO2 = 2NaClO2 + O2
5NaClO2 + 2H2SO4 = 4ClO2 + 2Na2SO4 + 2H2O + NaCl
Структура Ca(ClO2)2
в кристаллическом состоянии

vk.com/club152685050 | vk.com/id446425943
Соли кислородных кислот Cl, Br, I
3. Хлораты, броматы, иодаты |
|
|
|
|||||
6KOH + 3Cl |
2 |
= KClO |
3 |
+ 5KCl + 3H O |
|
60оС |
|
|
|
|
|
2 |
|
|
|
||
6KOH + 3Br2 = KBrO3 + 5KBr + 3H2O |
|
|
|
|||||
2KClO3 |
+ I2 = 2KIO3 + Cl2 |
|
MnO , to |
|
||||
|
|
|
|
|
|
|
|
|
4KClO3 |
= KCl + 3KClO4 |
2KClO3 |
2 |
2KCl + 3O2 |
||||
|
||||||||
2Ca(IO3)2 = 2CaO + I2 + 5O2 |
(Br) |
|
|
|||||
4. Перхлораты, перброматы, периодаты
KBrO3 + F2 + 2KOH = KBrO4 + 2KF + H2O
KOH + H2O + KIO3 + KOCl = K2H3IO6 + KCl K2H3IO6 + HNO3 = KIO4 + KNO3 + 2H2O
KClO4 = KCl + 2O2 (плохо растворимая соль)
vk.com/club152685050 | vk.com/id446425943
Общие закономерности
1.Все элементы существуют в виде 2х-атомных молекул. Изменение т.пл. и т.кип. указывает на ван-дер-ваальсово взаимодействие между Х2
2.Проявляют свойства типичных неметаллов. Для F неизвестны положительные степени окисления
3.Галогены – окислители. Окислительная способность падает вниз по группе. F стабилизирует высшие с.о. почти всех элементов
4.Стабильность НХ падает вниз по группе. Для HF характерны наиболее прочные водородные связи.
5.Легко образуются МГС, строение которых описывается по методу Гиллеспи
6.Кислородные соединения характеры для Cl, Br, I. Максимальная с.о. равна +7. Окислительная способность Х+7 изменяется по ряду
Br>Cl>I.
7.Наиболее стабильны с.о. -1 и +5. Особенность хлора – образование диоксида ClO2
8.Сила кислородных кислот уменьшается вниз по группе
vk.com/club152685050 | vk.com/id446425943
Элементы 18 группы
He – гелий, Ne – неон, Ar – аргон, Kr – криптон, Xe – ксенон, Rn – радон
Благородные газы
vk.com/club152685050 | vk.com/id446425943
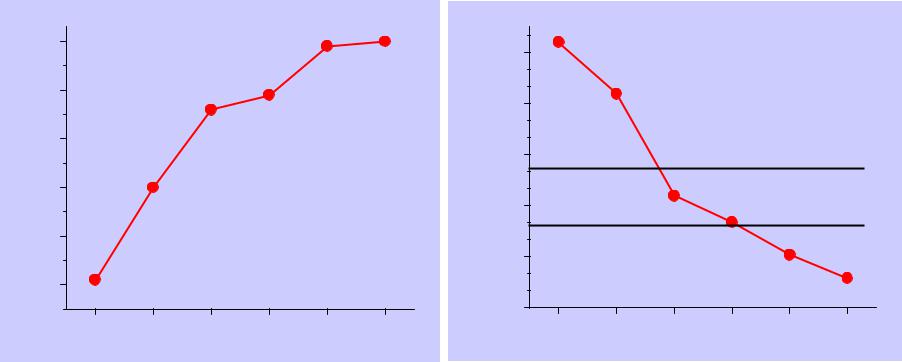
Свойства элементов
He |
Ne |
Ar |
Kr |
Xe |
Rn |
Ат. N |
2 |
10 |
18 |
36 |
54 |
86 |
|
Эл. |
1s2 |
2s22p6 |
3s23p6 |
3d104s24p6 |
4d105s25p6 |
4f145d106s26p6 |
|
конф. |
|
|
|
|
|
|
|
Радиус |
122 |
160 |
192 |
198 |
218 |
220 |
|
пм |
|
|
|
|
|
|
|
I1 |
(эВ) |
24.60 |
21.56 |
15.75 |
14.02 |
12.13 |
10.75 |
I2 |
(эВ) |
54.42 |
40.96 |
27.63 |
24.36 |
21.20 |
21.80 |
χAR |
5.50 |
4.84 |
3.20 |
2.94 |
2.40 |
2.06 |
|
С.О. |
0 |
0 |
0 |
0,(2) |
0,2,4,6,8 |
0,2,(4),(6) |
|
vk.com/club152685050 | vk.com/id446425943 |
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
Свойства элементов |
|
|
|
|
|||||
|
|
|
|
He |
|
Ne |
Ar |
|
Kr |
|
Xe |
|
|
Rn |
|
Ат. N |
|
2 |
10 |
18 |
|
36 |
|
54 |
|
|
86 |
|
|||
Эл. |
|
1s2 |
2s22p6 |
3s23p6 |
3d104s24p6 |
4d105s25p6 |
4f145d106s26p6 |
||||||||
конф2.2. |
R, Å |
|
|
|
|
198 24 |
|
|
|
|
|
|
|||
Радиус |
122 |
160 |
192 |
|
|
218 |
|
|
220 |
|
|||||
пм2.0 |
|
|
|
|
|
|
21 |
|
|
|
|
|
|
||
|
|
1.8 |
|
|
|
|
|
|
eV |
|
|
|
|
|
|
|
|
24.60 |
21.56 |
15.75 |
14.0218 |
|
12.13 |
|
10.75 F |
||||||
I1 (эВ) |
|
|
|||||||||||||
|
|
1.6 |
|
|
|
|
|
|
I(1), |
|
|
|
|
|
|
I |
|
54.42 |
40.96 |
27.63 |
24.36 |
|
21.20 |
|
21.80 |
|
|||||
2 |
(эВ) |
|
|
H |
|||||||||||
|
|
|
|
|
|
|
|
15 |
|
|
|
|
|
||
χAR1.4 |
|
5.50 |
4.84 |
3.20 |
2.94 |
|
2.40 |
|
|
2.06 |
|
||||
|
|
1.2 |
|
|
|
|
|
|
12 |
|
|
|
|
|
|
|
|
|
0 |
|
0 |
0 |
|
0,(2)9 |
|
0,2,4,6,8 |
0,2,(4),(6) |
||||
С.О. |
|
|
|
|
|||||||||||
|
|
|
He |
Ne |
Ar |
Kr |
Xe |
Rn |
He |
Ne |
Ar |
Kr |
Xe |
Rn |
|
vk.com/club152685050 | vk.com/id446425943 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
Свойства элементов |
|
|
|
|
|
|
|
|
|
|
|||||||||
|
He |
Ne |
|
Ar |
|
Kr |
|
|
Xe |
|
|
|
|
|
Rn |
|
|
|
|
||||
|
|
|
|
|
χAR |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5.5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ат. N |
2 |
|
10 |
|
18 |
|
36 |
|
|
54 |
|
|
|
|
|
86 |
|
|
|
|
|||
|
|
|
|
5.0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Эл. |
1s |
2 |
2s |
24.5 |
6 |
3s |
2 |
3p |
6 |
10 |
2 |
6 |
10 |
2 |
5p |
6 |
4f |
14 |
10 |
6s |
2 |
6p |
6 |
|
2p |
|
|
|
4d 4s |
|
4p |
4d 5s |
|
|
|
5d |
|
|
|||||||||
конф. |
|
|
|
4.0 |
|
|
|
|
|
|
|
|
F |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
||
Радиус |
122 |
|
3.5 |
|
192 |
|
198 |
|
|
|
|
|
|
|
220 |
|
|
|
|
||||
160 |
|
|
|
|
218 |
|
|
|
|
|
|
|
|
|
|||||||||
пм |
|
|
|
3.0 |
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
2.5 |
|
|
|
|
|
|
|
|
Cl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
I1 (эВ) |
24.60 |
|
2.0 |
|
15.75 |
|
14.02 |
|
12.13 |
|
|
10.75 |
|
|
|
||||||||
21.56 |
|
|
|
|
|
|
|
||||||||||||||||
I2 (эВ) |
54.42 |
40.96 |
He Ne Ar Kr Xe |
Rn |
|
|
|
|
21.80 |
|
|
|
|||||||||||
27.63 |
|
24.36 |
|
21.20 |
|
|
|
|
|
||||||||||||||
χAR |
5.50 |
4.84 |
|
3.20 |
|
2.94 |
|
|
2.40 |
|
|
2.06 |
|
|
|
|
|||||||
С.О. |
0 |
|
|
0 |
|
0 |
|
|
0,(2) |
|
0,2,4,6,8 |
|
0,2,(4),(6) |
|
|||||||||
vk.com/club152685050 | vk.com/id446425943
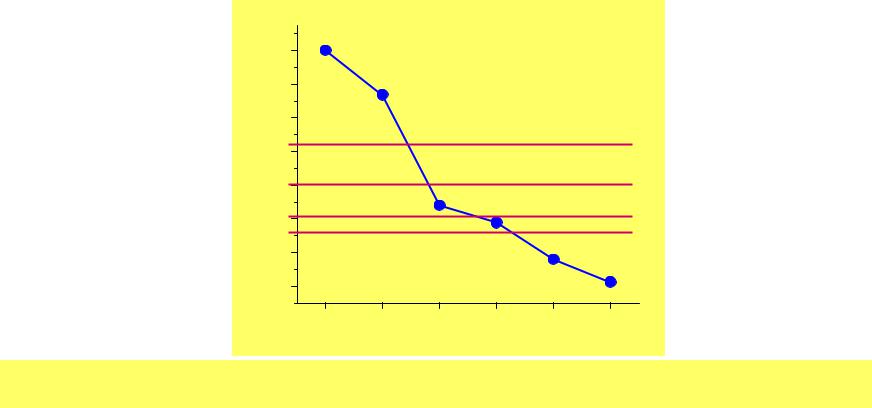
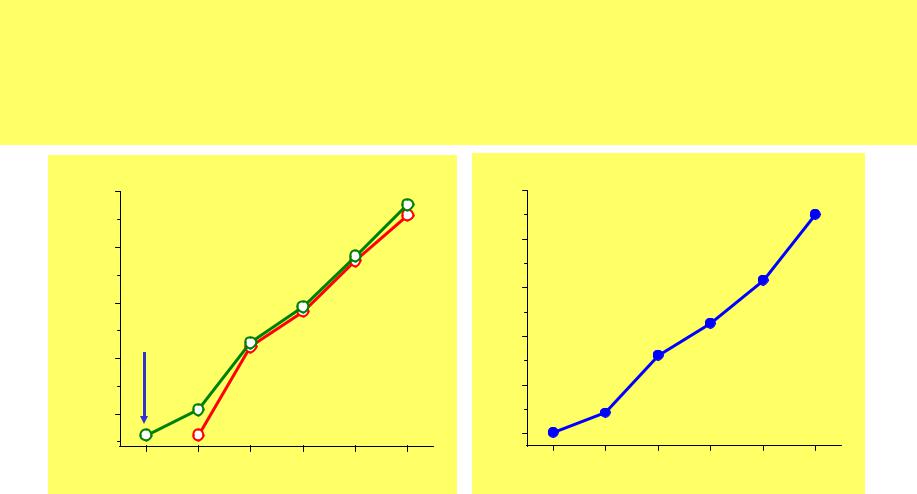
Физические свойства Ng
He |
Ne |
Ar |
Kr |
Xe |
Rn |
Т.пл. (оС) |
|
— |
-269 |
-189 |
-157 |
-112 |
-71 |
Т.кип. (оС) |
-268.94 |
-246 |
-185 |
-153 |
-108 |
-62 |
|
vH0bp |
|
0.08 |
1.71 |
6.43 |
9.08 |
12.62 |
18.0 |
кДж/моль |
|
|
|
|
|
|
|
d, г/л (н.у.) |
|
0.18 |
0.90 |
1.78 |
3.75 |
5.90 |
9.73 |
растворимость |
8.6 |
10.5 |
33.6 |
59.4 |
108.0 |
230 |
|
в воде при н.у. |
|
|
|
|
|
|
|
(мл/кгH2O) |
|
|
|
|
|
|
|
vk.com/club152685050 | vk.com/id446425943 |
|
|
|
|
|
|
|
|
||||
|
|
Физические свойства Ng |
|
|
|
|||||||
|
|
He |
|
Ne |
|
Ar |
|
Kr |
|
Xe |
|
Rn |
Т.пл. (оС) |
|
— |
|
-269 |
|
-189 |
|
-157 |
|
-112 |
-71 |
|
Т.кип. (оС) |
-268.94 |
|
-246 |
|
-185 |
|
-153 |
|
-108 |
-62 |
||
vH0bp |
|
0.08 |
|
1.71 |
|
6.43 |
|
9.08 |
|
12.62 |
18.0 |
|
кДж/моль |
|
|
|
|
|
|
|
|
|
|
|
|
-50 T, oC |
|
0.18 |
|
0.90 |
|
20 |
vH0bp, кДж/моль |
|
9.73 |
|||
d, г/л (н.у.) |
|
|
|
1.78 |
|
3.75 |
|
5.90 |
||||
-100 |
|
8.6т.кип. |
|
|
16 |
|
|
|
|
|
|
|
|
10.5 |
|
33.6 |
|
59.4 |
|
108.0 |
230 |
||||
растворимость |
|
|
|
|||||||||
-150 |
|
|
|
|
|
12 |
|
|
|
|
|
|
в воде при н.у. |
|
|
|
|
|
|
|
|
|
|
|
|
(мл/кгH2O)4.21 K |
|
т.пл. |
|
8 |
|
|
|
|
|
|
||
-200 |
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-250 |
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
He |
Ne Ar |
Kr |
Xe |
Rn |
|
He |
Ne |
Ar |
Kr |
Xe |
Rn |
|
