
Неметаллы лекция 4
.pdf
vk.com/club152685050 | vk.com/id446425943
Свойства галогенидов P(V)
PF5 |
|
PCl5 |
PBr5 |
|
PI5 |
|
|
Т.пл. -93.7оС |
|
Т.пл. 167оС |
Т.разл. 106оС |
? |
|
||
Т.кип. -84.6оС |
|
бесцветное |
желтое твердое |
? |
|
||
Бесцв. газ |
|
твердое в-во |
вещество |
? |
|
||
[PF ] |
|
[PCl |
+][PCl -] |
[PBr |
+]Br- |
? |
|
5 |
|
4 |
6 |
4 |
|
|
|
Галогенангидриды: PX5 + 4H2O = H3PO4 + 5HX |
|
|
|||||
|
|
|
|
|
|
|
|
KPF6 |
KHF2 |
P2O5 |
POCl3 |
|
|
||
|
|
|
|
|
|||
RCl |
ROH |
PCl5 |
AsF5 |
[PCl4+][AsF6-] |
|||
|
|
|
|
|
|
||
|
|
NH4Cl |
BCl3 |
|
|
||
(PNCl2)3 |
|
[PCl |
+][BCl |
-] |
|||
|
|
|
4 |
4 |
|||
|
|
|
|
|
|
||
vk.com/club152685050 | vk.com/id446425943
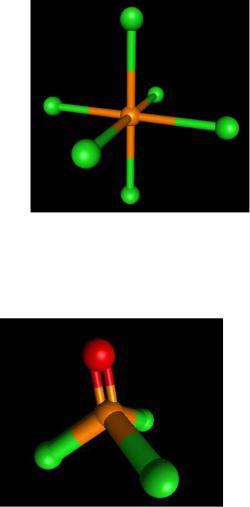
Кислота HPF6 и оксохлорид фосфора
1. |
Гексафторофосфорная кислота HPF6 |
PF6- |
||||||||||
|
существует только в растворе |
|
|
|||||||||
|
HPF |
6 |
H+ + PF - |
|
|
pKa ≈ -10 |
|
|||||
|
|
|
|
|
|
6 |
|
|
|
|
||
2. |
Получение |
|
|
|
|
|
|
|
|
|
||
|
H3PO4 + 6HF (конц) = HPF6 + 4H2O |
|
||||||||||
3. |
Не окислитель, не координирующий ион |
d(P–F) = 160 пм |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
4. |
Оксохорид фосфора POCl3 – бесцветная жидкость |
|||||||||||
|
т.пл. 2оС; т.кип. 105оС |
|
POCl3 |
|||||||||
5. |
Получение |
|
|
|
|
|
|
|
|
|||
|
2PCl |
3 |
|
+ O |
= 2POCl |
3 |
|
(to) |
|
|||
|
3PCl |
|
2 |
|
|
|
|
|
|
|||
|
3 |
|
+ P O |
5 |
= 5POCl |
3 |
(to) |
|
||||
6. |
Свойства |
|
|
2 |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
||
|
POCl3 |
+ 3H2O = H3PO4 + 3HCl |
гидролиз |
d(P–Cl) = 199 пм |
||||||||
|
POCl3 |
+ 3NaNO2 = 3NOCl + Na3PO4 |
||||||||||
|
d(P=O) = 145 пм |
|||||||||||
|
POCl3 + 4NH3 = PON + 3NH4Cl |
|
||||||||||
|
|
|
||||||||||
vk.com/club152685050 | vk.com/id446425943
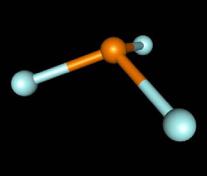
Свойства галогенидов P(III)
|
|
PF3 |
PCl3 |
PBr3 |
PI3 |
Т.пл., оС |
-152 |
-74 |
-40.5 |
61 (разл) |
|
Т.кип., оС |
-102 |
76 |
-173.5 |
─ |
|
Цвет |
бесцв. |
бесцв. |
бесцв. |
желто-красн. |
|
Е(Р-Х), |
490 |
360 |
264 |
184 |
|
кДж/моль |
|
|
|
|
|
d(P-X), пм |
156 |
204 |
222 |
243 |
|
(Х-Р-Х), О |
96.5 |
100 |
101 |
102 |
|
Go |
, |
-936 |
-261 |
-156 |
-45 |
f |
298 |
|
|
|
|
кДж/моль
PF3 – очень сильный яд PCl3, PBr3, PI3 гигроскопичны
PX3 + 3H2O = H3PO3 + 3HX
Проявляют донорные свойства: PCl3 + BF3 = PCl3·BF3
vk.com/club152685050 | vk.com/id446425943 |
|
|
|
|
|
|
||||
|
|
|
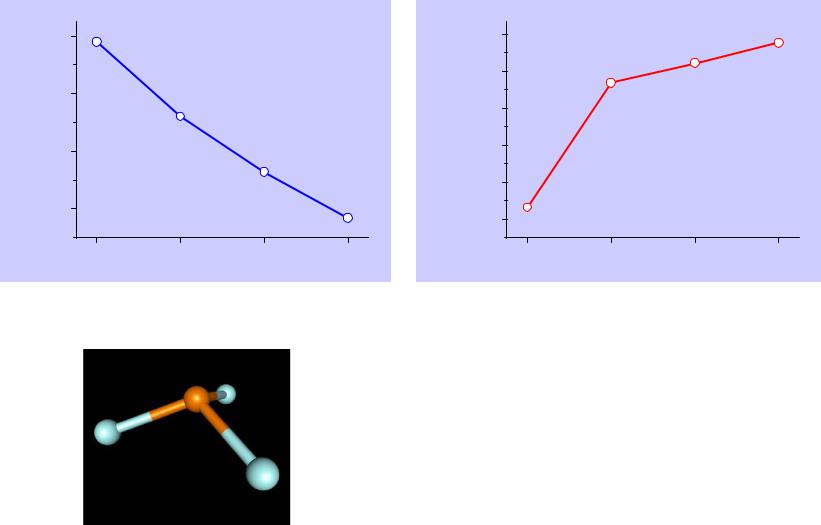
Свойства галогенидов P(III) |
|
|
|||||
|
|
|
PF3 |
|
PCl3 |
|
PBr3 |
|
PI3 |
|
Т.пл., оС |
|
-152 |
|
-74 |
|
-40.5 |
61 (разл) |
|||
Т.кип., оС |
|
-102 |
|
76 |
|
-173.5 |
|
─ |
||
|
500 |
|
E(P-X), кДж/моль |
|
0 |
fG0298, кДж/моль |
|
|||
Цвет |
|
бесцв. |
|
бесцв. |
-200 |
бесцв. |
желто-красн. |
|||
|
400 |
|
490 |
|
360 |
-400 |
264 |
|
|
184 |
Е(Р-Х), |
|
|
|
|
||||||
кДж/моль |
|
|
|
|
-600 |
|
|
|
|
|
|
300 |
|
|
|
|
|
|
|
|
|
d(P-X), пм |
156 |
|
204 |
-800 |
222 |
|
|
243 |
||
|
200 |
|
96.5 |
|
100 |
-1000 |
101 |
|
|
102 |
(Х-Р-Х), О |
|
|
|
|||||||
|
|
|
|
|||||||
o |
298, |
PF3 |
PCl |
PBr3 |
PI3 |
|
PF3 |
PCl3 |
PBr3 |
PI3 |
fG |
|
-936 |
|
-261 |
|
-156 |
|
-45 |
||
кДж/моль |
|
|
|
PF3 – очень сильный яд |
|
|
||||
|
|
|
|
|
|
|
||||
|
|
|
|
|
PCl3, PBr3, PI3 гигроскопичны |
|
||||
|
|
|
|
|
|
PX3 + 3H2O = H3PO3 + 3HX |
||||
|
|
|
|
|
Проявляют донорные свойства: |
|||||
|
|
|
|
|
|
PCl3 + BF3 = PCl3·BF3 |
|
|||
vk.com/club152685050 | vk.com/id446425943
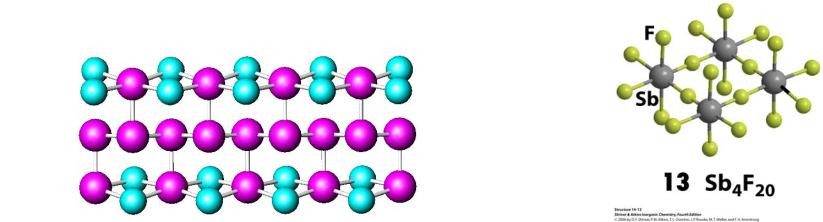
Свойства галогенидов As, Sb, Bi
1. Все галогениды, кроме AsF3, SbF3, SbCl3, Bi4Br4, получают прямым синтезом
As2O3 + 3H2SO4 + 3CaF2 = 3AsF3 + 3CaSO4 + 3H2O 4BiBr3 + 8Bi = 3Bi4Br4 в инертной атмосфере
2.Все галогениды, кроме Bi4Br4, Bi4I4, BiI3, гигроскопичны
SbCl5 + 4H2O = H3SbO4 + 5HCl AsCl3 + 3H2O = H3AsO3 + 3HCl BiCl3 + H2O = BiOCl + 2HCl
3.Все пентагалогениды – сильные кислоты Льюиса
SbCl5 + AlCl3 = [AlCl2+][SbCl6-]
Bi4I4
vk.com/club152685050 | vk.com/id446425943
Оксиды азота
|
N2O |
NO |
N2O3 |
NO2 |
N2O4 |
N2O5 |
с.о. |
+1 |
+2 |
+3 |
+4 |
+4 |
+5 |
Т.пл., оС |
-90.7 |
-163.7 |
-101 |
─ |
-11 |
32.4 |
|
|
|
|
|
|
(субл) |
Т.кип.,оС |
-88.7 |
-151.8 |
3.5 |
─ |
21.2 |
─ |
|
|
|
(разл) |
|
|
|
Цвет |
бесцв |
бесцв |
синий |
бурый |
бесцв |
бесцв |
fH0298, |
82.0 |
90.2 |
50.3 |
33.2 |
-19.5 |
-41.3 |
кДж/моль |
|
|
(жидк) |
|
(жидк) |
(тв) |
μ, D (газ) |
0.16 |
0.16 |
─ |
0.315 |
─ |
─ |
Магнитные |
диа- |
пара- |
диа- |
пара- |
диа- |
диа- |
свойства |
|
|
|
|
|
|
vk.com/club152685050 | vk.com/id446425943
Оксиды азота
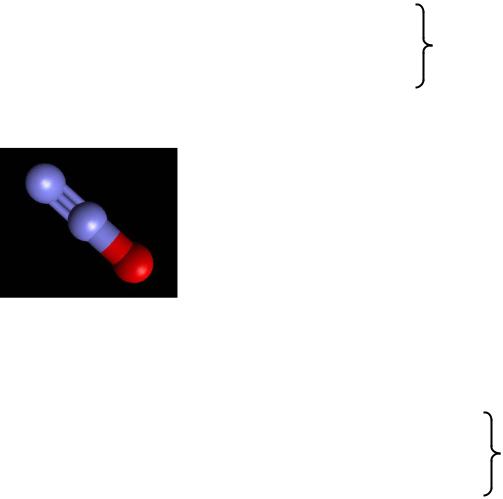
1. Закись азота, оксид азота (I) N2O |
«веселящий газ» |
||||||
NH |
NO |
3 |
= N O + 2H |
2 |
O |
250oC |
|
4 |
|
2 |
|
|
получение |
||
NH2OH + HNO2 = N2O + 2H2O |
|
||||||
|
|
||||||
C + 2N2O = CO2 + 2N2 |
поддерживает горение |
||||||
|
Линейная молекула |
|
d(N-N) = 113 пм |
N2O |
d(N-O) = 119 пм |
|
2. Получение моноксида азота, оксида азота (II) NO
4NH |
3 |
+ 5O |
2 |
= 4NO + 6H O |
1000oC, кат. (пром. получение) |
|
|
|
2 |
|
|
||
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O |
в лаборатории |
|||||
2KNO2 + 2KI + 2H2SO4 = 2K2SO4 + I2 +2NO |
|
|||||
vk.com/club152685050 | vk.com/id446425943
Оксиды азота
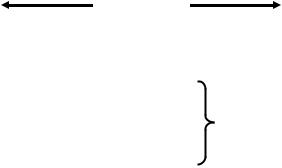
3. NO – молекула-радикал d(N-O) = 115 пм
строение: 1σ2 2σ2 1π4 3σ2 2π1 4σ0 один неспаренный электрон на разрыхляющей орбитали –
|
|
нет димеризации ! |
NO- |
+ e- |
- e- |
NO |
NO+ |
4. NO не растворяется в воде, не реагирует с кислотами и щелочами
2NO + O2 |
= 2NO2 |
при н.у. |
|
|
2NO + Cl2 = 2NOCl
5. NO – слабый окислитель, слабый восстановитель
2NO + 3Sn + 8HCl = 3SnCl2 + 2[NH3OH]Cl
2NO + K2Cr2O7 + 4H2SO4 = 2HNO3 + Cr2(SO4)3 + K2SO4 + 3H2O
vk.com/club152685050 | vk.com/id446425943
Оксиды азота
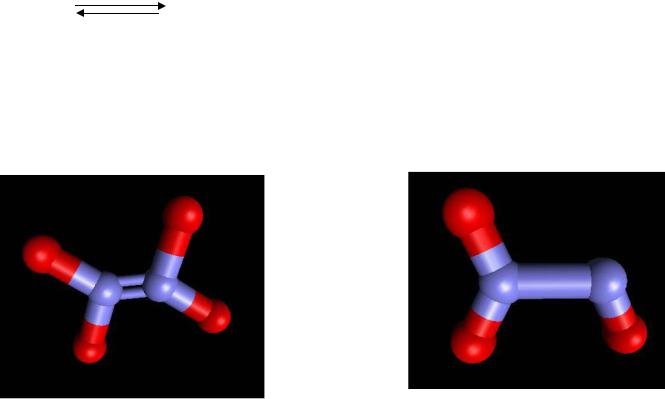
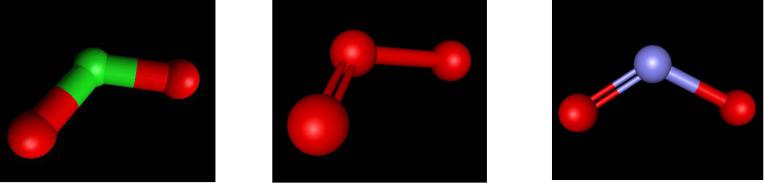
6. Азотистый ангидрид, оксид азота (III) N2O3
NO + NO2 N2O3
N2O3 + H2O 2HNO2 ангидрид
7. Оксиды азота (IV) NO2 и N2O4
2NO |
2 |
-11oC |
N O |
4 |
r |
H0 |
298 |
= -55 кДж/моль |
|
140oC |
2 |
|
|
||||
|
|
|
|
|
|
|
|
|
2NO2 |
+ H2O = HNO2 + HNO3 |
|
|
|
|
|||
2С + 2NO2 = 2CO2 + N2 |
поддерживает горение |
|||||||
164 пм |
186 пм |
|
N2O4 |
N2O3 |
vk.com/club152685050 | vk.com/id446425943
Оксиды азота
8. Димеризация NO2
ClO2 |
O3 |
NO2 |
19 e- |
18 e- |
17 e- |
1 неспаренный е- |
нет неспаренных е- |
1 неспаренный е- |
на разрыхляющей |
|
на связывающей |
орбитали |
|
орбитали |
9. Азотный ангидрид, оксид азота (V) N2O5 |
|
|
2HNO3 + P2O5 = N2O5 + 2HPO3 |
получение |
|
N2O5 + I2 = I2O5 + N2 |
окислитель |
|
|
взрывоопасен ! |
|
