
- •5) Стехиометрия химических реакций
- •6) Технологические критерии эффективности химико-технологического процесса.
- •7) Степень превращения (конверсия) реагента:
- •8) Выход продукта:
- •14) Дифференциальные и интегральные уравнения законов скоростей химических реакций
- •17) Влияние концентрации реагентов и температуры на скорость химических реакций
- •18) Влияние температуры на селективность химической реакции
Химические технологии - наука о наиболее экономичных и экологически целесообразных методах и средствах переработки сырых природных материалов в продукты потребления и промежуточные продукты.
Неорганическая химическая технология включает переработку минерального сырья (кроме металлических руд), получение кислот, щелочей, минеральных удобрений. Органическая химическая технология – переработку нефти, угля, природного газа и других горючих ископаемых, получение синтетических полимеров, красителей, лекарственных средств и других веществ.
Все процессы химической технологии разделяют в зависимости от общих кинетических закономерностей протекания процесса на пять основных групп:
гидромеханические;
тепловые;
массобменные (или диффузионные) процессы;
химические процессы;
механические процессы.
По организационно-технической структуре процессы делятся на периодические и непрерывные.
Химические процессы подразделяется на технологию неорганических веществ (производство кислот, щелочей, соды, силикатных материалов, минеральных удобрений, солей и т. д.) итехнологию органических веществ (синтетический каучук, пластмассы, красители, спирты, органические кислоты и др.)
Химико-технологический процесс и его содержание.
Химическая промышленность дает народному хозяйству огромное количество продуктов, без которых невозможна жизнь современного общества. Сюда входят моторные топлива, масла, горючие газы, кислоты, смолы, волокна, лаки, краски и т.д.
Важнейшая задача химической технологии - отыскание оптимальных условий для экономически целесообразного осуществления химической реакции в виде технологического процесса.
Химико-технологический процесс - это процесс получения целевого продукта начиная с этапа подготовки сырья и заканчивая выделением этого целевого продукта.
Химико-технологический процесс складывается из трех стадий:
1) подвод реагентов в зону реакции при помощи абсорбции, адсорбции, конденсации паров, плавлением, растворением и др. (осуществляется, как правило, с использованием физических процессов (механических, гидромеханических, тепловых, массообменных));
2) химические реакции - основа процесса (в ходе этого происходит глубокое изменение структуры, состава и свойств веществ, участвующих в нем);
3) отвод продуктов из зоны реакции за счет диффузии или перевода вещества из одной фазы в другую. Стадия выделения целевого продукта для большинства химических производств является необходимой. Технологический процесс, в котором достигается абсолютная селективность и 100% -ный выход целевого продукта, просто экономически невыгоден. Возрастают расходные коэффициенты, энергетические затраты, вследствие чего стоимость продукта резко возрастает, и тогда товар теряет своего потребителя.
3. Химическая реакция и химический реактор.
Хими́ческая реа́кция — превращение одного или нескольких исходных веществ (реагентов) в отличающиеся от них по химическому составу или строению вещества (продукты реакции). В отличие от ядерных реакций, при химических реакциях ядра атомов не меняются, в частности не изменяется их общее число, изотопный состав химических элементов, при этом происходит перераспределение электронов и ядер и образуются новые химические вещества
Химический реактор — агрегат для проведения химических реакций объёмом от нескольких миллилитров до десятков кубометров.
Цель работы реактора – выработка конечного продукта из исходных компонентов при соблюдении требований максимальной эффективности процесса:
Создание устойчивого и стабильного режима проведения реакции;
высокие энергетические показатели;
минимальная стоимость реактора;
простота работы и ремонта.
Существует две основные модели протекания реакций в реакторах: - Реактор идеального смешения - Реактор идеального вытеснения
4. Классификация химических реакций:
А) по фазовому составу:
Гомогенные гомофазные реакции. В реакциях такого типа реакционная смесь является гомогенной, а реагенты и продукты принадлежат одной и той же фазе. Примером таких реакций могут служить реакции ионного обмена, например, нейтрализация кислоты и щелочи в растворе:
NaOH(раств.) + HCl(раств.) → NaCl(раств.) + H2O(жидкость)
Гетерогенные гетерофазные реакции. В этом случае реагенты находятся в разном фазовом состоянии, продукты реакции также могут находиться в любом фазовом состоянии. Реакционный процесс протекает на границе раздела фаз. Примером может служить реакция солей угольной кислоты (карбонатов) с кислотами Бренстеда:
CO3(твердое) + 2HCl(раств.) → Cl2(раств.) + CO2(газ) + H2O(жидкость)
Гетерогенные гомофазные реакции. Такие реакции протекают в пределах одной фазы, однако реакционная смесь является гетерогенной. Например, реакция образования хлорида аммония из газообразных хлороводорода и аммиака:
NH3(газ) + HCl(газ) → NH4Cl(твердое)
Гомогенные гетерофазные реакции. Реагенты и продукты в такой реакции существуют в пределах одной фазы, однако реакция протекает на поверхности раздела фаз. Примером таких реакций являются некоторые гетерогенно-каталитические реакции, например, реакция синтеза аммиака из водорода и азота:
N2(газ) + 3H2(газ) → 2 NH3(газ) (катализатор Pt)
Б) по механизму:
По механизму химические реакции делят на простые и сложные. К простым относятся реакции, которые протекают только в одну стадию
Сложные
реакции в свою очередь делят на
последовательные, параллельные и
сопряженные. Последовательные - реакции
с промежуточными стадиями типа А → В →
С. Параллельные - исходные вещества
реагируют сразу в нескольких направлениях: ![]()
Например, 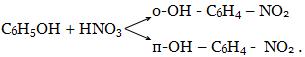
Сопряженные - реакции, из которых одна протекает лишь совместно с другой. Например, Н2О2 легко окисляет соединения железа, но практически не окисляет бензол. Однако если провести эти реакции в общей смеси, то Н2О2 в этом случае окисляет и бензол:
Fe2+ + H2O2 = Fe3+ + OH- OH- + OH- + C6H6 = C6H5OH + H2O.
В) по молекулярности:
Молекулярность реакции – это минимальное число молекул, участвующих в элементарном химическом процессе. По молекулярности элементарные химические реакции делятся на молекулярные (А →) и бимолекулярные (А + В →); тримолекулярные реакции встречаются чрезвычайно редко.
Г) по порядку реакции:
Порядок реакции по данному веществу — показатель степени при концентрации этого вещества в кинетическом уравнении реакции
Реакция
нулевого порядка
![]() Кинетическое
уравнение имеет следующий вид:
Кинетическое
уравнение имеет следующий вид:
V0 = k0
Скорость реакции нулевого порядка постоянна во времени и не зависит от концентраций реагирующих веществ. Нулевой порядок характерен, например, для гетерогенных реакций в том случае, если скорость диффузии реагентов к поверхности раздела фаз меньше скорости их химического превращения.
Реакция первого порядка
Кинетическое уравнение реакции первого порядка:
![]()
Приведение уравнения к линейному виду даёт уравнение:
![]()
Константа скорости реакции вычисляется как тангенс угла наклона прямой к оси времени:
k1 = − tgα
Период полупревращения:
![]()
Реакция второго порядка
Для реакций второго порядка кинетическое уравнение имеет следующий вид:
![]()
или
![]()
В первом случае скорость реакции определяется уравнением
![]()
Линейная форма уравнения:
![]()
Константа скорости реакции равна тангенсу угла наклона прямой к оси времени:
k2 = − tgα
![]()
Во втором случае выражение для константы скорости реакции будет выглядеть так:
![]()
Период полупревращения (для случая равных начальных концентраций!):
![]()
5) Стехиометрия химических реакций
Стехиометрия — раздел химии о соотношениях реагентов в химических реакциях.
Позволяет теоретически вычислять необходимые массы и объёмы реагентов.
6) Технологические критерии эффективности химико-технологического процесса.
Совершенствование химических производств.
Успехи химической промышленности, перспективы развития, ее роль в народном хозяйстве и обеспечении качества жизни населения зависят от уровня научных и технологических исследований.
Основные направления развития химической промышленности состоят:
в поиске новых соединений и материалов,
в повышении эффективности производства химической продукции.
Эффективность по существу определяется экономикой, и ее повышение обеспечивается:
А) снижением затрат:
на сырьё и материалы
на энергию,
на капитальные вложения
Б) повышением производительности труда.
В) разработкой вопросов охраны труда и окружающей среды
Для повышения эффективности ХТП:
А) инженерные приемы:
рекуперация энергии
использование тепла с помощью котлов-утилизаторов
оптимизация технологических схем разделения и выделения продуктов по минимуму затрат
улавливание и рекуперация отходов и др.
Б) открытие новых реакций и каталитических систем (наиболее кардинальная мера)
В) выяснение детального механизма протекающих реакций, позволяющее найти пути осуществления процесса с максимальной эффективностью.
7) Степень превращения (конверсия) реагента:
Степень
превращения
– количество прореагировавшего реагента,
отнесенное к его исходному количеству.
Для
простейшей реакции ![]()
![]() ,[1]
где
,[1]
где ![]() -
концентрация на входе в реактор или в
начале периодического процесса,
-
концентрация на входе в реактор или в
начале периодического процесса,
![]() -
концентрация на выходе из реактора или
текущий момент периодического процесса.
-
концентрация на выходе из реактора или
текущий момент периодического процесса.
8) Выход продукта:
ВЫХОД ПРОДУКТА — количество продукта (концентрата или металла), получаемое из единицы веса или объема полезного ископаемого; определяется отношением веса полученного продукта (концентрата, металла) к весу исходной руды в процентах.
Выход продукта - это отношение массы (объема), практически полученного продукта к массе (объему) вещества, рассчитанного теоретически, т. е. по уравнению реакции (mтеор)
9) Селективность – количество реально полученного целевого продукта, отнесенное к количеству этого продукта, которое получилось бы, если бы весь прореагировавший реагент перешел в этот продукта.
10) Производительность - объём продукции (работы), производимой в единицу времени данным оборудованием в соответствии с его конструктивными особенностями, технической характеристикой и производственной квалификацией рабочих
11) Интенсивность - напряженность процесса, характеризуемая мерой отдачи каждого из используемых факторов, ресурсов.
12) Технико-экономические показатели - система измерителей, характеризующая материально-производственную базу предприятий (производственных объединений) и комплексное использование ресурсов.
Расходный коэффициент- показатель использования сырья и материалов, обратный коэффициент использования материалов
Фабрично-заводская себестоимость - денежные (ресурсные) издержки социалистических предприятий на производство и реализацию продукции, выражающие часть её стоимости (стоимость потребленных средств производства и стоимость необходимого продукта)
Качество продукции - Это оценка потребителем степени соответствия её свойств индивидуальным и общественным ожиданиям, обязательным нормам в соответствии с ее назначением.
13) Скорость гомогенной химической реакции - в целом определяется как скорость изменения глубины протекания реакции в единицу времени в единице объема.
