
№1. химическая технология
Химическая технология. В ее основе хим-е реакции. Хим. Тех- наука о наиболее эконом-х, обоснованных методом сырья продукт. Основная задача химической технологии — сочетание в единой технологической системе разнообразных химически превращений с физико-химическими и механическими процессами: измельчением и сортировкой твёрдых материалов, образованием и разделением гетерогенных систем, массообменном и теплообменом, фазовыми превращениями, сжатием газов, созданием высоких и низких температур, электрических, магнитных, ультразвуковых полей и т.д. К химической технологии относятся также транспортировка, складирование и хранение сырья, полуфабрикатов и готовых продуктов, контроль и автоматизация производственных процессов, выбор конструкционных материалов для промышленной аппаратуры, а также типов и единичных мощностей аппаратов.
№2.химико-технологический процесс и его содержание
Химико-технологический процесс - это процесс получения целевого продукта начиная с этапа подготовки сырья и заканчивая выделением этого целевого продукта.
Химико-технологический процесс складывается из трех стадий:
1) подвод реагентов в зону реакции при помощи абсорбции, адсорбции, конденсации паров, плавлением, растворением и др. (осуществляется, как правило, с использованием физических процессов (механических, гидромеханических, тепловых, массообменных));
2) химические реакции - основа процесса (в ходе этого происходит глубокое изменение структуры, состава и свойств веществ, участвующих в нем);
3) отвод продуктов из зоны реакции за счет диффузии или перевода вещества из одной фазы в другую. Стадия выделения целевого продукта для большинства химических производств является необходимой. Технологический процесс, в котором достигается абсолютная селективность и 100% -ный выход целевого продукта, просто экономически невыгоден. Возрастают расходные коэффициенты, энергетические затраты, вследствие чего стоимость продукта резко возрастает, и тогда товар теряет своего потребителя.
№3.химическая реакция и химический реактор.
Химический реактор — агрегат для проведения химических реакций объёмом от нескольких миллилитров до десятков кубометров. В зависимости от условий протекания реакций и технологических требований реакторы делятся: реакторы для реакций в гомогенных системах и в гетерогенных системах; реакторы низкого, среднего и высокого давления; реакторы низкотемпературные и высокотемпературные; реакторы периодического, полунепрерывного и непрерывного действия.Цель работы реактора – выработка конечного продукта из исходных компонентов при соблюдении требований максимальной эффективности процесса:
-Создание устойчивого и стабильного режима проведения реакции;
-высокие энергетические показатели;
-минимальная стоимость реактора;
-простота работы и ремонта.
Существует две основные модели протекания реакций в реакторах: - Реактор идеального смешения - Реактор идеального вытеснения.
Химическими реакциями называются явления, при которых одни вещества, обладающие определенным составом и свойствами, превращаются в другие вещества - с другим составом и другими свойствами. При этом в составе атомных ядер изменений не происходит.Существует большое количество признаков, по которым можно классифицировать химические реакции:
По фазовому составу реагирующей системы:-Гомогенные гомофазные реакции. В реакциях такого типа реакционная смесь является гомогенной, а реагенты и продукты принадлежат одной и той же фазе.-Гетерогенные гетерофазные реакции. В этом случае реагенты находятся в разном фазовом состоянии, продукты реакции также могут находиться в любом фазовом состоянии. Реакционный процесс протекает на границе раздела фаз.-Гетерогенные гомофазные реакции. Такие реакции протекают в пределах одной фазы, однако реакционная смесь является гетерогенной. -Гомогенные гетерофазные реакции. Реагенты и продукты в такой реакции существуют в пределах одной фазы, однако реакция протекает на поверхности раздела фаз.
По изменению степеней окисления реагентов:
-Окислительно-восстановительные реакции, в которых атомы одного элемента (окислителя) восстанавливаются, то есть понижают свою степень окисления, а атомы другого элемента (восстановителя) окисляются, то есть повышают свою степень окисления.- Не окислительно-восстановительные реакции — соответственно, реакции, в которых не происходит изменения степеней окисления атомов, например, указанная выше реакция нейтрализации.
По тепловому эффекту реакции: Все реакции сопровождаются тепловыми эффектами. При разрыве химических связей в реагентах выделяется энергия, которая, в основном, идет на образование новых химических связей. В некоторых реакциях энергии этих процессов близки, и в таком случае общий тепловой эффект реакции приближается к нулю. В остальных случаях можно выделить:
экзотермические реакции, которые идут с выделением тепла, (положительный тепловой эффект) например, указанное выше горение водорода
эндотермические реакции в ходе которых тепло поглощается (отрицательный тепловой эффект) из окружающей среды.
По типу превращений реагирующих частиц:
соединения:
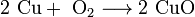
разложения:
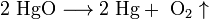
замещения:
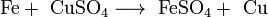
обмена (тип реакции-нейтрализация):
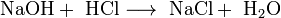
обмена (тип реакции-обмена):
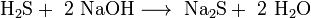
№4. классификация химических реакций по фазовому составу, по механизму, по молекулярности, по порядку реакций.
По фазовому составу реагирующей системы:
-Гомогенные гомофазные реакции. В реакциях такого типа реакционная смесь является гомогенной, а реагенты и продукты принадлежат одной и той же фазе. Примером таких реакций могут служить реакцииионного обмена, например, нейтрализация кислоты и щелочи в растворе:
NaOH(раств.) + HCl(раств.) → NaCl(раств.) + H2O(жидкость)
-Гетерогенные гетерофазные реакции. В этом случае реагенты находятся в разном фазовом состоянии, продукты реакции также могут находиться в любом фазовом состоянии. Реакционный процесс протекает на границе раздела фаз. Примером может служить реакция солей угольной кислоты (карбонатов) с кислотами Бренстеда:
CO3(твердое) + 2HCl(раств.) → Cl2(раств.) + CO2(газ) + H2O(жидкость)
-Гетерогенные гомофазные реакции. Такие реакции протекают в пределах одной фазы, однако реакционная смесь является гетерогенной. Например, реакция образования хлорида аммония из газообразных хлороводорода и аммиака:
NH3(газ) + HCl(газ) → NH4Cl(твердое)
-Гомогенные гетерофазные реакции. Реагенты и продукты в такой реакции существуют в пределах одной фазы, однако реакция протекает на поверхности раздела фаз. Примером таких реакций являются некоторые гетерогенно-каталитические реакции, например, реакция синтеза аммиака из водорода и азота:
N2(газ) + 3H2(газ) → 2 NH3(газ) (катализатор Pt)
По механизму:
Механизм реакций - совокупность элементарных стадий слагающих процесс.
-Простой процесс - протекает в одну стадию (реагент - продукт)
-Сложный процесс – многостадийный (реагент -промежуточные продукты - конечный продукт).
По молекулярности:
По числу молекул одновременно участвующих в хим. превращении простые реакции делятся на:
-Мономолекулярные
N2O4= 2NO2
-Бимолекулярные
NO + H2O= NO2 + H2
- Тримолекулярные
2NO + Cl2= 2NOCl.
по порядку реакций:
Порядком реакции называется сумма показателей степеней у концентраций реагентов в кинетическом уравнении. Существуют реакции первого, второго, третьего, дробного порядков.
№5 стехиометрия химических реакций
СТЕХИОМЕТРИЯ - учение о соотношениях-массовых или объемных реагирующих веществ. В основе стехиометрия лежат законы сохранения массы. эквивалентов (см. Эквивалент химический), Авогадро, Гей-Люссака, постоянства состава, кратных отношений. Все законы стехиометрия обусловлены атомно-мол. строением вещества. Соотношения, в которых, согласно законам стехиометрия, вступают в реакцию вещества, наз. стехиометрическими, также наз. соответствующие этим законам соединения. В-ва, для которых наблюдаются отклонения от законов стехиометрия, наз. нестехио-метрическими (см. Нестехиометрия). Отклонения от законов стехиометрия наблюдаются для конденсир. фаз и связаны с образованием твердых растворов (для кристаллич. веществ), с растворением в жидкости избытка компонента реакции или термич. диссоциацией образующегося соединения (в жидкой фазе, в расплаве). Законы стехиометрия используют в расчетах, связанных с ф-лами веществ и нахождением теоретически возможного выхода продуктов реакции.
Закон сохранения массы веществ: Масса реагирующих веществ равна массе продуктов реакции.
Закон постоянства состава (Ж. Пруст):Химическое соединение, имеющее молекулярное строение, независимо от метода получения характеризуется постоянным составом
Закон кратных отношений (Д. Дальтон):Если два элемента образуют между собой несколько молекулярных соединений, то масса одного элемента, приходящаяся на одну и ту же массу другого, относятся между собой как небольшие целые числа.
Закон эквивалентов (И. Рихтер):В молекулярных соединениях массы составляющих их элементов относятся между собой как их эквиваленты. Химический эквивалент – реальная или условная частица вещества, способная соединиться и заместить 1 моль атомов водорода в реакциях присоединения и замещения или принять (отдать) 1 моль электронов в окислительно-восстановительных реакциях.
Закон простых объемных отношений (Ж. Гей-Люссак): При равных условиях объемы вступающих в реакцию газов относятся друг к другу и к объемам образующихся газообразных продуктов, как небольшие целые числа.
Закон Авогадро: В равных объемах любых газов, взятых при одинаковых условиях, содержится одинаковое число молекул.
Из закона Авогадро вытекают два следствия:
-Одинаковое количество молекул любых газов при одинаковых условиях занимают одинаковый объем; -Относительная плотность одного газа по другому равна отношению их молярных масс.
Число Авогадро – число частиц в моле любого вещества; NA = 6,02∙1023 моль–1.
№6.технологические критерии эффективности химико-технологического процесса


№7.степень превращения (конверсия) реагента
Степень
превращения - отношение
количества исходного сырья, вступившего
в реакцию, к его начальному количеству
(концентрации), например, для простой
необратимой реакции A
→ R
степень превращения (ХA)
По этим соотношениям обычно вычисляют

№8.выход продукта
Выходом продукта называют отношение реально полученного количества продукта (Gф) к максимально возможному его количеству(GT):
 (%
или доли единицы)
(%
или доли единицы)
№9.селективность
Селективность (избирательность) - отношение количества образовавшегося целевого продукта (R) к общему количеству всех полученных продуктов (R+S).
Знание этих и других технологических понятий и определений необходимо для оценки эффективности функционирования действующих, а также при анализах и расчетах, предшествующих и сопутствующих созданию новых химических производств
№10. Производительность
Производительность. Важным критерием эффек¬тивности работы отдельных аппаратов, цехов или заводов в целом является производительность.Производительность – это кол-во продукта, полученное в единицу времени.П=ПR/t, где П — производительность; nR — количество продукта; т — время.Производительность измеряется в кг'ч, т/сут, т'год и т. д.Максимально возможная для данного агрегата, машины произво¬дительность (проектная) называется мощностью. Одним из ос¬новных направлений развития химической промышленности является увеличение единичной мощности агрегатов, так как оно ведет к сниже¬нию удельных капитальных затрат, повышению производительности труда.
№11. Интенсивность. Интенсивность. Интенсивность – это производительность, отнесенная к какой-либо величине, характеризующей размеры аппарата, - его объему, площади поперечного сечения и т.д.I= П/V=ПR/Vt, где V — объем аппарата. Интенсивность измеряется в кг/(ч-м3), т (сут- мг) и т. д.При разработке новых процессов или усовершенствовании существующих стремятся к созданию высокоинтенсивных аппаратов. Увеличение интенсивности аппарата часто возможно за счет создания таких условий проведения процесса, которые обеспечивают его протекание с высокой скоростью. При анализе работы каталитических реакторов принято относить производительность аппарата в целом к единице объема или массы катализатора, загруженного в реактор. Такую величину, численно равную количеству продукта, полученного с единицы объема или массы катализатора, называют производительностью катализатора или его напряженностью.
№12.технико-экономические показатели: расходный коэффициент по сырью и энергии, фабрично-заводская себестоимость, качество продукции.
Технико-экономический уровень химического производства определяется совокупностью технико-экономических показателей. Технико-экономические показатели отражают возможности предприятия выпускать продукцию заданной номенклатуры и качества, удовлетворяющей требованиям заказчика (ГОСТ, ОСТ, ТУ), и в заданном количестве. Они являются критериями, позволяющими установить экономическую целесообразность организации данного производства и его рентабельность, а также сравнивать по эффективности различные производства одного профиля.
-Расходным коэффициентом называется количество сырья или энергии каждого вида, затрачиваемое на производство единицы массы или объема готовой продукции
-Фабрично-заводская себестоимость – это сумма производственных затрат цеха и общезаводских расходов, которые включают расходы по управлению предприятием (заработная плата персонала заводоуправления, амортизация и текущий ремонт зданий общезаводского назначения и т. д.)
-Качество продукции- совокупность свойств продукции, обусловливающих ее способность удовлетворять определенные потребности в соответствии с ее назначением. Свойства, составляющие К. п., характеризуются с помощью непрерывных или дискретных величин, называемых показателями К. п., которые должны иметь количественный измеритель. Они могут быть абсолютными, относительными или удельными.
№13.скорость гомогенной химической реакции


№14.законы скорости реакций первого и второго порядка (зависимость скорости от концентрации и конверсии)
Важным понятием химической кинетики является скорость химической реакции. Эта величина определяет, как изменяется концентрация компонентов реакции с течением времени. Скорость химической реакции — величина всегда положительная, поэтому если она определяется по исходному веществу (концентрация которого убывает в процессе реакции), то полученное значение домножается на −1. Например для реакции
![]() скорость
можно выразить так:
скорость
можно выразить так:
![]()
Реакция первого порядка
Кинетическое уравнение реакции первого порядка:
![]()
Приведение уравнения
к линейному виду даёт уравнение:![]()
Константа скорости реакции вычисляется как тангенс угла наклона прямой к оси времени: k1 = − tgα
Период
полупревращения:![]()
Реакция второго порядка
Для реакций второго порядка кинетическое уравнение имеет следующий вид:
![]() или
или
![]()
В первом случае
скорость реакции определяется уравнением
![]()
Линейная форма
уравнения:![]()
Константа скорости реакции равна тангенсу угла наклона прямой к оси времени:
k2 = − tgα
![]()
Во втором случае выражение для константы скорости реакции будет выглядеть так:
![]()
Период
полупревращения (для случая равных
начальных концентраций!):![]()
15. . Дифференциальные и интегральные уравнения законов скоростей хим. реакции.Главное преимущество дифференциального метода состоит в том, что не требуется никаких предположений по поводу механизма реакции, так как дифференциальное уравнение скорости выводится непосредственно из эксперимента. Основной недостаток метода заключается в том, что исходные данные cА—t нужно сначала перевести в данные v— cА («второе поколение» экспериментальных данных). Как правило, экспериментальные кривые c—t не записываются непрерывно, а строятся по отдельным точкам. Повысить точность метода можно с помощью графических редакторов на ЭВМ путем аппроксимации точек какой-либо кривой, описываемой известной функцией, с последующим ее дифференцированием. Интегральный метод основан на использовании экспериментальной зависимости cА—t, при этом кривые расходования (накопления) вещества обрабатываются без предварительного преобразования. Главный недостаток интегрального метода состоит в том, что нужно априори предположить вид интегрального уравнения скорости, а затем проверить правомочность его использования. При квалифицированном использовании данный метод широко применяется при исследовании простых реакций, а также реакций псевдопервого порядка.
№ 16 полупериод хим реакции
Полупериод химической реакции время в течении которого концентрация реагента уменьшается в 2 раза : t1/2=(1/k)ln2
Полупериод хим. реакции.Разработаны специальные методы непрерывной струи и остановленной струи, предназначенные для измерения скорости реакций при очень малых полупериодах реакции порядка 0 001 с. Для таких и несколько более быстрых реакций используются электрохимические и релаксационные методы, например метод температурного скачка или скачка давления. Постоянно ведутся поиски возможности повышения чувствительности и прецизионности методов. Следовательно, реакции первого порядка можно отличить от реакций второго порядка по тому, зависит липолупериод реакции от начальной концентрации реагентов.

№17. энергия активации химической реакции

№18.уравнение Аррениуса (скорость химической реакции)

19влияние концентрации реагентов и температуры на скорость химической реакции
Правило Вант-Гоффа — эмпирическое правило, позволяющее в первом приближении оценить влияние температуры на скорость химической реакции в небольшом температурном интервале (обычно от 0 °C до 100 °C). Я. Х. Вант-Гофф на основании множества экспериментов сформулировал следующее правило: При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два — четыре раза.
Уравнение, которое описывает это правило следующее:
![]()
где
![]() —
скорость реакции при температуре
—
скорость реакции при температуре
![]() ,
,
![]() —
скорость реакции при температуре
—
скорость реакции при температуре
![]() ,
,
![]() —
температурный коэффициент реакции
(если он равен 2, например, то скорость
реакции будет увеличиваться в 2 раза
при повышении температуры на 10 градусов).
—
температурный коэффициент реакции
(если он равен 2, например, то скорость
реакции будет увеличиваться в 2 раза
при повышении температуры на 10 градусов).
Следует помнить, что правило Вант-Гоффа применимо только для реакций с энергией активации 60-120 кДж/моль в температурном диапазоне 10-400oC. Правилу Вант-Гоффа также не подчиняются реакции, в которых принимают участие громоздкие молекулы, например белки в биологических системах. Температурную зависимость скорости реакции более корректно описывает уравнение Аррениуса.
Из уравнения Вант-Гоффа температурный коэффициент вычисляется по формуле:
![]()
Смещение химического равновесия под действием температуры и давления (концентрации). Концентрация. Увеличение концентрации одного из реагирующих веществ сначала приводит к увеличению числа молекул этого вещества. Поскольку число столкновений с участием этих молекул увеличивается, реакция, для которой они являются реагентами, ускоряется. Это приводит к увеличению концентраций реагентов у противоположной реакции и т. д. В результате изменяется концентрация всех веществ, участвующих в химической реакции.
Можно сделать вывод, что при увеличении концентрации одного из реагирующих веществ равновесие смещается в сторону расхода этого вещества, при уменьшении концентрации равновесие смещается в сторону образования этого вещества.
Температура. Повышение температуры увеличивает кинетическую энергию всех молекул, участвующих в реакции. Но молекулы, вступающие в реакцию, при которой происходит поглощение энергии (эндотермическая реакция), начинают взаимодействовать между собой быстрее. Это увеличивает концентрацию молекул, участвующих в обратной реакции, и ускоряет ее. В результате достигается новое состояние равновесия с повышенным содержанием продуктов реакции, протекающей с поглощением энергии.
При повышении температуры равновесие смещается в сторону эндотермической реакции, при понижении температуры — в сторону экзотермической реакции.
№20.селективность
Селективность (избирательность) - отношение количества образовавшегося целевого продукта (R) к общему количеству всех полученных продуктов (R+S).
Знание этих и других технологических понятий и определений необходимо для оценки эффективности функционирования действующих, а также при анализах и расчетах, предшествующих и сопутствующих созданию новых химических производств
№21влияние температуры на селективность химической реакции

№22способы увеличения скорости гомогенной химической реакции

№23скорость гетерогенного химического процесса
Под скоростью гетерогенного химического процесса понимают количество в молях NJ одного из реагентов или продуктов реакции, которое прореагировало или образовалось в единицу времени на на единице поверхности раздела фаз. Скорость гетерогенного процесса по веществу J определяется уравнением:

Где, j –стехиометрический коэффициент у вещества J, по которому рассчитывается скорость процесса, S- реакционная поверхность, τ-время протекания процесса. Скорость гетерогенного химического процесса всегда положительна, поэтому в данном уравнение ставится знак минус, если J является реагентом, или знак плюс, если J- продукт.. Скорость процесса , рассчитанная по приведенному уравнению , иногда называют удельной скоростью, так как она зависит от размеров общей поверхности раздела фаз.
24основные стадии и кинетические особенности гетерогенных процессов
Гетерогенно-каталитическая реакция на поверхности твердого катализатора — это сложный многостадийный процесс. Наблюдаемая общая скорость каталитической реакции зависит от относительных скоростей нескольких различных по своей физической и химической при роде стадий.
1-я стадия. Сначала происходит диффузия газообразного реагента из основного потока к внешней поверхности зерна катализатора через газовую пленку, в которой концентрация реагента ниже, а концентрация продукта выше, чем в основном потоке. Эту стадию можно назвать стадией внешней диффузии.
2-я стадия. Основная часть молекул газообразного реагента диффундирует внутри пор катализатора (стадия внутренней диффузии).
3-я стадия. Молекулы реагента адсорбируются на поверхности катализатора. Адсорбция заключается в некотором уплотнении газа на поверхности твердого тела.
4-я стадия. Вслед за адсорбцией происходит собственно поверхностная химическая реакция, которая заключается в перегруппировке активированного комплекса адсорбции или во взаимодействии одного адсорбированного реагента с молекулами другого реагента. Механизм этой реакции может быть различным; от него зависит и вид кинетического уравнения. В результате поверхностной реакции образуется адсорбированный продукт
5-я стадия. Десорбция продукта с поверхности катализатора. На этом этапе также проявляются специфические свойства катализатора: энергия связи адсорбированного продукта и адсорбента должна быть такой, чтобы десорбция в объем не вызывала затруднений.
6-я стадия. Десорбированные газообразные продукты диффундируют из пор к внешней поверхности катализатора.
7-я стадия. Газообразные продукты диффундируют от поверхности катализатора в газовый поток через пограничную пленку, окружающую зерно катализатора.
25лимитирующая стадия гетерогенного химического процесса
Область протекания процесса определяет лимитирующая стадия. Лимитирующая стадия -это стадия гетерогенного процесса, характеризующаяся максимальной движущей силой или минимальной интенсивностью, то есть минимальным коэффициентом интенсивности. Второй признак лимитирующей стадии- минимальная интенсивность, характеризуемая величиной коэффициента интенсивности стадии, - применять можно только в том случае, если у всех стадий движущая сила одного порядка по концентрации. Лимитирующую стадию называют также определяющей стадией, т.е. если какая то стадия процесса – лимитирующая, то закономерности гетерогенного процесса и этой стадии совпадают. Например, если процесс протекает в кинетической области, то скорость гетерогенного процесса зависит от температуры так же, как и скорость реакции. Гетерогенный процесс, протекающий в диффузионной области, описывается законами массопереноса.
26Диффузионная
и кинетические области протекания
гетерогенного химического процесса.
Диффуз-ая
область. В результате протекания
гетерогенной химической реакции в
разных точках реакционного пространства
устанавливаются различные кон¬центрации
реагирующих веществ и продуктов реакции.
Например, при взаимодействии газообразного
реагента А с твердым реагентом В
концентрация вещества А у поверхности
реагента В будет в общем слу¬чае меньше,
чем в ядре газового потока, обтекающего
твердую части¬цу.
Градиент
концентраций реагента А является
причиной возникно¬вения диффузии —
самопроизвольного процесса переноса
вещества в результате беспорядочного
движения молекул до установления
рав¬новесного распределения концентраций.
При рассмотрении
гетерогенных процессов важно знать,
какова скорость диффузионных стадий,
не будут ли диффузионные процессы
тормозить химическое взаимодействие.
Скорость
диффузии зависит от плотности и вязкости
среды, темпе¬ратуры, природы диффундирующих
частиц, воздействия внешних сил и т. д.
Закономерности диффузионных процессов
описываются зако¬нами Фика.
Согласно
первому закону Фика количество вещества
А, перене¬сенного за счет диффузии в
единицу времени через поверхность S,
перпендикулярную направлению переноса,
пропорционально градиен¬ту концентрации
этого вещества в данный момент времени
t:
 (1)
(1)
Коэффициент пропорциональности D называется коэффи¬циентом молекулярной диффузии; его единицы измерения (длина)2•(время)-1, например см2 /с.
Изменение
концентрации вещества А во времени в
резуль¬тате молекулярной диффузии
описывается вторым законом Фика
 (2)
(2)
Заменим
в уравнении (1) градиент концентрации
на отношение конечных приращений:
 (3)
(3)
где СА - изменение концентрации на расстоянии z = δ - толщи¬ны слоя, через который проходит диффузионный поток. При протекании реакции происходит расходование исходных реагентов и образование продуктов реакции. Для стационарного протекания процесса необхо-димо непрерывное пополнение убыли реагентов у реакционной по¬верхности и удаление от нее образующихся продуктов. Перенос осу-ществляется за счет диффузии. Чем быстрее идет реакция, тем выше должна быть и скорость диффу¬зии, иначе химическая реакция будет тормозиться диффузионными процессами. Можно считать, что перепад концентраций возникает в диффузион¬ном подслое, находящемся у поверхности раздела фаз. Внутри этого диффузионного подслоя перенос вещества осуществляется исключи¬тельно за счет молекулярной диффузии. Коэффициент молекулярной диффузии D является функцией моле¬кулярных свойств того вещества, которое диффундирует, и ве¬щества, в котором происходит диффузия первого. Он слабо возрастает с ростом температуры и уменьшается с ростом давления. Чаще всего коэффициент D определяют по опытным данным, а также по эмпирическим или полуэмпирическим зависимостям. Кинетическая область. Существует ряд кинетических моделей, позволяющих описать гетерогенные процессы с помощью сравнительно простых уравнений. Наиболее распространенными среди них являются мо¬дель с непрореагировавшим ядром и квазигомогенная модель. Рас¬смотрим, в чем отличие этих моделей, на примере гетерогенной реак¬ции: aA(г)+bB(т) = rR(г)+sS(т) при протекании которой внешние размеры твердой частицы не ме¬няются. Квазигомогенная модель предполагает, что гетеро¬генный процесс протекает одновременно в любой точке объема твердой частицы. Это возможно, если газообразный реагент может достаточно свободно проникнуть внутрь твердой фазы. Более распространенной является модель с фронтальным перемещением зоны реакции. Согласно этой модели химическая реакция сначала протекает на внешней поверхно¬сти частицы. Постепенно зона химической реакции продвигается внутрь, оставляя за собой твердый продукт реакции и инертную часть исходного твердого реагента. В произвольный момент вре-мени твердая частица представляет собой внутреннее ядро, окруженное внешней оболоч-кой. Ядро состоит из не прореагировавшего реагента. Окружающая его оболоч¬ка состоит из твердого продукта и инерт¬ных веществ. Рассмотрим более детально особенности гетерогенного процесса, описываемого мо¬делью с фронтальным перемещением зоны реакции. Объектом рассмотрения будет оди¬ночная твердая частица с не изменяющимися во времени внешними размерами.
№27.экспериментальное определение области протекания гетерогенного химического процесса
Лимитирующую стадию можно экспериментально определить, изучая изменение скорости гетерогенного процесса в зависимости от температуры Т, линейной скорости газового потока u и степени измельчения 1/R..
Если гетерогенный процесс в некотором диапазоне изменения параметров его проведения лимитируется химической реакцией, то скорость его определяется в основном константой скорости поверхностного химического взаимодействия. Константа скорости k экспоненциально увеличивается с ростом температуры, в то время как коэффициенты массоотдачи на диффузионных стадиях β и β' зависят от температуры лишь очень слабо (~T1/2).
Скорость конвективной диффузии очень сильно зависит от гидродинамической обстановки. Следовательно, увеличение линейной скорости газового потока относительно твердых частиц при неизменных R и Т приведет к резкому увеличению скорости процесса, если он лимитируется внешней диффузией.
Скорость внутренней диффузии должна резко увеличиться в случае измельчения твердой. Если изучение
влияния температуры и линейной скорости потока не позволило определить лимитирующую стадию, а измельчение твердого материала вызвало существенный рост скорости гетерогенного процесса, то это значит, что он лимитируется диффузией в поры твердого вещества.
28
Основные стадии химического гетерогенного
процесса в системе газ-твердое
вещество.Химические
реакции, протекающие на границе раздела
двух фаз, называют гетерогенными.
Гетерогенные процессы широко распространены
в природе и часто используются в практике.
Примерами могут служить процессы
растворения, кристаллизации, испарения,
конденсации, химические реакции на
границе раздела двух фаз, гетерогенный
катализ и др.

29.Способы интенсификации гетерогенных химических процессов в системе газ-твердое в-во. Для интенсификации процесса, протекающего во внешнедиф. области необходимо: 1) увеличить коэффициент скорости массоотдачи по газу, применяя перемешивание или увеличивая скорость газового потока 2)изменить размеры тв. Частиц 3) увеличить концентрацию реагента в газовой фазе.
№30.катализ и катализаторы
Катализ - явление изменения скорости химической или биохимической реакции в присутствии веществ, количество и состояние которых в ходе реакции не изменяются (катализаторов).
Катализаторы - это вещества, которые, многократно вступая в промежуточное взаимодействие с участниками реакции, изменяют ее механизм и увеличивают скорость реакции; при этом они восстанавливают свой химический состав после каждого цикла промежуточных взаимодействий.
Роль катализатора состоит лишь в изменении скорости достижения состояния равновесия. Катализатор может увеличивать скорость только тех процессов, которые разрешены термодинамически.
Некоторые химические реакции без катализаторов практически неосуществимы, например, из-за слишком большой энергии активации. Катализатор снижает энергию активации реакции и позволяет тем самым проводить ее при существенно более низких температурах.
Твердые катализаторы - это высокопористые вещества с развитой внутренней поверхностью, характеризующиеся определенной пористой и кристаллической структурой, активностью, селективностью и рядом других технологических характеристик.
Рассмотрим некоторые характеристики твердых катализаторов.
Активность - мера ускоряющего воздействия по отношению к данной реакции.
Температура зажигания - это минимальная температура, при которой технологический процесс начинает идти с достаточной для практических целей скоростью.
С технологической точки зрения лучше использовать катализаторы с низкой температурой зажигания, что позволяет снизить энергетические затраты на предварительный нагрев реакционной смеси.
Селективность - способность избирательно ускорять целевую реакцию при наличии нескольких побочных.
Селективность зависит не только от выбранных катализатора, но и от условий проведения процесса.
Пористая и кристаллическая структура катализатора. Важным свойством катализатора является пористая структура, которая характеризуется размерами и формой пор; удельной поверхностью катализатора.
При выборе твердого вещества, которое должно служить катализатором, важную роль играет доступность поверхности катализатора для реагирующих газов.
Наряду с пористой структурой большое значение имеет кристаллическая структура катализаторов. Различные кристаллические модификации одного и того же вещества могут обладать сильно отличающейся каталитической активностью.
№31.технологические характеристики твердых катализаторов
Твердые катализаторы – это, как правило, высокопористые вещества с развитой внутренней поверхностью, характеризующиеся определенной пористой и кристаллической структурой, активностью, селективностью и рядом других технологических характеристик. Рассмотрим некоторые характеристики твердых катализаторов.
-Активность. При сравнении разных катализаторов обычно выбирают более активный, если он удовлетворяет основным технологическим требованиям.
Активность катализатора – мера ускоряющего воздействия по отношению к данной реакции.
- Температура зажигания. Наряду с активностью важной технологической характеристикой является температура зажигания катализатора Tзаж.
Температура зажигания – это минимальная температура, при которой технологический процесс начинает идти с достаточной для практических целей скоростью.
-Селективность. Сложные каталитические реакции могут протекать по нескольким термодинамически возможным направлениям с образованием большого числа различных продуктов. Преобладающее течение реакции зависит от используемого катализатора, причем не всегда ускоряется процесс, термодинамически самый выгодный из нескольких возможных.
Селективностью, или избирательностью, катализатора называют его способность избирательно ускорять целевую реакцию при наличии нескольких побочных
-Пористая и кристаллическая структура катализатора. Важным свойством катализатора является пористая структура, которая характеризуется размерами и формой пор, пористостью (отношением свободного объема пор к общему объему), удельной поверхностью катализатора (т. е. приходящейся на единицу массы или объема).
При выборе твердого вещества, которое должно служить активным катализатором для гетерогенных газовых реакций, важную роль играет доступность поверхности катализатора для реагирующих газов. Чем больше для каждого данного катализатора поверхность, доступная для реагирующего газа, тем выше скорость расходования реагентов в единицу времени при использовании того же количества катализатора.
-Промотирование и отравление катализаторов. Часто введение очень небольшого количества (долей процента) какой-либо посторонней добавки к основному катализатору приводит либо к резкому повышению его активности, либо, наоборот, к снижению активности на несколько порядков. В первом случае говорят о промотировании, во втором – об отравлении катализатора.
Механизм промотирования твердых катализаторов может быть различным. Добавки могут вступать с основным катализатором в химическое взаимодействие, образуя на поверхности продукты, обладающие более высокой каталитической активностью. Они могут изменить условия взаимодействия с реагентами в местах контакта основного компонента и промотора, а также увеличить дисперсность или стабилизировать пористую и кристаллическую структуру катализатора и т. п.
№32.основные стадии гетерогенно-каталитического процесса в системе твердый катализатор- газообразные реагенты
Гетерогенно-каталитическая реакция на поверхности твердого катализатора — это сложный многостадийный процесс. Наблюдаемая общая скорость каталитической реакции зависит от относительных скоростей нескольких различных по своей физической и химической при роде стадий.
1-я стадия. Сначала происходит диффузия газообразного реагента из основного потока к внешней поверхности зерна катализатора через газовую пленку, в которой концентрация реагента ниже, а концентрация продукта выше, чем в основном потоке. Эту стадию можно назвать стадией внешней диффузии.
2-я стадия. Основная часть молекул газообразного реагента диффундирует внутри пор катализатора (стадия внутренней диффузии).
3-я стадия. Молекулы реагента адсорбируются на поверхности катализатора. Адсорбция заключается в некотором уплотнении газа на поверхности твердого тела.
4-я стадия. Вслед за адсорбцией происходит собственно поверхностная химическая реакция, которая заключается в перегруппировке активированного комплекса адсорбции или во взаимодействии одного адсорбированного реагента с молекулами другого реагента. Механизм этой реакции может быть различным; от него зависит и вид кинетического уравнения. В результате поверхностной реакции образуется адсорбированный продукт
5-я стадия. Десорбция продукта с поверхности катализатора. На этом этапе также проявляются специфические свойства катализатора: энергия связи адсорбированного продукта и адсорбента должна быть такой, чтобы десорбция в объем не вызывала затруднений.
6-я стадия. Десорбированные газообразные продукты диффундируют из пор к внешней поверхности катализатора.
7-я стадия. Газообразные продукты диффундируют от поверхности катализатора в газовый поток через пограничную пленку, окружающую зерно катализатора.
№33.способы интенсификации гетерогенно-каталитического процесса в системе твердый катализатор - газообразные реагенты
Температура оказывает существенное влияние на каталитические процессы, т.к. при повышении температуры увеличивается const скорости реакции и одновременно изменяется const равновесия. Для процессов, проходящих в кинетической области, повышение температуры всегда способствует приближению процесса к состоянию равновесия. Время контакта или сопротивления реагирующих веществ с катализатором также является важной технологической характеристикой каталитического процесса, т.к. оно определяет его интенсивность. Интенсивность катализатора выражают в виде: G=pzs
G – производительность катализатора кг*ч-1 *м-3
P – плотность реагента при нормальных условиях кг*м-3
Z – мольная доля целевого продукта в газовой смеси
S – объёмная скорость, ч-1
34 Скорости прямо и обратной хим. реакций.Под скоростью химической реакции понимается изменение концентрации реагента (продукта) в единицу времени: V= (cкон – cнач)/(tкон – tнач). Cкорость химической реакции находят, определяя концентрации реагентов через определенные промежутки времени. О концентрации реагента судят по какому-либо его внешнему признаку. Это может быть его окраска, поглощение им излучения в ультрафиолетовой или инфракрасной области, электропроводность раствора и т.д.Химические реакции заключаются во взаимодействии реагентов с образованием продуктов реакциию. Не следует, однако, полагать, что направление химической реакции только одно. В действительности, химические реакции протекают и в прямом, и в обратном направлениях:Все химические реакции, в принципе, обратимы. Это означает, что в реакционной смеси протекает как взаимодействие реагентов, так и взаимодействие продуктов. В этом смысле различие между реагентами и продуктами условное. Направление протекания химической реакции определяется условиями ее проведения.
35 Равновесие в случае обратимой хим. реакции. Многие химические реакции протекают в одном направлении до полного исчерпания реагирующих веществ. Такие реакции называются химически необратимыми. Другие реакции протекают вначале в прямом направлении, а затем в прямом и обратном благодаря взаимодействию продуктов реакции. В результате образуется смесь, содержащая одновременно исходные вещества и продукты реакции. Такие реакции называют химически обратимыми. В результате химически обратимого процесса наступает истинное (устойчивое) химическое равновесие, признаками которого являются: 1) в отсутствии внешних воздействий состояние системы остается неизменным неограниченно долго; 2) любое изменение внешних условий приводит к изменению состояния системы; 3) состояние равновесия не зависит от того, с какой стороны оно достигнуто. Кроме истинных равновесий очень часто встречаются кажущиеся (ложные, заторможенные) равновесия, когда состояние системы сохраняется во времени очень долго
№36.константа равновесия обратимой химической реакции
Состояние
химического равновесия обратимых
процессов количественно характеризуется
константой
равновесия.
Так, для обратимой реакции, которую в
общем виде можно записать как

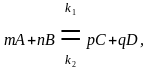
согласно закону действующих масс, скорости прямой реакции 1 и обратной 2 соответственно запишутся следующим образом:

В момент достижения состояния химического равновесия скорости прямой и обратной реакций равны:

где К — константа равновесия, представляющая собой отношение констант скорости прямой и обратной реакций.В правой части первого уравнения стоят те концентрации взаимодействующих веществ, которые устанавливаются при равновесии, — равновесные концентрации.Второе уравнение представляет собой математическое выражение закона действующих масс при химическом равновесии.Этот закон является одним из наиболее важных в химии. Исходя из кинетического уравнения любой химической реакции, можно сразу же записать отношение, связывающее равновесные концентрации реагирующих веществ и продуктов реакции. Если определить константу К экспериментально, измеряя равновесные концентрации всех веществ при данной температуре, то полученное значение можно использовать в расчетах для других случаев равновесия при той же температуре.Численное значение константы равновесия характеризует тенденцию к осуществлению реакции или, другими словами, характеризует выход данной реакции. Так, при К >> 1 выход реакции велик, так как при этом

Понятно, что при К << 1 выход реакции мал.
