
- •Структура и пространственная модель молекулы глицина
- •Глицил-изолейцил-цистеил-валил-аланил-треонин
- •Ковалентные связи и невалентные взаимодействия в белковых молекулах.
- •5. Для следующих веществ определите электронные эффекты атомов и групп атомов. Покажите распределение электронной плотности. Расставьте эти соединения в порядке увеличения кислотных свойств.
Глицил-изолейцил-цистеил-валил-аланил-треонин
Ковалентные связи и невалентные взаимодействия в белковых молекулах.
Пептидная связь является практически плоской, отклонение от плоскости не превышает 5-10. Связи NH и С=О обычно находятся в транс-расположении.
![]()
Из-за взаимодействия электронной пары атома азота с -системой карбонильной группы отсутствует свободное вращение вокруг связи СN, что ограничивает конформационную подвижность пептидной цепи. Длина пептидной связи – 0,132 нм, что меньше чем у связи СN в алифатических аминах, которая составляет 0,147 нм.
Дисульфидная связь. Тиольные функции в боковой цепи цистеина способны к окислительной димеризации, образуя дисульфидные мостики между пространственно удаленными участками одной пептидной цепи или двумя различными пептидными цепями.
Наряду с ковалентными (пептидными и дисульфидными) связями на пространственное строение белков и пептидов существенное влияние оказывают невалентные взаимодействия.

Водородные связи. Подвижные атомы водорода в группе NH, а также в расположенных в боковых цепях группах ОН и SН, обычно образуют водородные связи с атомом кислорода в группе С=О. Чаще всего такие связи реализуются между пептидными фрагментами, но возможно участие функциональных групп боковых цепей, например:
Ионные взаимодействия. Различные аминокислоты, в том числе удаленные друг от друга по аминокислотной цепи, могут связываться за счет притяжения противоположно заряженных функций боковой цепи (СООи NH3+), образуя солевые мостики, а рядом расположенные участки цепи могут наоборот отталкиваться друг от друга из-за наличия одноименно заряженных групп.
Гидрофобные взаимодействия. Под действием воды гидрофобные заместители в боковых цепях с одной стороны стремятся занять положение внутри белковой структуры с минимальным контактом с водой, а с другой стороны такие гидрофобные функции стремятся расположиться рядом, образуя гидрофобные области.
Вторичная структура белков.
Под вторичной структурой понимают пространственно упорядоченные участки пептидных цепей, стабилизированные водородными связями. Выделяют - и -структуры.
-Спираль. Пептидная цепь способна самопроизвольно закручиваться в спираль, витки которой скреплены водородными связями. Боковые радикалы аминокислотных остатков при этом оказываются на периферии спирали.
-Структура («складчатый лист») – соединенный водородными связями ассоциат вытянутых, зигзагообразных пептидных цепей. Боковые радикалы располагаются над и под плоскостью «складчатого листа».
-спираль |
«складчатый лист» |
Третичная структура белков.
Фибриллярные белки. В эту группу белков входят нерастворимые в воде белковые молекулы, имеющие нитевидное (фибриллярное) строение. Примером такой структуры может послужить белок волос и шерсти – -кератин. Три -спиральные цепи кератина закручены друг на друга, образуя протофибриллу. Комплекс протофибрилл образует микрофибриллу, из которых и состоит волос.

-спираль протофибрилла микрофибрилла
Глобулярные белки. Большинство растворимых в воде белков в пространстве представлены в виде глобулы (неправильной сферы или эллипсоида). Обычно в белковой цепи таких белков участки вторичной структуры сочетаются с неструктурированными фрагментами цепи.
Четвертичная структура.
Большинство белков с молекулярной массой выше 50 кДа представляют собой комплекс белковых молекул с третичной структурой, связанных между собой в основном водородными связями, гидрофобными и электростатическими взаимодействиями. В некоторых случаях компоненты соединены дисульфидными связями. Биологические свойства присущи именно комплексу белков, а не отдельным субъединицам. Например, структуру белка гемоглобина образуют две - и две -субъединицы, каждая из которых , содержит по молекуле гема (см. Гл. 14), способного обратимо присоединять по молекуле кислорода..
Третичная структура химотрипсина |
Четвертичная структура гемоглобина |
Пептидный синтез
Биологически активные пептиды или выделяют из природных источников, или синтезируют. Химический синтез пептидов имеет ряд особенностей.
Во-первых, карбоксильная группа при взаимодействии с аминами не дает амидной связи и, следовательно, карбоксильную группу необходимо активировать – превращать в ангидриды или активированные сложные эфиры (см. Гл. 12).
Во-вторых, для того чтобы направить реакцию на образование пептидной связи между двумя разными аминокислотами необходимо исключить взаимодействие аминокислот между собой. С этой целью используют введение защитных групп.
В-третьих, реакции необходимо проводить в мягких условиях, при которых не происходит рацемизации аминокислот или пептидов.
Рацемизация – процесс переход одного энантиомера в другой.
Разберем в качестве примера синтез дипептида глицил-глутаминовая кислота.
1. Первоначально нужно защитить аминогруппу в глицине и карбоксильные функции в глутаминовой кислоте. Для этого, соответственно, проводят ацилирование аминогруппы и этерификацию карбоксильных групп.


2. Активируют карбоксильную группу в производном глицина, превращая ее в хлорангидрид. Другие аминокислоты с целью предотвращения возможной рацемизации обычно переводят или в ангидриды, или в активированные сложные эфиры.

3. Проводят конденсацию двух аминокислот – фактически происходит ацилирование по свободной аминогруппе производного глутаминовой кислоты.
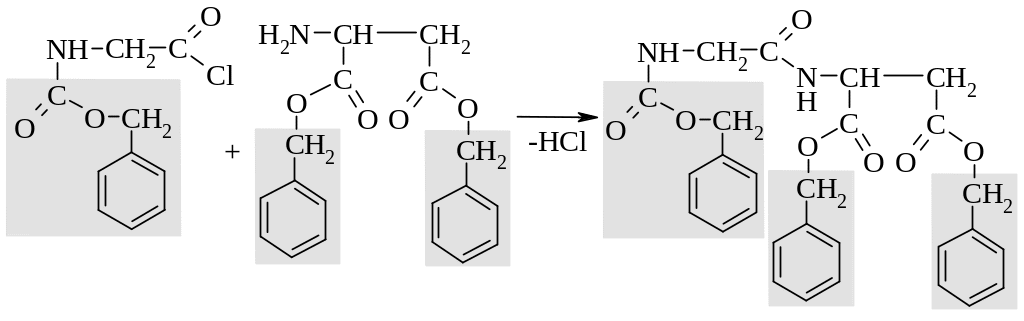
4. В завершении каталитическим гидрогенолизом удаляют защитные группы как с карбоксильной группы, так и с аминофункции.

|
Биологически активные пептиды |
|
|
|
|
|
|
|
|
|
|
Контрольные задания
1. Напишите структурные формулы:
|
а. этиллактата, тирозина. |
|
а. глицериновой кислоты, глицина; б. метилгликолата, аспарагиновой кислоты; в. салициловой кислоты, валина. |
Назовите следующие соединения по номенклатуре ИЮПАК:
|
а.
|
|
а.
|
б.
![]()
в.
![]()
2. Определите конфигурацию данного соединения по DL-номенклатуре.
|
а.
|
|
а.
|
д.
 е.
е.

3. I. Нарисуйте проекцию Фишера для данного соединения, преобразуйте ее в правильно расположенную проекцию Фишера. Определите конфигурацию по DL-номенклатуре.
II. Нарисуйте проекционную формулу его стереоизомера.
III. Обозначьте старшинство атомов, соседних с асимметрическим атомом углерода. Определите конфигурацию по RS-номенклатуре. (Пример решения задания см. Гл. 12)
|
а.
|
|
а.
|
г.
![]() д.
д.
![]() е.
е.
![]()
4. I. Какие функциональные группы присутствуют в данном соединении? Выделите их и обозначьте соответствующими буквами.
А. Гидроксил; Б. Карбонил; В. Карбоксил; Г. Эфир; Д. Галоген; Е. Нитрогруппа; Ж. Цианогруппа; З. Аминогруппа; И. Двойная связь; К. Тройная связь.
II. К каким классам органических соединений можно отнести это вещество?
А. Первичный амин; Б. Вторичный амин; В. Третичный амин; Г. Четвертичный амин; Д. Кетон; Е. Первичный спирт; Ж. Вторичный спирт; З. Третичный спирт; И. Карбоновая кислота.
III. Отметьте значком (*) асимметрические атомы углерода.
IV. Возможна ли пространственная изомерия для этого вещества?
А. Нет; Б. -Диастереомерия; В. -Диастереомерия; Г. Энантиомерия.
V. Какое максимальное теоретически возможное количество стереоизомеров существует для этого соединения?
А. Один; Б. Два; В. Четыре; Г. Восемь; Д. Шестнадцать.
|
а. ДОФА – биологический предшественник норадреналина |
б. Гидроксипролин – аминокислота, входящая в состав коллагена |
|
|
а. Треонин – незаменимая аминокислота |
б. Изолимонная кислота – компонент цикла Кребса |
|
в. Дигидроксиминдальная кислота – метаболит норадреналина |
г. Пантоевая кислота – компонент витамина В3 |
||
д. Пангамовая кислота – витамин В15 |
е. Сарколизин – противоопухолевый препарат |
||









 б.
б.
 в.
в.
 г.
г.





