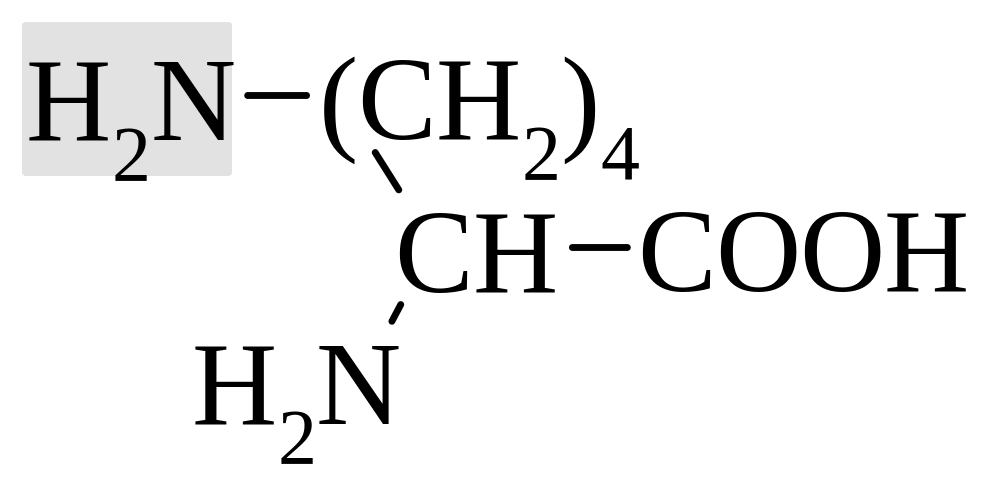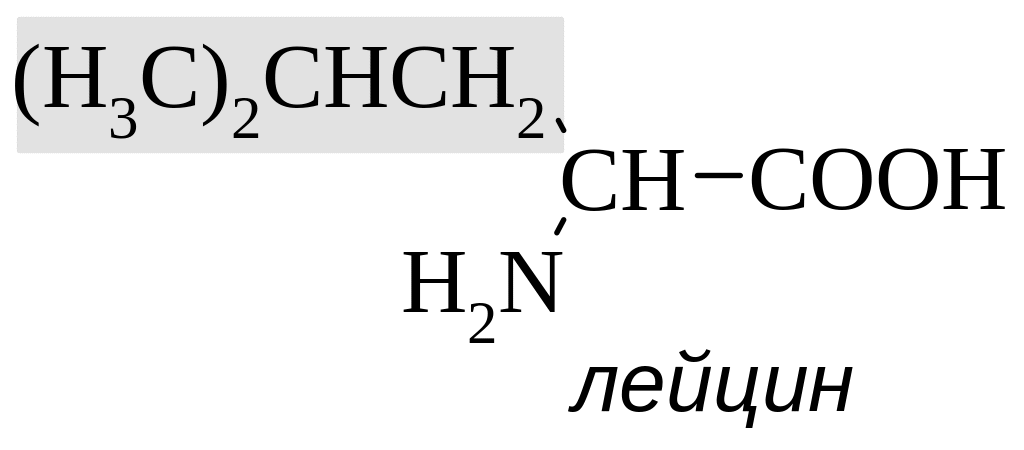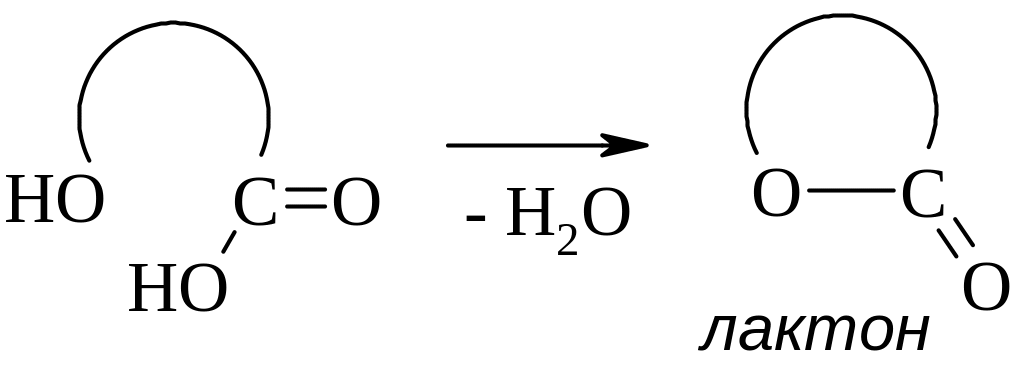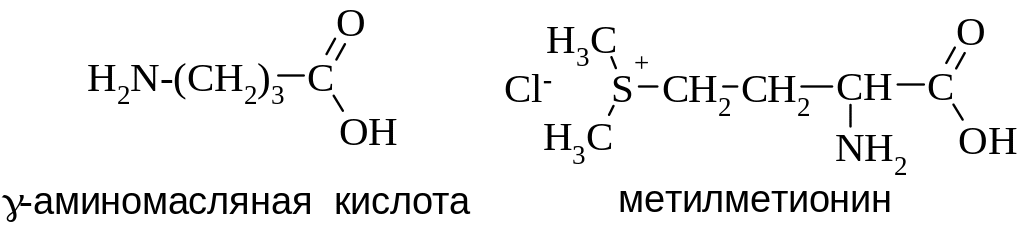- •Структура и пространственная модель молекулы глицина
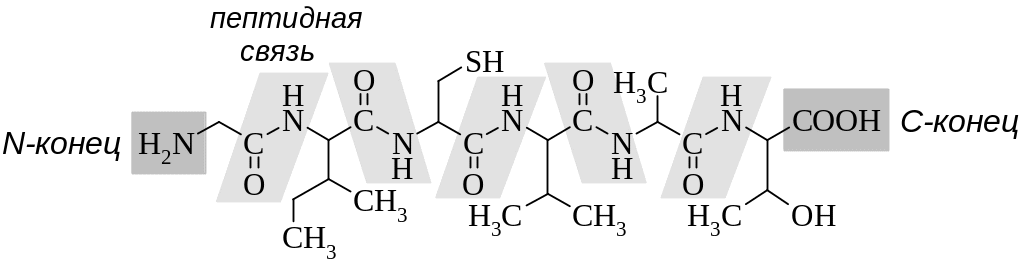
- •Глицил-изолейцил-цистеил-валил-аланил-треонин
- •Ковалентные связи и невалентные взаимодействия в белковых молекулах.
- •5. Для следующих веществ определите электронные эффекты атомов и групп атомов. Покажите распределение электронной плотности. Расставьте эти соединения в порядке увеличения кислотных свойств.
Гидрокси- и аминокислоты
16 |
гидрокси- и аминокислоты |
Среди гетерофункциональных органических соединений особое место занимают гидрокси- и аминокислоты, которые не только сами обладают биологической активностью, но и входят в состав многих активных природных соединений.
Классификация гидроксикислот
Гидроксикислотами называют карбоновые кислоты, содержащие дополнительно одну или несколько гидроксильных групп. Они классифицируют по нескольким признакам:
по природе углеводородной цепи:

2-гидроксипропановая кислота молочная кислота |
2-гидроксибензойная кислота (салициловая кислота) |
по количеству карбоксильных групп (по основности):

гидроксиуксусная кислота гликолевая кислота |
2,3-дигидроксиянтарная кислота винная кислота |
3-гидрокси-3-карбоксипентандиовая кислота лимонная кислота |
по количеству гидроксильных групп:
2-гидрокси-2-фенилуксусная кислота (миндальная кислота) |
2,3-дигидроксипропановая кислота глицериновая кислота |
по взаимному расположению гидроксильной и карбоксильной групп:
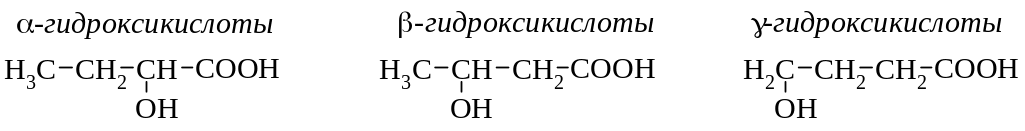
2-гидроксибутановая кислота |
3-гидроксибутановая кислота |
4-гидроксибутановая кислота |
Классификация аминокислот
Аминокислоты – соединения, одновременно содержащие карбоксильную и аминную функцию. Взаимное расположение амино- и карбоксильной групп альтернативно цифровым локантам можно показать буквами греческого алфавита. Нахождение аминофункции на конце углеводородной цепи часто обозначают буквой (омега).
-аминокислоты |
-аминокислоты |
-аминокислоты |
NH2CH2COOH аминоуксусная кислота глицин |
NH2CH2CH2COOH 3-аминопропановая кислота -аланин |
NH2(CH2)5COOH 6-аминогексановая кислота |
Из природных аминокислот наиболее распространены -аминокислоты. Известно более 300 природных аминокислот, из которых 20 считаются основными. Структура и тривиальные названия этих аминокислот представлены в приложении 3.
Химические классификации. С точки зрения химического строения аминокислоты можно подразделить по нескольким признакам.
По кислотно-оснóвным свойствам:
нейтральные аминокислоты |
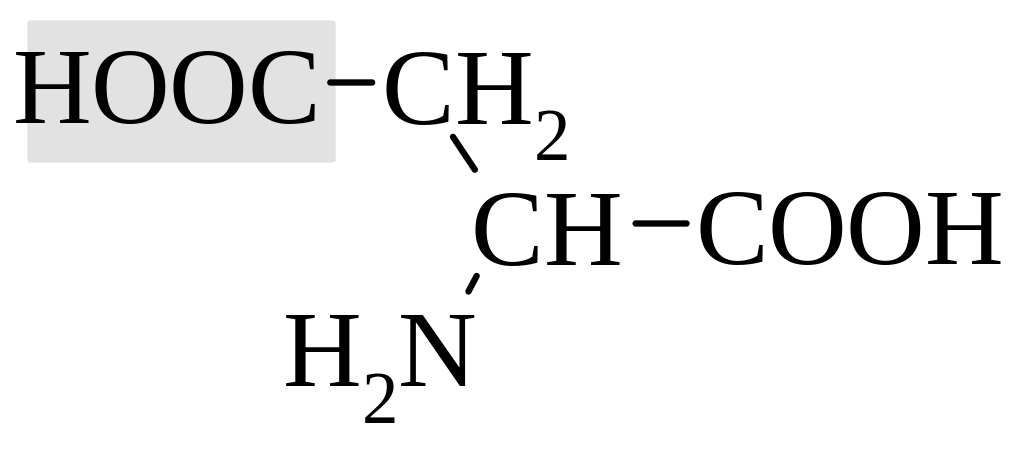
кислые аминокислоты |
оснóвные аминокислоты |
|
|
|
аланин |
аспарагиновая кислота |
лизин |
Карбоксильная и аминогруппа взаимно нейтрализуют друг друга. Дополнительная карбоксильная группа в боковой цепи придает соединению кислые свойства, соответственно, аминогруппа – оснóвные.
По природе боковой цепи:
алифатические аминокислоты |
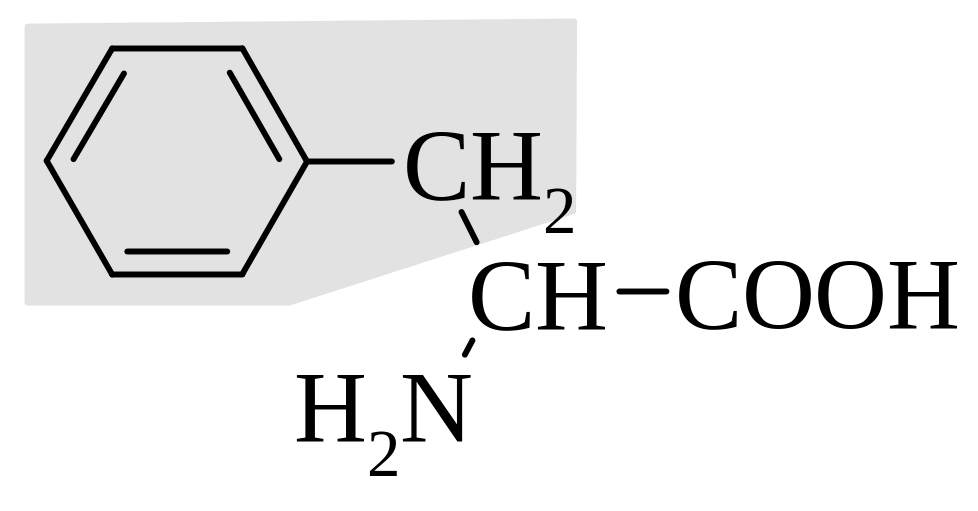
ароматические аминокислоты |
гетероциклические аминокислоты |
|
|
|
валин |
фенилаланин |
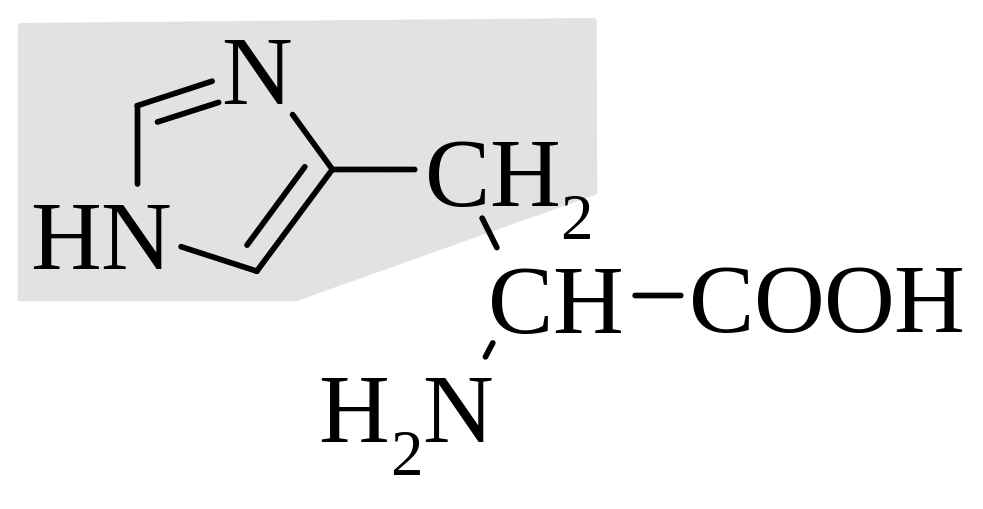
гистидин |
По гидрофильно-гидрофобным свойствам:
гидрофобные аминокислоты |
гидрофильные аминокислоты |
|
|
По отношению к воде аминокислоты подразделяются на гидрофильные – содержат в боковой цепи полярные гидроксильные, карбоксильные и аминогруппы, и гидрофобные – в боковой цепи присутствуют алифатические и ароматические заместители.
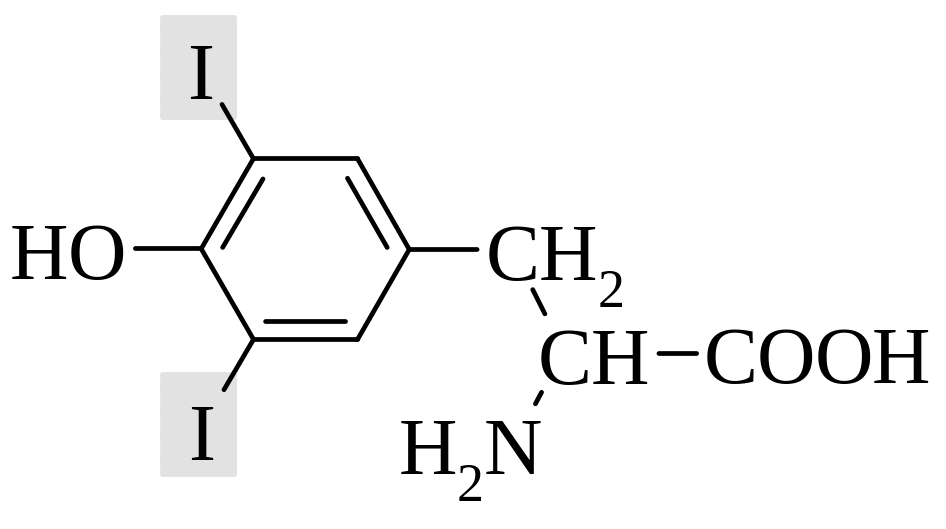
Биохимические классификации. С биохимической точки зрения выделяют 20 основных протеиногенных (образующих белки), или иначе генетически кодируемых, аминокислот. Остальные аминокислоты относят к необычным (редким) аминокислотам. Среди них многие соединения можно рассматривать как продукты биохимической модификации (метилирования, гидроксилирования, декарбоксилирования и дезаминирования и т.п.) основных аминокислот. Например:
|
|
|
4-гидроксипролин |
3,5-дииодтирозин |
саркозин |
Выделяют также незаменимые аминокислоты, которые не синтезируются в организме человека и, соответственно, должны обязательно поступать с пищей. К ним относят лизин, лейцин, изолейцин, метионин, фенилаланин, треонин, триптофан и валин.
Номенклатура ИЮПАК
По заместительной номенклатуре гидрокси- и аминокислоты рассматривают как замещенные карбоновые кислоты и для обозначения гидроксильного заместителя и аминогруппы используют префиксы гидрокси- и амино-. Примеры таких названий приведены в разделе «Классификация».
Многие гидроксикислоты имеют тривиальные названия, широко используемые в химической и биохимической литературе. Правилами ИЮПАК 1993 г. тривиальные названия сохранены для небольшого количества гидроксикислот, а также для образованных от них названий кислотных остатков и ацильных заместителей (см. таблицу 20).
Таблица 20. Тривиальные названия гидрокси- и аминокислот,
их кислотных остатков и ацильных заместителей
Структурная формула |
Название кислоты |
Название кислотного остатка |
Название ацильного заместителя |
НО-СН2СООН |
гликолевая |
гликолат |
гликолоил |
|
молочная |
лактат |
лактоил |
|
глицериновая |
глицеринат |
глицериноил |
|
винная |
тартарат |
тартароил |
|
лимонная |
цитрат |
цитроил |
|
антраниловая |
антранилат |
антранилоил |
Для основных -аминокислот правилами ИЮПАК закреплено использование тривиальных названий. Примеры таких названий приведены курсивом в разделе «Классификация», а также в приложении 3. Разрешено использование тривиального названия антраниловая кислота и соответствующих названий кислотного остатка и ацильного заместителя (см. таблицу 20).
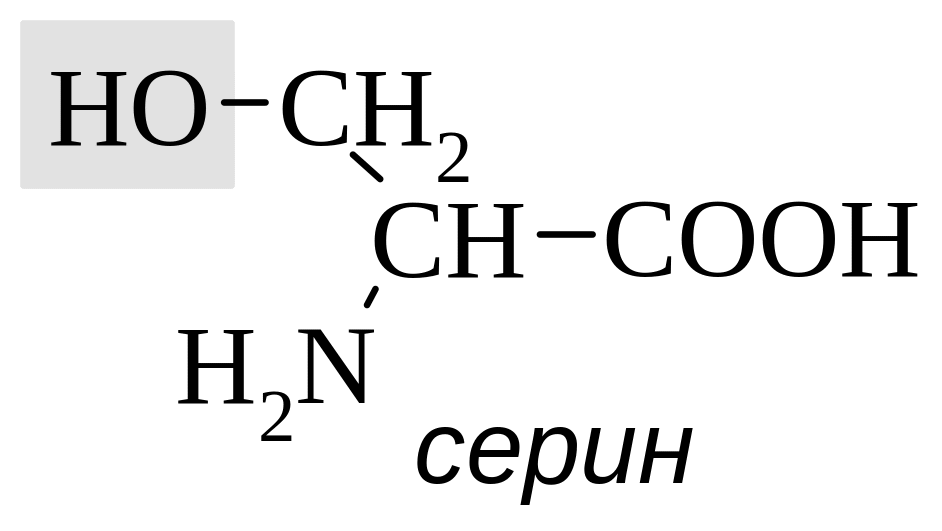
-Аминокислоты, за исключением глицина, имеют асимметрический атом углерода и могут находиться в двух энантиомерных формах. Природные аминокислоты, получаемые из белков животного и растительного происхождения, в основном относятся к L-ряду. В качестве стандарта для определения конфигурации асимметрического центра аминокислот используют природный L-серин. Например, конфигурация природного аланина обозначается L, так как конфигурация его верхнего тетраэдра совпадает с конфигурацией L-серина.
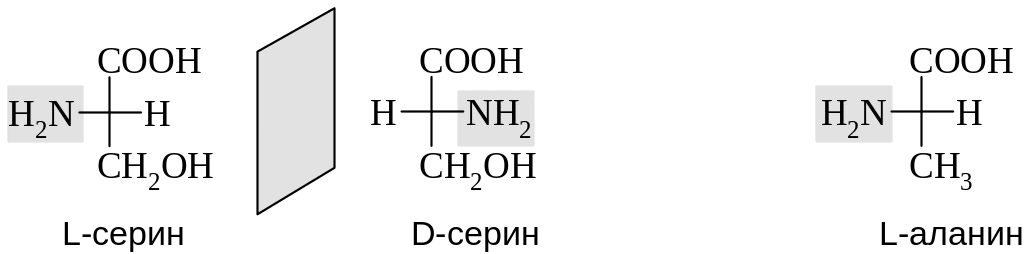
В случае аминокислот с двумя асимметрическими центрами тривиальные названия (треонин, изолейцин) закреплены за аминокислотами белкового происхождения. Для их диастереомеров применяют названия с приставкой алло-.
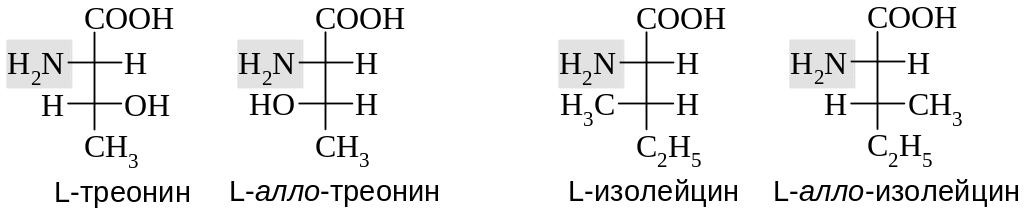
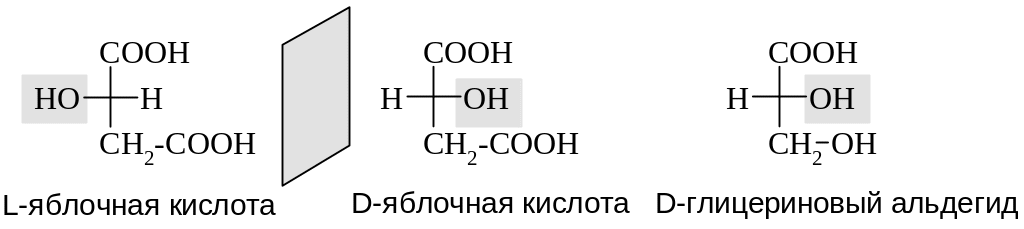
Для гидроксикислот, имеющих асимметрический атом углерода, в отличие от аминокислот в качестве стандарта для определения конфигурации по DL-номенклатуре используется D-глицериновый альдегид.
При наличии двух и более асимметрических центров индексами D или L обозначается конфигурация нижнего асимметрического атома углерода. Для показа взаимной конфигурации этих центров используются тривиальные префиксы аналогично тому, как было рассмотрено для моносахаридов (см. Гл. 15). Конфигурация винных кислот ранее рассмотрена в главе 3.
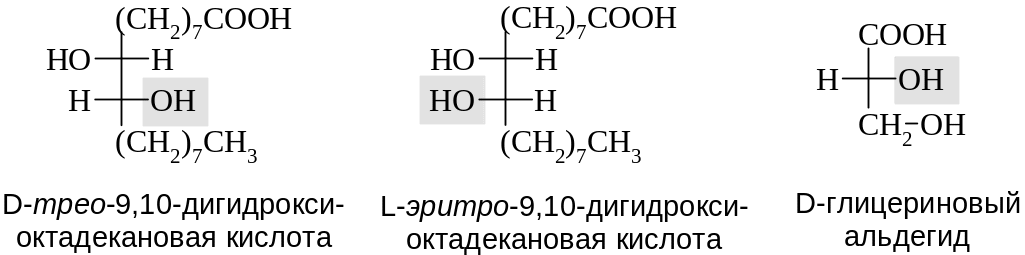
Строение гидрокси- и аминокислот
Гидроксикислоты. Гидроксильная группа, как обладающая –I-эффектом, оттягивает электронную плотность от карбоксильного атома углерода и тем самым повышает кислотность по сравнению с соответствующими карбоновыми кислотами (см. Гл. 11). Наибольшее электроноакцепторное действие наблюдается для гидроксильных групп в -положении к карбоксильной функции. Например, молочная (2-гидроксипропановая) кислота существенно сильнее 3-гидроксипропановой, а тем более пропионовой кислоты (рКа 4,9).
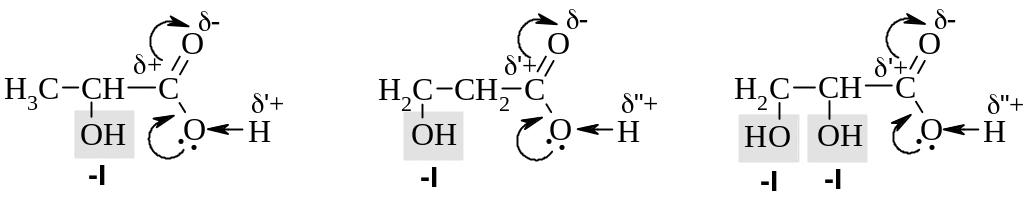
молочная кислота (рКа 3,87) |
3-гидроксипропановая кислота (рКа 4,52) |
глицериновая кислота (рКа 3,55) |
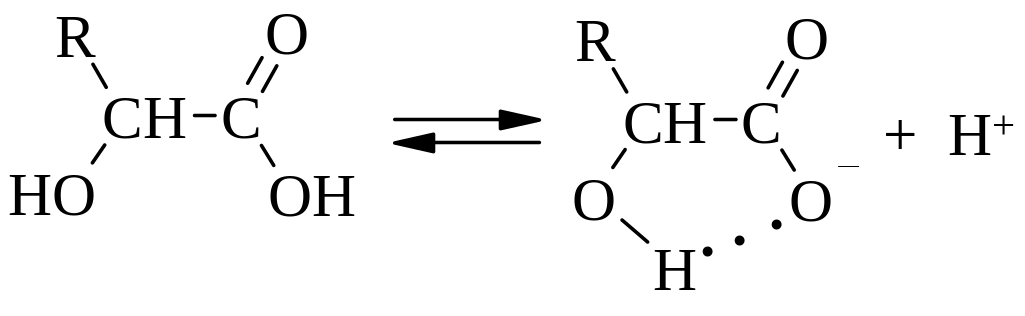
Дополнительным фактором, повышающим кислотность -гидроксикислот, является образование внутримолекулярной водородной связи, стабилизирующей карбоксилат-анион.
Поэтому о-гидроксибензойная (салициловая) кислота существенно сильнее бензойной и п-гидроксибензойной кислот, а винная и гидроксиянтарная (яблочная) кислоты сильнее янтарной кислоты.
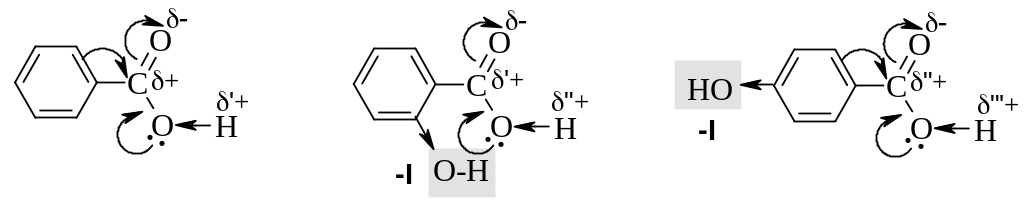
бензойная кислота (рКа 4,2) |
о-гидроксибензойная кислота (рКа 3,0) |
п-гидроксибензойная кислота (рКа 4,5) |
![]()
янтарная кислота (рКа 4,2) |
яблочная кислота (рКа1 3,5) |
винная кислота (рКа1 2,9) |
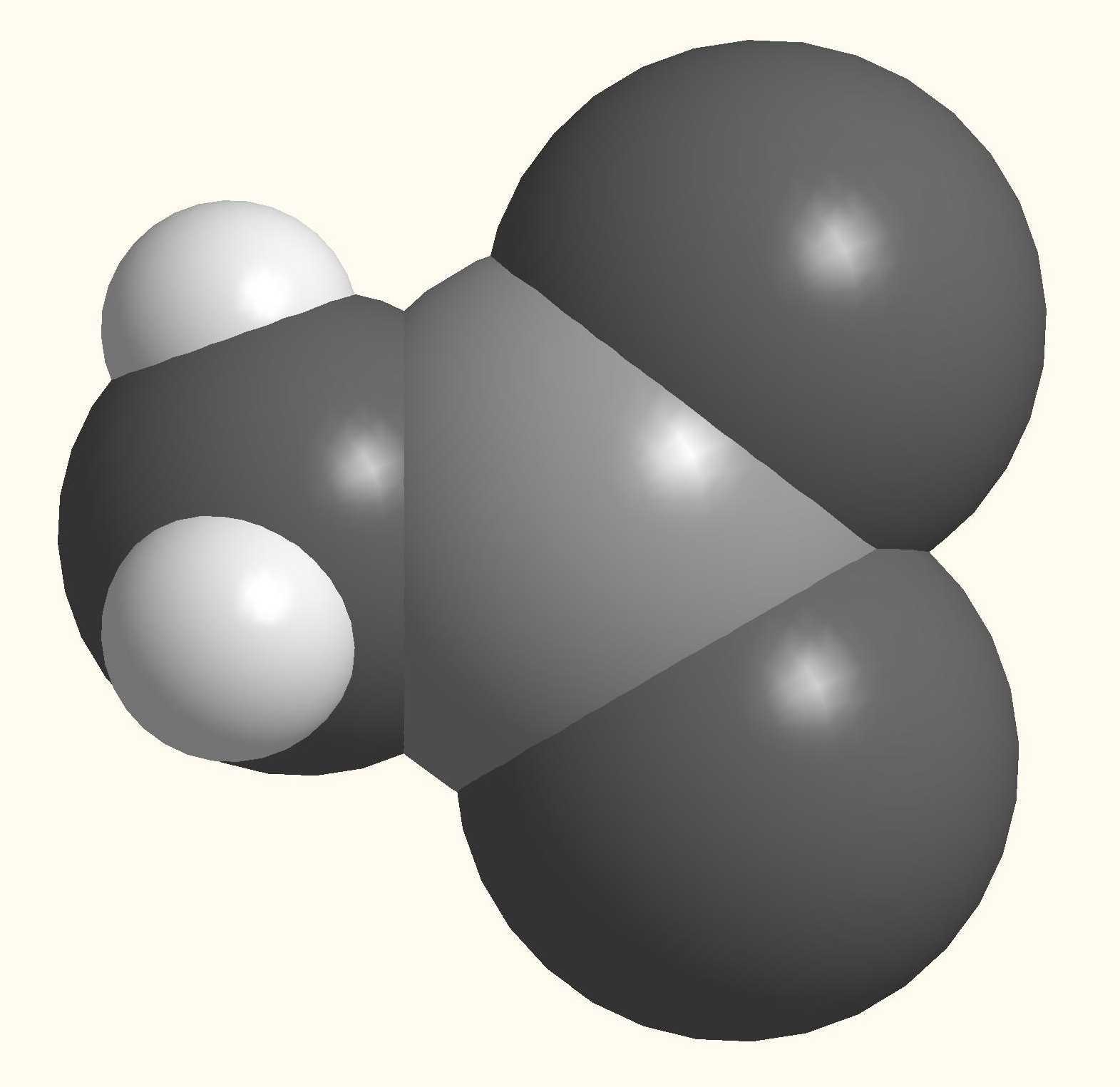
Аминокислоты в своем составе содержат кислотную и основную функции, т.е. их можно рассматривать как амфотерные органические соединения. В кристаллическом виде и в растворах аминокислоты находятся в виде биполярного иона – цвиттер-иона (внутренняя соль), который образуется за счет присоединения протона карбоксильной группы к аминогруппе. Водные растворы таких аминокислот нейтральны и из-за наличия ионов являются электролитами.
|
|
Структура и пространственная модель молекулы глицина
Реакции гидрокислот
Общие свойства.
Для гидроксикислот характерны реакции как спиртов, так и карбоновых кислот. Используя обычные условия реакции можно получить соответствующие соли, простые и сложные эфиры, галогенкарбоновые кислоты.
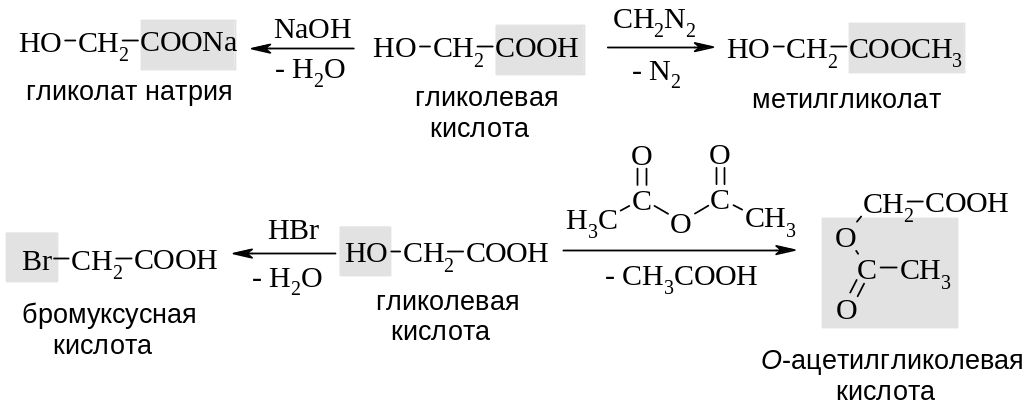
В ряде реакций карбоксильная и гидроксильная группы реагируют одновременно. Так, при действии металлического натрия или хлорида фосфора(V) участие в реакции принимают обе функциональные группы.

Реакции дегидратации.
К превращениям, специфическим для гидроксикислот, относится их дегидратация. Обычно она происходит при нагревании и, в зависимости от взаимного расположения функциональных групп, образуются продукты различного строения.
-Гидрокислоты при нагревании до 150 С дегидратируются с образованием димерных циклических сложных эфиров – лактидов.
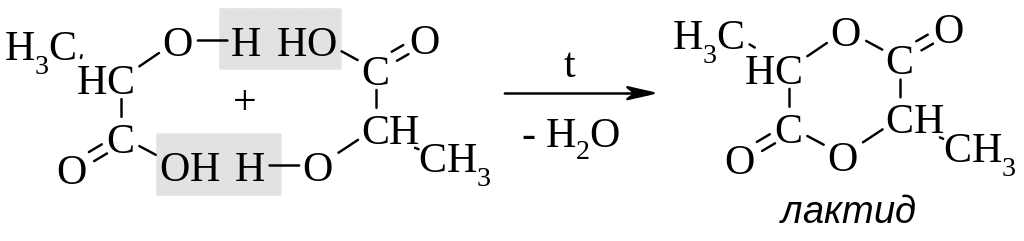
-Гидроксикислоты при нагревании образуют α,β-ненасыщенные кислоты.
![]()
γ- и δ-Гидроксикислоты при нагревании и даже самопроизвольно дегидратируются с образованием циклических внутренних сложных эфиров – лактонов.
Например:
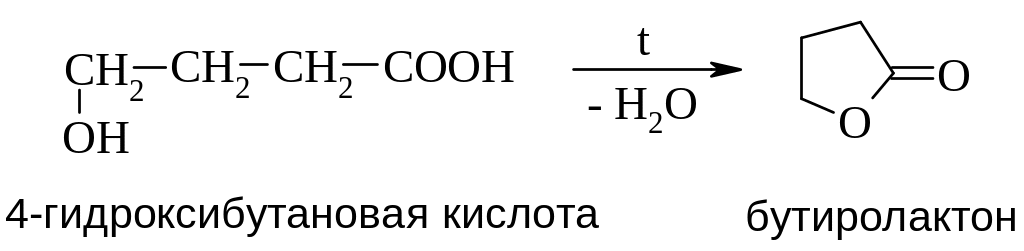
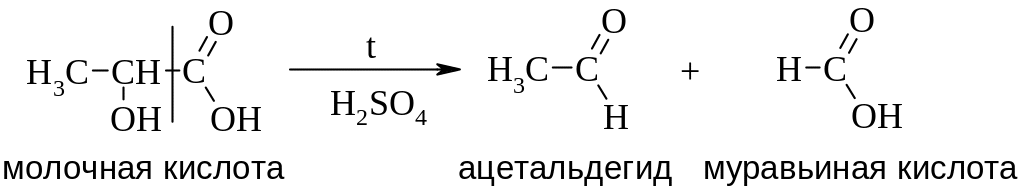
Разложение гидроксикислот.
Молочная кислота при нагревании с разбавленной серной кислотой разлагается до ацетальдегида и муравьиной кислоты.
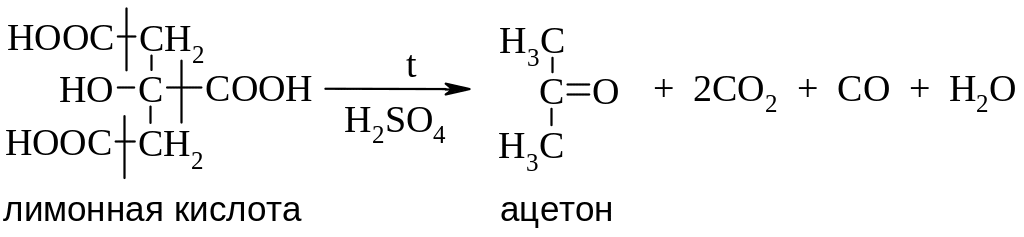
Лимонная кислота при нагревании с концентрированной кислотой разлагается на ацетон, углекислый газ и оксид углерода(II).
Комплексообразование гидроксикислот.
-Гидроксикислоты способны образовывать комплексные соединения с ионом железа(III), обладающие желтым окрашиванием.
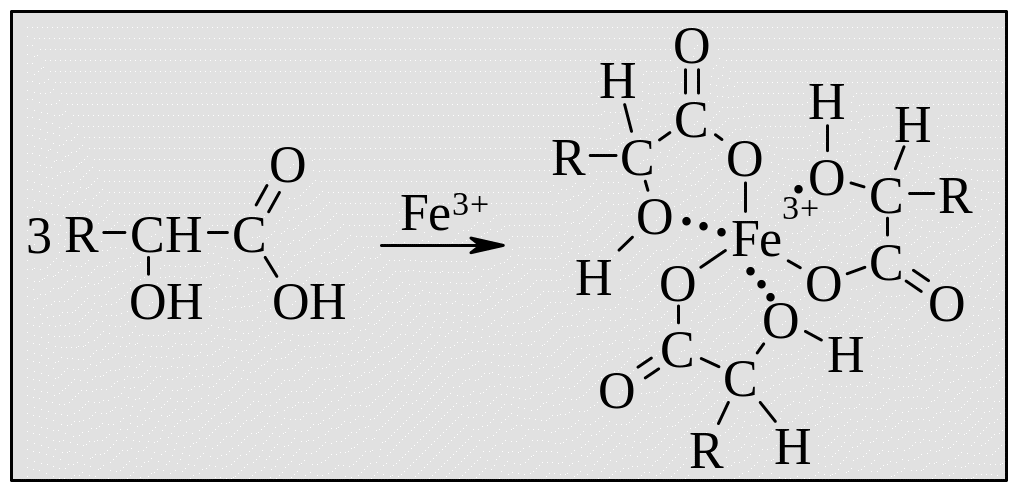
Особенно эффектно протекает эта реакция, если в качестве реагента используют комплекс фенола с хлоридом железа. Гидроксикислоты образуют с ионом железа более прочный комплекс, поэтому происходит изменение окраски с фиолетовой на светло-желтую.
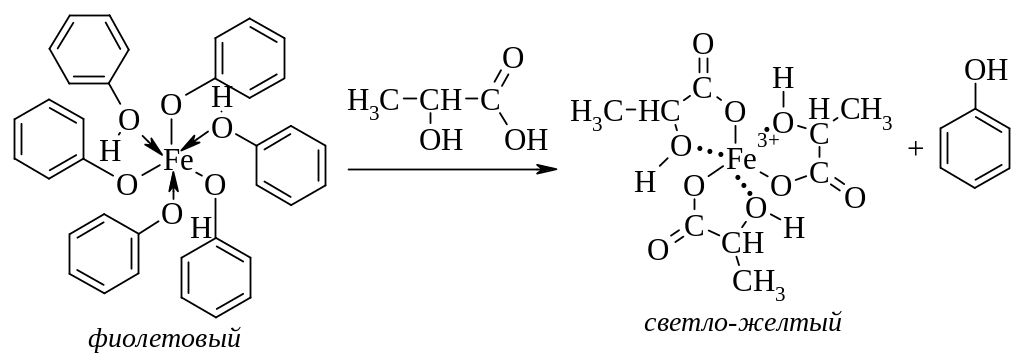
Винная кислота, имеющая в своей структуре диольную группировку, аналогично гликолям (см. Гл. 6) образует ярко-синие комплексы с гидроксидом меди(II). Все эти реакции используются как качественные.

Салициловая кислота.
Из фенолкарбоновых кислот наибольшее значение имеет о-гидроксибензойная (салициловая) кислота. Для нее характерна качественная реакция с хлоридом железа(III), в результате которой образуется комплекс интенсивно фиолетового цвета, более прочный по сравнению с комплексом фенола (см. Гл. 9).
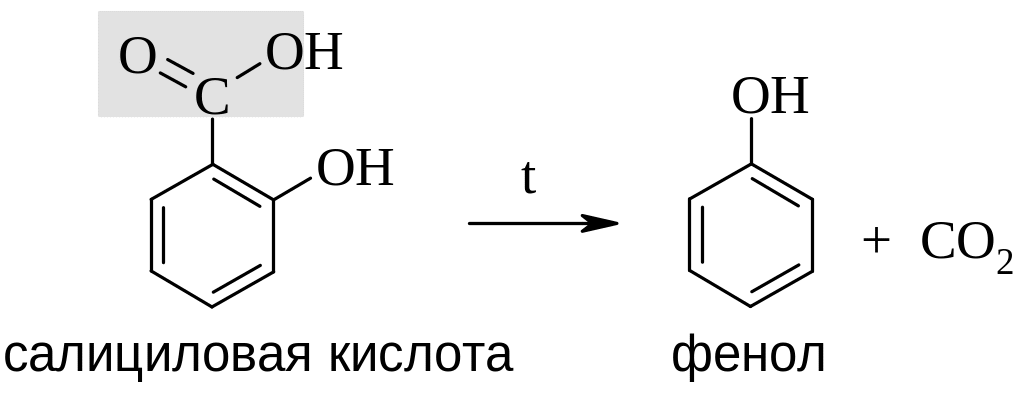
Декарбоксилирование. В отличие от бензойной кислоты, устойчивой при нагревании выше 400 С, салициловая кислота при нагревании ~250 С теряет карбоксильную группу и превращается в фенол.
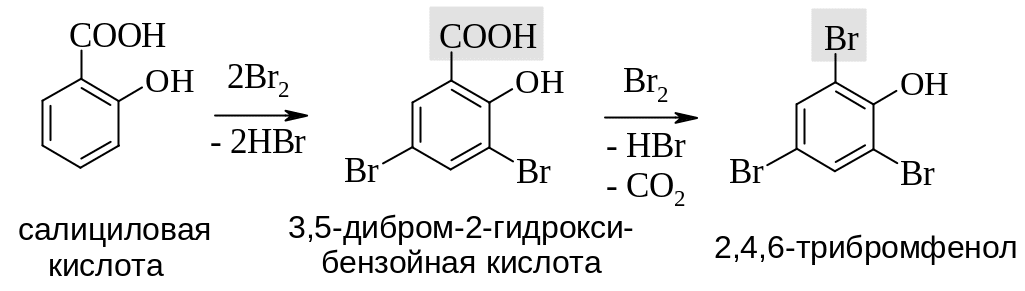
Реакции электрофильного замещения. Фенольная гидроксильная группа активирует ароматическое ядро салициловой кислоты и облегчает реакции электрофильного замещения. Заместители вводятся в орто- и пара-положения по отношению к гидроксилу. При действии избытка реагента и нагревании легко протекает декарбоксилирование и вместо карбоксильной группы вводится третий заместитель. Например:

|
Производные салициловой кислоты |
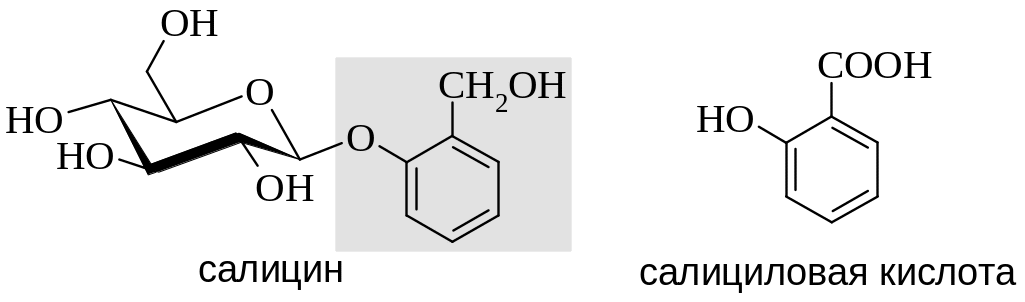
Еще в конце 18 века в качестве лекарственного препарата в европейскую медицинскую практику была введена кора ивы белой (Salix alba), обладающая жаропонижающим действием. Позже был выделен активный компонент этого препарата – гликозид салицин (см. Гл. 8, 15), содержащий в своей структуре остаток о-гидроксиметилфенола (салицилового спирта). Окисленной формой этого фенола является салициловая кислота.
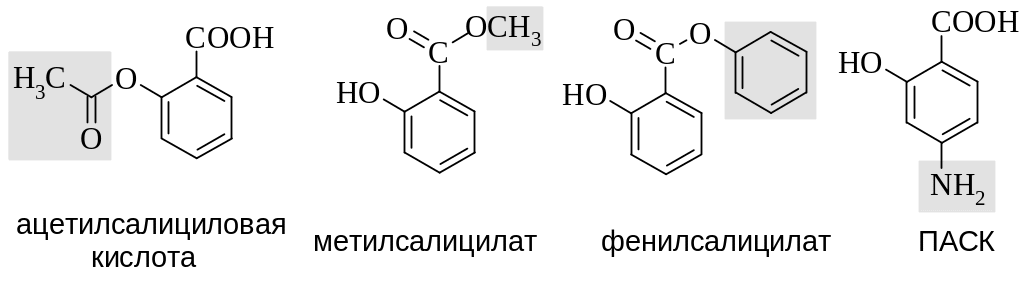
Эта же кислота в виде метилового эфира входит в состав гаультерового масла. Она обладает жаропонижающим, противовоспалительным и антисептическим действием, но из-за высокой кислотности в качестве лекарственного средства применяют ее производные:
|
|
Реакции аминокислот
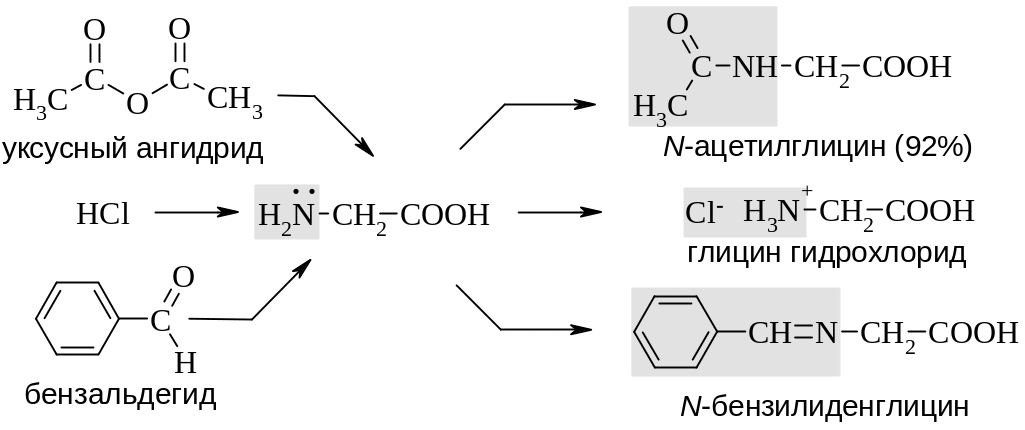
Аминокислоты, как бифункциональные соединения, вступают в основные химические реакции, характерные как для карбоновых кислот, так и для аминов. В качестве примеров приведены некоторые реакции глицина. В частности, как амин это соединение способно образовывать соли с более сильными кислотами, ацилироваться, вступать в конденсацию с карбонильными соединениями, взаимодействовать с азотистой кислотой (см. Гл. 13).
Аминокислоты, содержащие первичную аминогруппу, выделяют азот под действием азотистой кислоты, превращаясь в гидроксикислоты.
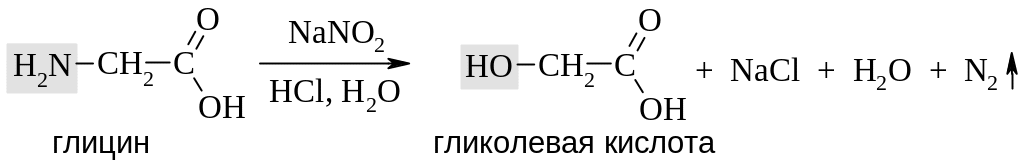
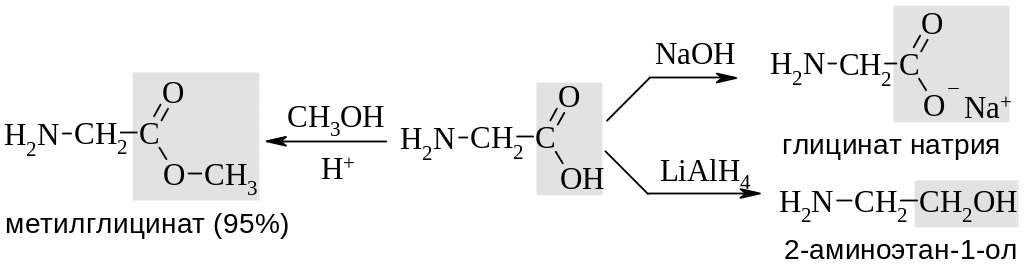
Как карбоновая кислота глицин образует соли с щелочами, подвергается этерификации с образованием сложных эфиров, восстанавливается до аминоспирта (см. Гл. 11).
Качественные реакции аминокислот.
Реакции комплексообразования. Соли d-металлов образуют окрашенные комплексы с аминокислотами. Например, образование ярко-синего окрашивания при взаимодействии с ионами меди(II) используют как качественную реакцию на аминокислоты.

Реакция с нингидрином. При взаимодействии аминокислот с нингидрином получается сине-фиолетовое окрашивание, что служит качественной реакцией на аминокислоты. В процессе реакции аминокислота дезаминируется и восстанавливается до соответствующего альдегида.
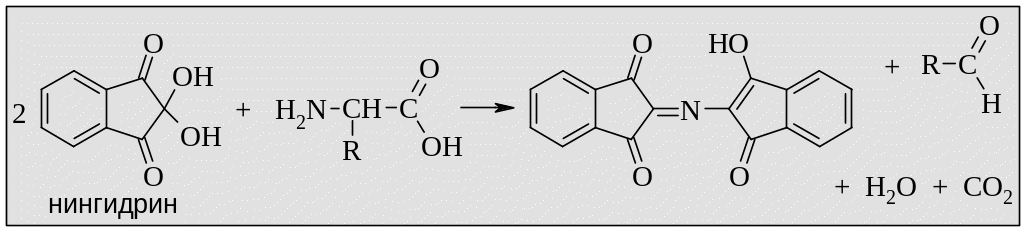
!!! Пролин и аминобензойные кислоты дают желтое окрашивание, а ряд аминов (например, анилин) – красно-оранжевое. Ложную положительную реакцию дают четвертичные аммонийные соли.
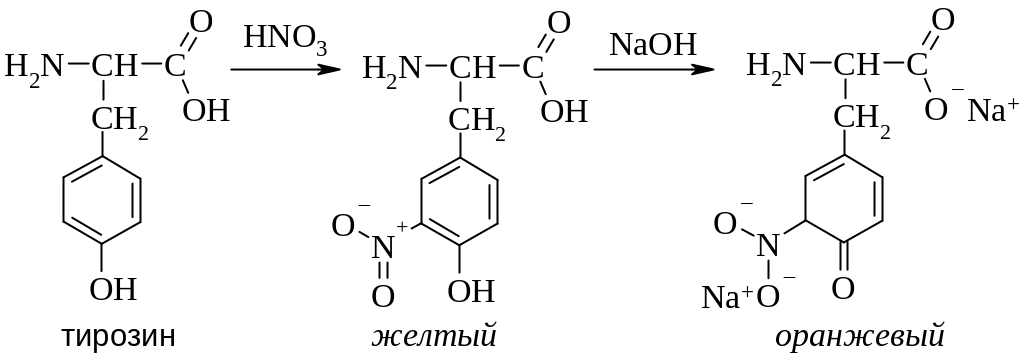
Ксантопротеиновая реакция. С помощью этой качественной реакции определяют ароматические аминокислоты, в том числе, фенилаланин, тирозин, триптофан. При последовательном действии на эти аминокислоты или белки, содержащие ароматические аминокислоты, концентрированной азотной кислоты и концентрированного раствора щелочи окраска изменяется от желтой к ярко-оранжевой.
|
В качестве примера приведена реакция с тирозином. Первоначально происходит нитрование ароматического кольца, а затем происходит ионизация нитрогруппы.
|
Биологически активные аминокислоты |
|
|
Белки и пептиды
Белки – природные полимеры, состоящие из остатков -аминокислот, соединенных посредством амидной (пептидной) связи. Молекулярная масса белков может достигать нескольких миллионов Да. Белковые структуры с молекулярной массой ниже 5000 называют пептидами.
Аминокислоты, соединяясь одна за другой пептидной связью, образуют пептидные цепи. Последовательность аминокислот в полипептидной цепи является первичной структурой белков или пептидов.
В таких цепях различают аминокислоту, у которой имеется свободная аминогруппа (так называемый N-конец), и аминокислоту со свободной карбоксильной группой (соответственно С-конец).
При построении названий коротких пептидов за основу берется С-концевая аминокислота, а остальные аминокислоты рассматриваются как ее заместитель, название которого составляют, начиная с N-конца, из перечисления ацильных заместителей аминокислот (в тривиальных названиях окончание -ин заменяют на -ил).