
10. Класифікація енергетичних термів у випадку багато електронних атомів.
Структура термів атомів з двома електронами.
Ми розібрались з вами з особливостями класифікацій енергетичних термів атомів у випадку одного електрона на зовнішній оболонці. Отже :
Знімається виродження по орбітальному квантовому числу за рахунок різного ступеня екранування заряду ядра для -електронів.
Виникає додаткове розщеплення енергетичних рівнів зумовлене спін-орбітальною взаємодією.
У одноелектронних атомів спін має дві можливості для орієнтації відносно орбітального моменту – паралельно або антипаралельно. Відповідно енергетичний рівень розщеплюється на два рівні. Тому систему енергетичних рівнів атомів з одним електроном називають дублетною.
У випадку багато електронних атомів, коли кожний електрон має свій орбітальний момент, виникає питання: Як додаються орбітальні і спінові моменти?
а)Чи відбувається між орбітальним і спіновим моментом для кожного електрона спочатку взаємодія, а потім вони додаються?, б) чи окремо між собою взаємодіють орбітальні моменти, окремо спінові моменти, а потім розкладається їх сума?
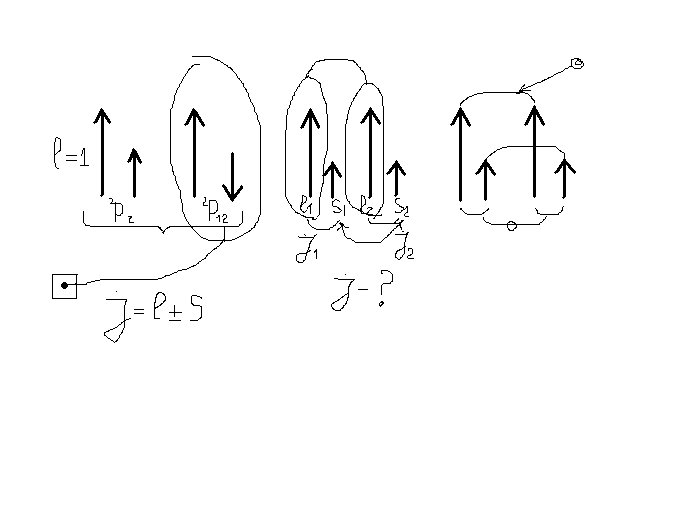
Як тут шукати повний момент?
Отже для визначення повного моменту атома (а саме к–ть значень j буде показувати на скільки рівнів буде відбуватись розщеплення внаслідок s-0 взаємодії) можна скористатися двома підходами, які проілюструємо на прикладі атомів з двома електронами.
I схема: II схема:
1+2=L 1+ s1=J1
s1+s2=S 2+ s2=J2
J=L+S J=J1+J2
Зв’язок Рассел-Саундерса (ls- зв’язок), нормальний зв’язок.
Ці наведені схеми відповідають випадкам коли переважає взаємодія між 1 і 2 та s1 і s2 , або між і і sі . Перший випадок взаємодії відомий під назвою зв’язку Рассел-Саундерса або нормального, (LS)-зв’язку. Для цього зв’язку нехтують спін-орбітальною взаємодію в межах кожного електрона і вважають незалежними орбітальні і спінові моменти електронів. При такій взаємодії окремо додають орбітальні моменти і окремо спінові. У векторній моделі це запишеться:
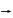 1+
2
=
1+
2
= і для взаємодіючих спінів
і для взаємодіючих спінів
 1
+
2
=
1
+
2
=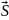 .
.
Оскільки це векторна модель, а вектори можуть мати різні проекції, і відповідно по різному один відносно орієнтувань, то відповідні значення допустимі для L будуть лежати в межах: від випадку, коли 1 і 2 - паралельні, до випадку коли 1 і 2 - анти паралельні.
Повному орбітальному моменту відповідає квантове число L , яке приймає значення L=(1+2)…(1-2).
L=
1+2
, 1+2
-1,
1+2
-2,
…
 . Чому
віднімається 1 ?
. Чому
віднімається 1 ?
бо квантове число L приймає цілі значення, відмінні на одиницю. Ми встановили крайні , а проміжні будуть відрізнятись на 1.
Для
маємо:
=
1
+
2
. Для квантового числа маємо: S
= s1+s2
, s1-s2
;
s
=1,0
 це
для двох електронної системи.
це
для двох електронної системи.
У
випадку багатоелектронних атомів в
загальному випадку для нормального
зв’язку
запишуться наступні умови:
=
 і
;
=
sі
.
і
;
=
sі
.
і
тоді для повного моменту отримаємо
вираз:
 =
+
.
=
+
.
Квантове число J, що відповідає повному моменту приймає значення:
J=
L+S, L+S-1,
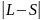 ,
(J=> 2L+1,L≤S i J=> 2S+1, L≥S) - ?
,
(J=> 2L+1,L≤S i J=> 2S+1, L≥S) - ?
Для даного L кількість значень J буде визначатись кількістю можливих значень проекцій вектора на додатній напрямок ( -?). Кількість проекцій задається магнітним квантовим числом і дорівнює 2S+1, ця величина, яка показує на скільки рівнів розщеплюється енергетичний терм з даним L внаслідок спін-орбітальної взаємодії, називається мультиплетністю.
Мультиплетність – величина, яка показує на скільки рівнів розщеплюється терм внаслідок спін-орбітальної взаємодії.
Енергетичні терми атомів у наближенні РС(Рассел-Саундерса) позначаться
χLj , де =2S+1 і визначає мультиплетність рівня.
L- повний орбітальний момент атома,
J- повний момент атома.
для L=0,1,2,3,4,5,6…, запис 3P1 означає, що χ = 3, L=1, J=1.
Розташування термів електронної конфігурації для величин нормального зв’язку.
Важливо не тільки розуміти кожен запис терму, але і вміти записувати такі терми для основного та збудженого стану атома.
Основний
стан.
Для запису терму основного стану
користуються записом електронної
конфігурації у вигляді “квантових
комірок”
 ,
де кожна комірка відповідає певній
орбіталі і містить не більше 2-х електронів.
Інший необхідний момент – це врахування
правила
Гунда.
Правило
Гунда
стосується визначення конфігурацій
основного стану, тобто визначення
найбільш стійкої конфігурації.
,
де кожна комірка відповідає певній
орбіталі і містить не більше 2-х електронів.
Інший необхідний момент – це врахування
правила
Гунда.
Правило
Гунда
стосується визначення конфігурацій
основного стану, тобто визначення
найбільш стійкої конфігурації.
{Ще
раз повернемось до кількості компонент
розщеплення у випадку одного електрона
S=1/2
могло бути тільки дві проекції згідно
магнітного квантового числа ms,
2S+1,
ms=2×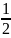 +1=2,
ms=-Sn,
S=-1/2,1/2(Аналогічно
до .
m=-до
,
m=
2+1).
У нашому випадку S=1,
отже вектор
буде мати три можливості орієнтуватись
відносно виділеного напрямку, а це
означає, що і терму будуть відповідати
три можливі різні енергії з різними j,
ми пам’ятаємо що ΔEj≈
2zz4/n3(
+1=2,
ms=-Sn,
S=-1/2,1/2(Аналогічно
до .
m=-до
,
m=
2+1).
У нашому випадку S=1,
отже вектор
буде мати три можливості орієнтуватись
відносно виділеного напрямку, а це
означає, що і терму будуть відповідати
три можливі різні енергії з різними j,
ми пам’ятаємо що ΔEj≈
2zz4/n3(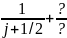 ).
).
Число можливих значень проекцій S і відповідно J дорівнює 2S+1. Це число 2S+1 і визначає мультиплетність терма.}
Для
прикладу розглянемо, яка із 2p2
–конфігурацій відповідає основному
стану, тобто відповідає найменшій
енергії,
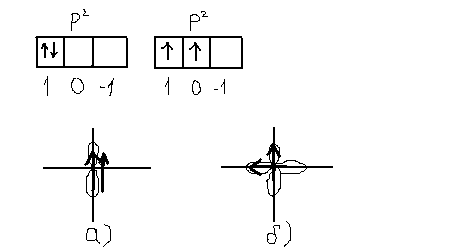
Паралельно намалюємо електронні хмарки. Конфігурації а) може бути молою енергією, бо відштовхування між електронами більше у випадку а), ніж у випадку б). Отже конфігурація б) із неспареними електронами буде більш сильною.
І правило Гунда і говорить, що основному стану відповідає конфігурація з максимальним числом неспарених спінів, тобто з максимальним спіном. Згідно цього правила для визначення основного стану треба розташувати електрони в комірках, щоб спін S був максимальним.
ІІ правило Гунда – найбільшу енергетичність має терм з максимальним значенням L. Максимальному значенню L буде відповідати максимальне значення магнітного квантового числа. (Пригадаєм, що mзмінюється від -…0,1…), отже максимальне mі відповідає значенню . Згідно з цим правилом нам треба додати mдля кожної комірки і абсолютне значення суми дасть величину L, тобто визначає символ терма.
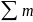
=
ML
=> L -?
=
ML
=> L -?
ІІІ правило Гунда дозволяє розташувати енергетичні рівні згідно квантового числа J. Для конфігурацій з наполовину наповненими оболонками найбільш стабільним є терм з мінімальним J. Для заповнених більш, ніж наполовину стабільним термом буде терм з максимальним значенням J.
Продемонструємо застосування цих правил до визначення основних термів деяких атомів.
Для атома кисню зовнішня оболонка має вигляд 2p4 => Будуємо квантові комірки для p-орбіталей.
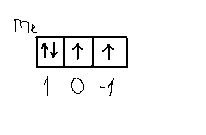 Заповнюємо
електрони згідно вимоги, що спін
максимальний. Шукаємо суму
= 1 , що відповідає стану з L=1.
Тобто основному стану відповідає терм
– P.
Спін для цього стану S=1,
отже χ=2S+1=3-
мультиплетність. J
приймає значення J=L+S,…L-S
=> 2,1,0. Енергетичні рівні будуть
розташовані у порядку спадання J,
Заповнюємо
електрони згідно вимоги, що спін
максимальний. Шукаємо суму
= 1 , що відповідає стану з L=1.
Тобто основному стану відповідає терм
– P.
Спін для цього стану S=1,
отже χ=2S+1=3-
мультиплетність. J
приймає значення J=L+S,…L-S
=> 2,1,0. Енергетичні рівні будуть
розташовані у порядку спадання J,
 оскільки
атом має більш, ніж на половину заповнену
оболонку.
оскільки
атом має більш, ніж на половину заповнену
оболонку.
{Розглянемо ще конфігурацію p2:
= 1, L=1 1, S=1, χ=3, J= 2,1,0
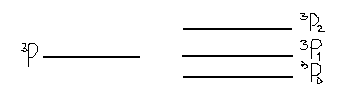
І ще звернемо увагу, що терми p2 і p4 однакові і відрізняються тільки порядком розташування J. Тобто в загальному ми могли б записати, що терми pn- і p6-n-обол є однакові. Аналогічне співвідношення і для інших оболонок f n = f 14-n ; d4 = d10-n}.
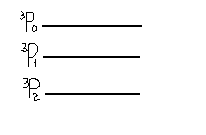
Збуджений стан. Продемонструємо побудову термів для двохелектронного атому. На відміну від основного стану, де значення спіну регламентовано, тобто розташування спінів повинно бути згідно правила Гунда, для збуджених атомів цього немає. Тут спіни можуть займати усі можливі орієнтації. Продемонструємо це для p2 – конфігурації, для якої щойно знайшли конфігурацію в основному стані.
DPS
P2 , 1=1, 2=1, L=1+2…1-2 = 2,1,0 .
L=2-D S=0,1 χ=1, χ=3 1D2 3D1,2,3 J=1,2,3.
L=1-P S=0,1 1P1 3P0,1,2 J=0,1,2.
L=0-S S=0,1 1S0 3S1 J=0, J=1.
Ви бачите, які різні стани мають електронні конфігурації p2 в основному і p2 в збудженому стані.
