
- •Предмет физики. Связь физики с другими науками. Границы применимости классической
- •Кинематика материальной точки. Скорость и ускорение произвольно движущейся материальной точки.
- •Кинематика вращательного движения материальной точки.
- •Динамика материальной точки. Законы Ньютона.
- •Закон сохранения импульса в классической механике.
- •Инерциальные системы отсчета. Принцип относительности Галилея.
- •Работа и кинетическая энергия.
- •Потенциальное поле сил. Силы консервативные и неконсервативные.
- •Потенциальная энергия. Примеры. Закон сохранения энергии в механике.
- •Связь между потенциальной энергий и силой.
- •Движение твердого тела. Закон вращения твердого тела вокруг неподвижной оси.
- •Кинетическая энергия вращающегося тела. Работа сил при вращении тела вокруг неподвижной оси.
- •Моменты инерции некоторых тел. Свободные оси.
- •Теорема Штейнера.
- •Основные представления молекулярно-кинетической теории. Масса и размеры молекул. Понятие о статистическом методе.
- •Опытные газовые законы. Уравнение Менделеева-Клапейрона.
- •Основное уравнение молекулярно-кинетической теории газ зов и его следствия.
- •Внутренняя энергия газа. Число степеней свободы молекулы.
- •Первое начало термодинамики. Применение первого начала термодинамики к изопроцессам. Уравнение Майера.
- •Теплоемкость идеального газа. Физический смысл универсальной газовой постоянной.
- •Круговые процессы (циклы). Тепловые и холодильные машины. К.П.Д. Тепловой машины.
- •Цикл Карно. К.П.Д. Идеальной тепловой машины.
- •Энтропия. Второе начало термодинамики.
- •Свойства электрического заряда. Закон Кулона. Закон сохранения электрического заряда. Работа по перемещению заряда в электростатическом поле.
- •Электрическое поле. Напряженность
- •Теорема Остроградского-Гаусса для поля в вакууме.
- •Примеры применения теоремы Остроградского Гаусса.
- •Потенциал электростатического поля.
- •Электрическое поле в веществе. Типы диэлектриков.
- •Теорема Остроградского-Гаусса для поля в диэлектрике. Электрическое смещение.
- •Проводники в электрическом поле.
- •Электроемкость уединенного проводника. Конденсаторы.
- •Энергия заряженного проводника, конденсатора.
- •Энергия электростатического поля.
- •Электрический ток, его характеристики и условия существования.
- •Скорость хаотического движения электронов в металле.
- •Классическая электронная теория электропроводности металлов.
Круговые процессы (циклы). Тепловые и холодильные машины. К.П.Д. Тепловой машины.
Количество
теплоты, полученное рабочим телом от
нагревателя при изотермическом
расширении, равно![]() .
.
Аналогично,
при изотермическом сжатии рабочее тело
отдало холодильнику![]() .
.
Отсюда коэффициент
полезного действия тепловой
машины Карно равен![]() .
.
Из последнего выражения видно, что КПД тепловой машины Карно зависит только от температур нагревателя и холодильника. Кроме того, из него следует, что КПД может составлять 100 % только в том случае, если температура холодильника равна абсолютному нулю. Это невозможно, но не из-за недостижимости абсолютного нуля (этот вопрос решается только третьим началом термодинамики, учитывать которое здесь нет необходимости), а из-за того, что такой цикл или нельзя замкнуть, или он вырождается в совокупность двух совпадающих адиабат и изотерм.
Поэтому максимальный КПД любой тепловой машины, будет меньше или равен КПД тепловой машины Карно, работающей при тех же температурах нагревателя и холодильника. Например, КПД идеального цикла Стирлинга равен КПД цикла Карно.
Цикл Карно. К.П.Д. Идеальной тепловой машины.
Пусть тепловая машина состоит из нагревателя с температурой TH, холодильника с температурой TX и рабочего тела.
Цикл Карно состоит из четырёх стадий:
Изотермическое расширение (на рисунке — процесс A→Б). В начале процесса рабочее тело имеет температуру TH, то есть температуру нагревателя. Затем тело приводится в контакт с нагревателем, который изотермически (при постоянной температуре) передаёт ему количество теплоты QH. При этом объём рабочего тела увеличивается.
Адиабатическое (изоэнтропическое) расширение (на рисунке — процесс Б→В). Рабочее тело отсоединяется от нагревателя и продолжает расширяться без теплообмена с окружающей средой. При этом его температура уменьшается до температуры холодильника.
Изотермическое сжатие (на рисунке — процесс В→Г). Рабочее тело, имеющее к тому времени температуру TX, приводится в контакт с холодильником и начинает изотермически сжиматься, отдавая холодильнику количество теплоты QX.
Адиабатическое (изоэнтропическое) сжатие (на рисунке — процесс Г→А). Рабочее тело отсоединяется от холодильника и сжимается без теплообмена с окружающей средой. При этом его температура увеличивается до температуры нагревателя.
При изотермических процессах температура остаётся постоянной, при адиабатических отсутствует теплообмен, а значит, сохраняется энтропия:
![]() при δQ =
0.Поэтому цикл Карно удобно представить
в координатах T и S (температура и энтропия).
при δQ =
0.Поэтому цикл Карно удобно представить
в координатах T и S (температура и энтропия).
Энтропия. Второе начало термодинамики.
Второе начало термодинамики — физический принцип, накладывающий ограничение на направление процессов передачи тепла между телами.
Второе начало термодинамики гласит, что невозможен самопроизвольный переход тепла от тела, менее нагретого, к телу, более нагретому.
Второе начало термодинамики запрещает так называемые вечные двигатели второго рода, показывая что коэффициент полезного действия не может равняться единице, поскольку для кругового процесса температура холодильника не должна равняться 0.
Второе начало термодинамики является постулатом, не доказываемым в рамках термодинамики. Оно было создано на основе обобщения опытных фактов и получило многочисленные экспериментальные подтверждения.
Энтропи́я (от греч. ἐντροπία —
поворот, превращение) в естественных
науках —
мера порядка системы,
состоящей из единого элемента.
В частности, встатистической
физике — мера вероятности осуществления
конкретного макроскопического состояния;
в теории
информации —
мера конкретизации какого-либо опыта
(испытания), который должен иметь разные
исходы, а значит и качество информации;
в исторической
науке,
для экспликации феноменаальтернативности
истории (инвариантности
и вариативности исторического
процесса).
![]()
Статистический смысл второго начала термодинамики. Энтропия и вероятность.


Число столкновений и длина свободного пробега молекул в газе.
Средние скорости
молекул, газа очень велики - порядка
сотен метров в секунду при обычных
условиях. Однако процесс выравнивая
неоднородности в газе вследствие
молекулярного движения протекает весьма
медленно. Это объясняется тем, что
молекулы при перемещении испытывают
соударения с другими молекулами. При
каждом соударении скорость молекулы
изменяется по величине и направлению.
Вследствие этого, скорость, с которой
молекула диффундирует из одной части
газа в другую, значительно меньше средней
скорости молекулярного движения. Для
оценки скорости движения молекул
вводится понятие средней длины свободного
пробега. Таким образом, средняя дли
свободного пробега ![]() -
это среднее расстояние, которое проходит
молекула от столкновения до столкновения.
-
это среднее расстояние, которое проходит
молекула от столкновения до столкновения.
Д ля
определения
вычислим
сначала среднее число соударений
ля
определения
вычислим
сначала среднее число соударений ![]() выбранной
молекулы с другими молекулами за единицу
времени. Будем считать, что молекула
после соударения продолжает двигаться
по прямой со средней скоростью движения
выбранной
молекулы с другими молекулами за единицу
времени. Будем считать, что молекула
после соударения продолжает двигаться
по прямой со средней скоростью движения ![]() .
.
Молекулы, с которыми
соударяется выбранная молекула, в первом
приближении считаем неподвижными и
принимаем их за сферические тела радиуса
r. Пусть выбранная молекула движется
вправо из положения ![]() в
положение
в
положение ![]() по
прямой
по
прямой ![]() (рис.11.3).
При своем движении она испытывает
соударения с теми неподвижными молекулами,
центры которых лежат не дальше чем 2r от
траектории
.
Иными словами, движущаяся со средней
скоростью молекула в течении одной
секунды столкнется со всеми молекулами,
центры которых находятся в объеме
ограниченном цилиндром с радиусом 2r и
длиной
,
т.е.
(рис.11.3).
При своем движении она испытывает
соударения с теми неподвижными молекулами,
центры которых лежат не дальше чем 2r от
траектории
.
Иными словами, движущаяся со средней
скоростью молекула в течении одной
секунды столкнется со всеми молекулами,
центры которых находятся в объеме
ограниченном цилиндром с радиусом 2r и
длиной
,
т.е.![]() .
.
Если концентрация молекул n , то внутри рассмотренного цилиндра находится число молекул, равное
![]() Это
число
и
определяет среднее число соударений
за единицу времени.
Это
число
и
определяет среднее число соударений
за единицу времени.
Предположение о
том, что все молекулы, кроме одной,
неподвижны, является, конечно не верным.
В действительности все молекулы движутся,
и возможность соударения двух частиц
зависит от их относительной скорости.
Поэтому вместо среднеарифметической
скорости
должны
входить средняя относительная скорость
молекул ![]() .
Если скорости молекул распределены по
закону Максвелла, то, как можно показать,
средняя относительная скорость двух
молекул однородного газа в
.
Если скорости молекул распределены по
закону Максвелла, то, как можно показать,
средняя относительная скорость двух
молекул однородного газа в ![]() раз
превышает
.
Таким образом, среднее число соударений
должно быть увеличено в
раз
раз
превышает
.
Таким образом, среднее число соударений
должно быть увеличено в
раз
![]() (11.7)Средний путь,
проходимый молекулой за единицу времени,
численно равен
.
Поэтому средняя длина свободного пробега
равна
(11.7)Средний путь,
проходимый молекулой за единицу времени,
численно равен
.
Поэтому средняя длина свободного пробега
равна ![]() или
или![]() (11.8)
(11.8)
Таким образом,
средняя длина свободного пробега
не
зависит от температуры газа, т.к. с ростом
температуры одновременно возрастают
и
,
и
.
При подсчете числа соударений и средней
длины свободного пробега молекул за
модель молекулы было принято шарообразное
упругое тело. В действительности каждая
молекула представляет собой сложную
систему элементарных частиц и при
рассмотрении упругого соударения
молекул имелось в виду, что центры
молекул могут сблизиться до некоторого
наименьшего расстояния. Затем возникает
силы отталкивания которые вызывают
взаимодействие, подобное взаимодействию
при упругом ударе. Среднее расстояние
между центрами молекул, взаимодействующих,
как при упругом ударе, называют эффективным
диаметром ![]() .
Тогда
.
Тогда![]() (11.9)
(11.9)
Реальные газы. Уравнение Ван-дер-Ваальса. Изотермы реального газа.
Реальный газ — газ, который не описывается уравнением состояния идеального газа Клапейрона — Менделеева.
Зависимости между его параметрами показывают, что молекулы в реальном газе взаимодействуют между собой и занимают определенный объём. Состояние реального газа часто на практике описывается обобщённым уравнением Менделеева — Клапейрона:
![]() где
p — давление; V - объем T — температура;
Zr = Zr (p,T) — коэффициент
сжимаемости газа;
m - масса; М —молярная
масса;
R — газовая
постоянная.
где
p — давление; V - объем T — температура;
Zr = Zr (p,T) — коэффициент
сжимаемости газа;
m - масса; М —молярная
масса;
R — газовая
постоянная.
Для ν молей
газа Ван-дер-Ваальса уравнение состояния
выглядит так:![]()
где
V — объём,
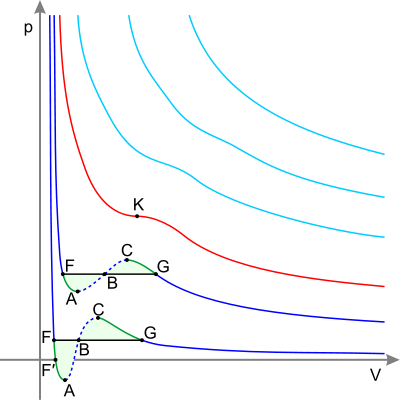
Изотермы реального газа (схематично) Синие — изотермы при температуре ниже критической. Зелёные участки на них — метастабильные состояния. Участок левее точки F — нормальная жидкость. Точка F — точка кипения. Прямая FG — равновесие жидкой и газообразной фазы. Участок FA — перегретая жидкость. Участок F′A — растянутая жидкость (p<0). Участок AC — аналитическое продолжение изотермы, физически невозможен. Участок CG — переохлаждённый пар. Точка G — точка росы. Участок правее точки G — нормальный газ. Площади фигуры FAB и GCB равны. Красная — критическая изотерма. K — критическая точка. Голубые — сверхкритические изотермы
