
- •Предмет физики. Связь физики с другими науками. Границы применимости классической
- •Кинематика материальной точки. Скорость и ускорение произвольно движущейся материальной точки.
- •Кинематика вращательного движения материальной точки.
- •Динамика материальной точки. Законы Ньютона.
- •Закон сохранения импульса в классической механике.
- •Инерциальные системы отсчета. Принцип относительности Галилея.
- •Работа и кинетическая энергия.
- •Потенциальное поле сил. Силы консервативные и неконсервативные.
- •Потенциальная энергия. Примеры. Закон сохранения энергии в механике.
- •Связь между потенциальной энергий и силой.
- •Движение твердого тела. Закон вращения твердого тела вокруг неподвижной оси.
- •Кинетическая энергия вращающегося тела. Работа сил при вращении тела вокруг неподвижной оси.
- •Моменты инерции некоторых тел. Свободные оси.
- •Теорема Штейнера.
- •Основные представления молекулярно-кинетической теории. Масса и размеры молекул. Понятие о статистическом методе.
- •Опытные газовые законы. Уравнение Менделеева-Клапейрона.
- •Основное уравнение молекулярно-кинетической теории газ зов и его следствия.
- •Внутренняя энергия газа. Число степеней свободы молекулы.
- •Первое начало термодинамики. Применение первого начала термодинамики к изопроцессам. Уравнение Майера.
- •Теплоемкость идеального газа. Физический смысл универсальной газовой постоянной.
- •Круговые процессы (циклы). Тепловые и холодильные машины. К.П.Д. Тепловой машины.
- •Цикл Карно. К.П.Д. Идеальной тепловой машины.
- •Энтропия. Второе начало термодинамики.
- •Свойства электрического заряда. Закон Кулона. Закон сохранения электрического заряда. Работа по перемещению заряда в электростатическом поле.
- •Электрическое поле. Напряженность
- •Теорема Остроградского-Гаусса для поля в вакууме.
- •Примеры применения теоремы Остроградского Гаусса.
- •Потенциал электростатического поля.
- •Электрическое поле в веществе. Типы диэлектриков.
- •Теорема Остроградского-Гаусса для поля в диэлектрике. Электрическое смещение.
- •Проводники в электрическом поле.
- •Электроемкость уединенного проводника. Конденсаторы.
- •Энергия заряженного проводника, конденсатора.
- •Энергия электростатического поля.
- •Электрический ток, его характеристики и условия существования.
- •Скорость хаотического движения электронов в металле.
- •Классическая электронная теория электропроводности металлов.
Первое начало термодинамики. Применение первого начала термодинамики к изопроцессам. Уравнение Майера.
Первое начало термодинамики — один из трёх основных законов термодинамики, представляет собой закон сохранения энергии длятермодинамических систем.
Первое начало термодинамики было сформулировано в середине XIX века в результате работ немецкого учёного Ю. Р. Майера, английского физика Дж. П. Джоуля и немецкого физика Г. Гельмгольца[1]. Согласно первому началу термодинамики, термодинамическая система может совершать работу только за счёт своей внутренней энергии или каких-либо внешних источников энергии. Первое начало термодинамики часто формулируют как невозможность существования вечного двигателя первого рода, который совершал бы работу, не черпая энергию из какого-либо источника.
Рассмотрим несколько частных случаев:
Если δQ > 0, то это означает, что тепло к системе подводится.
Если δQ < 0, аналогично — тепло отводится.
Если δQ = 0, то система не обменивается теплом с окружающей средой и называется адиабатически изолированной.
Обобщая:
в конечном процессе ![]() элементарные
количества теплоты могут быть любого
знака. Общее количество теплоты, которое
мы назвали просто Q — это
алгебраическая сумма количеств теплоты,
сообщаемых на всех участках этого
процесса. В ходе процесса теплота может
поступать в систему или уходить из неё
разными способами.
элементарные
количества теплоты могут быть любого
знака. Общее количество теплоты, которое
мы назвали просто Q — это
алгебраическая сумма количеств теплоты,
сообщаемых на всех участках этого
процесса. В ходе процесса теплота может
поступать в систему или уходить из неё
разными способами.
При отсутствии работы над системой и потоков энергии-вещества, когда δA' = 0, δQ = 0, dN = 0, выполнение системой работы δA приводит к тому, что ΔU < 0, и энергия системы U убывает. Поскольку запас внутренней энергии U ограничен, то процесс, в котором система бесконечно долгое время выполняет работу без подвода энергии извне, невозможен, что запрещает существование вечных двигателей первого рода.
Первое начало термодинамики:при изобарном процессе
![]() при
изохорном процессе (A = 0)
при
изохорном процессе (A = 0)![]()
при
изотермическом процессе (ΔU = 0)![]()
Здесь
— масса газа,
— молярная
масса газа, ![]() — молярная
теплоёмкость при
постоянном объёме,
— молярная
теплоёмкость при
постоянном объёме, ![]() — давление, объём и температура газа
соответственно, причём последнее
равенство верно только для идеального
газа.
— давление, объём и температура газа
соответственно, причём последнее
равенство верно только для идеального
газа.
Cp = Cv + R Оно показывает, что расширение моля идеального газа при постоянном давлении и изменении его температуры на 1 Кельвин требует дополнительного, по сравнению с изобарическим расширением, количества теплоты, необходимого для совершения работы. Это значение равно универсальной газовой постоянной....;)
Теплоемкость идеального газа. Физический смысл универсальной газовой постоянной.
Теплоемкость идеального газа — это отношение тепла, сообщенного газу, к изменению температуры δТ, которое при этом произошло.
![]() Молярная
теплоемкость — теплоемкость 1 моля
идеального газа.
Молярная
теплоемкость — теплоемкость 1 моля
идеального газа.![]()
![]()
В уравнение состояния
идеального газа (уравнение Менделеева
— Клапейрона)![]() .
.
входит универсальная
газовая постоянная R. Она, как известно,
равна произведению двух других постоянных
— числа Авогадро NA и постоянной
Больцмана k:![]() .
.
Постоянные NA и k имеют ясный смысл: NA — это число молекул или атомов в единице количества вещества, то есть моле; k — постоянная, определяющая связь между температурой в Кельвинах и температурой в единицах энергии. Но определенные физический смысл (быть может, многим он покажется неожиданным) имеет и комбинация NA и k — постоянная R.
Представим себе, что 1 моль идеального газа находится в сосуде с подвижным поршнем и что подводом тепла к нему или отводом тепла от него его температуру изменяют на 1 кельвин. Благодаря тому, что сосуд закрыт подвижным поршнем, давление газа будет оставаться постоянным (нравным внешнему давлению).
Напишем уравнение
состояния газа до и после нагревания:до
нагревания ![]() ,после
нагревания
,после
нагревания ![]() ,
где ΔT = 1 К.
,
где ΔT = 1 К.
Вычтя первое
равенство из второго, мы получим![]() .
.
Левая часть этого равенства представляет собой работу, совершаемую силой давления газа (или внешней силой против силы давления), когда при постоянном давлении р объем газа увеличивается (или уменьшается) от V1 до V2. Следовательно, газовая постоянная R равна работе, которую совершает 1 моль идеального газа, расширяясь при нагревании на 1 К при постоянном давлении.
Разумеется, при изобарном охлаждении 1 моля газа на 1 К такую же работу совершает внешняя сила, действующая на поршень.
Процессы с газами. Работа газа при различных процессах.
А
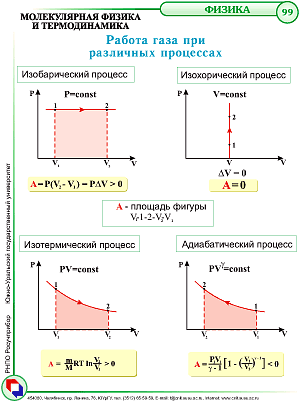 диабатический
процесс. Уравнение адиабаты.
диабатический
процесс. Уравнение адиабаты.
Адиабатический
процесс — термодинамический
процесс в
макроскопической системе, при котором
система не получает и не отдаёт тепловой
энергии.
![]() Серьёзное
исследование адиабатических процессов
началось с XVIII века[1].
Серьёзное
исследование адиабатических процессов
началось с XVIII века[1].
Основное уравнение термодинамики для адиабатического процесса
Для адиабатического процесса первое начало термодинамики в силу отсутствия теплообмена (ΔQ = 0) системы со средой имеет вид[4][5]
![]() ,где:
,где:![]() —
изменение внутренней
энергии тела,
—
изменение внутренней
энергии тела,![]() — работа,
совершаемая системой
— работа,
совершаемая системой
![]() —
теплота,
полученная системой
—
теплота,
полученная системой
Основное
уравнение термодинамики применительно
к адиабатическому процессу записывается
в дифференциалах как![]() ,
,
где ![]() —
дифференциальное выражение для
работы, ai — внешние параметры, Ai —
соответствующие им внутренние параметры.
—
дифференциальное выражение для
работы, ai — внешние параметры, Ai —
соответствующие им внутренние параметры.
Энтропия системы
в обратимом адиабатическом процессе
не меняется[6]:![]() .
.
