
- •4.Специфичность действия ферментов. В основе специфичности действия ферментов лежит конформационное соответствие его активного центра молекуле субстрата. Различают следующие виды специфичности:
- •2.На этапе пищеварения.
- •1 .На этапе поступления жиров с пищей:
- •2.На этапе пищеварения.
- •2. Репарация днк.
- •4. Элонгация (продолжение) протекает циклически в виде последовательной смены трёх фаз:
- •1. Углеводный обмен:
- •Витаминоподобные вещества.
- •1.Экскреторная функция - это выделение мочевины, мочевой кислоты, креатина, лекарств, токсинов, избытка воды, микроэлементов, электролитов. Состоит из трёх фаз:
- •2.Регуляторная и гомеостатическая.
2.На этапе пищеварения.
A. При поражении печени и кишечника нарушается образование и транспорт ЛП крови.
B. При поражении печени и желчевыводяицих путей нарушается образование и экскреция желчных кислот, участвующих в переваривании жиров пищи. В случае нарушения оттока желчи происходит насыщение её холестерином, что ведёт в этих условиях к застою и образованию холестериновых камней, центрами образования которых служат слущивающиеся клетки эпителия. Развивается ЖЕЛЧЕКАМЕННАЯ БОЛЕЗНЬ. В крови отмечается ГИПЕРХОЛЕСТЕРИНЕМИЯ.
C. Если поражается слизистая оболочка кишечника и нарушается выработка и поступление ферментов ПЖЖ, содержание жира в кале увеличивается. Если содержание жира будет превышать 50%, развивается СТЕАТОРЕЯ. Кал становится бесцветным.
D. Наиболее часто в последнее время среди населения встречается поражение бета -клеток ПЖЖ, что ведйт к развитию сахарного диабета, который сопровождается интенсивным окислением в клетках белков и жиров. В крови у таких больных отмечается ГИПЕРКЕТОНЕМИЯ, ГИПЕРХОЛЕСТЕРИНЕМИЯ. Кетоновые тела и холестерин синтезируются из АЦЕТИЛ-КОА.
3.На этапе обмена холестерина наиболее частым заболеванием является АТЕРОСКЛЕРОЗ, когда в клетках органов и тканей откладывается холестерин. Если холестерин откладывается в стенках сосудов, то происходит нарушение образования крови, следовательно, развиваются тромбозы, инфаркты.
Болезнь развивается тогда, когда между клетками тканей и ЛП крови растёт содержание АТЕРОГЕННЫХ ФРАКЦИЙ и понижается содержание ЛПВП, назначение которых удалять холестерин из клеток тканей в печень для последующего его окисления. Все ЛП за исключением ХИЛОМИКРОНОВ, которые содержат много белков и ФОСФОЛИПИДОВ быстро метаболизируются. ЛПНП задерживаются в сосудистой стенке. Они содержат много ТРИГЛИЦЕРИДОВ и ХОЛЕСТЕРИНА. Они, фагоцитируясь, разрушаются ферментами ЛИЗОСОМ, за исключением холестерина. Он накапливается в клетке в большом количестве. Клетки разрушаются и гибнут. Холестерин откладывается в межклеточном пространстве и инкапсулируется соединительной тканью. В сосудах образуются АТЕРОСКЛЕРОТИЧЕСКИЕ БЛЯШКИ. Способствуют развитию заболевания: повреждение сосудов токсинами при курении, алкоголизации, сахарном диабете (кетоновые тела), употребление обильной жирной пищи.
Лекция № 16. Обмен белков.
1. БЕЛКОВОЕ ПИТАНИЕ.
2. ПРЕВРАЩЕНИЕ БЕЛКОВ В ОРГАНАХ ПИЩЕВАРЕНИЯ.
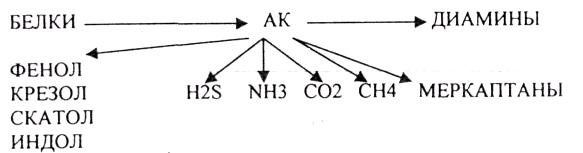
3. ГНИЕНИЕ БЕЛКОВ. ОБРАЗОВАНИЕ ТОКСИЧЕСКИХ ПРОДУКТОВ И МЕХАНИЗМ ИХ ОБЕЗВРЕЖИВАНИЯ.
В нашем организме идёт постоянный синтез и распад белков. Ежесуточно распадается 400гр. белка и столько же синтезируется. Из общей массы организма белка приходится 15кг. Синтез обновленного белка происходит из аминокислот, которые образуются при распаде.
Все АК можно разделить на 4 группы:
1 .Заменимые - синтезируются в организме: АЛА, АСП, АСН, ГЛУ, ГЛН, ГЛИ, ПРО, СЕР.
2.Незаменимые - не синтезируются в организме и поступают с пищей: ВАЛ, ЛЕЙ, ИЛЕ. ЛИЗ. ТРЕ, МЕТ, ФЕН, ТРИ.
3.Частично заменимые - синтезируются в организме, но очень медленно и не покрывают всех потребностей организма: ГИС, АРГ.
4.Условно заменимые - синтезируются из незаменимых аминокислот: ЦИС (МЕТ), ТИР (ФЕН). Полноценность белкового питания определяется:
1. Наличием всех незаменимых аминокислот. Отсутствие даже одной незаменимой аминокислоты нарушает биосинтез белка, т.е. каждая незаменимая АК может быть лимитирующей в процессе синтеза белка.
2. Аминокислотным составом белка. Все АК могут содержаться в продуктах как животного, так и растительного происхождения. Суточная потребность человека в белках составляет 100гр.
Пищевые белки подвергаются гидролитическому расщеплению под действием целой группы ферментов ПРОТЕОЛИТИЧЕСКИХ ФЕРМЕНТОВ (ПЕПТИДАЗЫ). Большинство этих ферментов вырабатывается в неактивной форме, т.е. в форме ПРОФЕРМЕНТОВ, а затем активируется путём ЧАСТИЧНОГО ПРОТЕОЛЗА. Это предохраняет стенки органов ЖКТ от само переваривания. Поверхность желудка и кишечника покрыта слизью, в составе которой содержаться ГЕТЕРОПОЛИСАХАРИДЫ. Они не подвергаются действию ферментов. Проферменты вырабатываются слизистой желудка или кишечника и поступают в полость этих органов, где происходит их активация. В пристеночном слое вырабатываются БИКАРБОНАТЫ, которые создают среду близкую к нейтральной (рН=5-6). В ротовой полости белки не подвергаются каким-либо химическим превращениям, т.к. здесь отсутствуют ферменты, действующие на белки. Здесь происходит лишь механическая переработка пищи. В желудке начинается химическое превращение белков. Здесь действуют два основных фермента: ПЕПСИН и ГАСТРИКСИН.
ПЕПСИН вырабатывается главными клетками слизистой желудка в неактивной форме -ПЕПСИНОГЕН, который под действием соляной кислоты активируется и превращается в пепсин. Процесс активации является АУТОКАТАЛИТИЧЕСКИМ. ПЕПСИНОГЕН активируется очень медленно, а пепсин потом становится активатором молекул ПЕПСИНОГЕНА. От ПЕПТИДНОЙ цепи неактивного ПЕПСИНОГЕНА со стороны N-конца отрывается один ПЕПТИД, содержащий 42 аминокислоты - активация путём ЧАСТИЧНОГО ПРОТЕОЛИЗА. Затем из остатка цепи формируется новая трёхмерная структура фермента - пепсина и новый активный центр. Соляная кислота вырабатывается обкладочными клетками слизистой желудка и играет очень важную роль в переваривании белков:
активирует ПЕПСИНОГЕН, превращая его в пепсин, создаёт оптимум рН для действия пепсина (1,5 - 2), обладает бактерицидным действием, денатурирует белки, которые потом гидролизуются. Внутренние ПЕПТИДНЫЕ связи становятся доступными для действия пепсина, способствует продвижению желудочного содержимого далее в кишечник. Пепсин - это фермент, который является ЭНДОПЕПТИДАЗОЙ, т.е. действует на внутренние ПЕПТИДНЫЕ связи, в образовании которых участвуют ароматические аминокислоты (ФЕН, ТИР, ТРИ) своими АМИДНЫМИ группами. ГАСТРИКСИН по действию аналогичен пепсину. Это тоже ЭНДОПЕПТИДАЗА. Его оптимум рН = 3 - 3,5. Действует на ПЕПТИДНЫЕ связи, в образовании которых участвуют ДИКАРБОНОВЫЕ аминокислоты (ГЛУ, АСП) своими КАРБОКСИЛЬНЫМИ группами. В желудке под действием ПЕПСИНА и ГАСТРИКСИНА сложные белковые молекулы распадаются на высокомолекулярные ПОЛИПЕПТИДЫ. Ими являются так называемые АЛЬБУМОЗЫ, ПЕПТОНЫ, которые поступают в тонкий кишечник.
В тонком кишечнике эти ПОЛИПЕПТИДЫ подвергаются действию целого ряда протеолитических ферментов ПЖЖ, которые вырабатываются в неактивной форме: ТРИПСИНОГЕН, ХИМОТРИПСИНОГЕН, ПРОЭЛАСТАЗА, ПРОКАРБОКСИПЕПТИДАЗА.
Механизм активации всех этих ферментов - ЧАСТИЧНЫЙ ПРОТЕОЛИЗ по каскадному механизму.
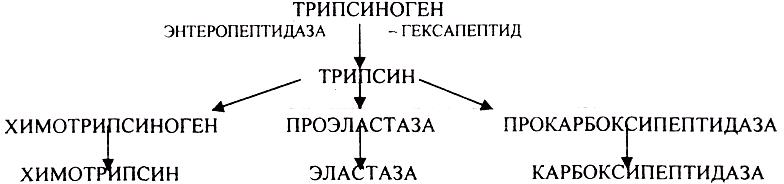
ТРИПСИН, ХИМОТРИПСИН, ЭЛАСТАЗА - ЭНДОПЕПТИДАЗЫ.
ТРИПСИН разрушает внутренние ПЕПТИДНЫЕ связи, в образовании которых принимают участие ЛИЗ и АРГ. ХИМОТРИПСИН разрушает внутренние связи, в образовании которых принимают участие ароматические аминокислоты (ТИР, ТРИ, ФЕН). ЭЛАСТАЗА разрушает внутренние ПЕПТИДНЫЕ связи, в образовании которых принимают участие АЛА, ГЛИ, ПРО, ЦИС. В результате действия ПЕПСИНА, ХИМОТРИПСИНА и ЭЛАСТАЗЫ высокомолекулярные ПЕПТИДЫ расщепляются до низкомолекулярных, которые подвергаются действию ЭКЗОПЕПТИДАЗ, действующих на крайние связи, отщепляя отдельные концевые аминокислоты. КАРБОКСИПЕПТИДАЗА разрушает крайние связи, отщепляя аминокислоты с С-конца. АМИНОПЕПТИДАЗА действует на крайние ПЕПТИДНЫЕ связи со стороны N-конца, отщепляя отдельные аминокислоты. ДИПЕПТИДЫ подвергаются действию ДИПЕПТИДАЗ, продуцирующихся слизистой кишечника сразу в активной форме. Т.о. в результате действия всей этой группы ферментов в ЖКТ белки пищи расщепляются до аминокислот. Образующиеся аминокислоты всасываются стенкой кишечника в кровь и поступают во все органы и ткани. Не всосавшиеся аминокислоты поступают в толстую кишку, где подвергаются процессам гниения. Это процесс бактериального распада веществ под действием микрофлоры или ферментов, вырабатывающихся этой микрофлорой. В норме в толстой кишке подвергаются аминокислоты, а при патологии - белки. Это происходит и в других отделах ЖКТ: в желудке (при понижении кислотности), ротовой полости (при кариесе).
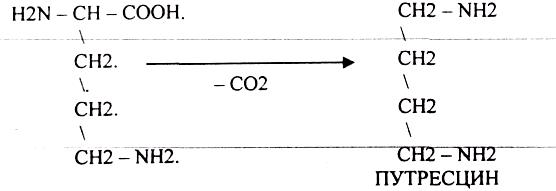
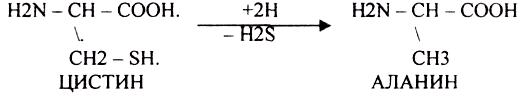
1.РЕАКЦИЯ ДЕКАРБОКСИЛИРОВАНАЯ.
А ОРНИТИН в состав белков не входит, но обязательно содержится в организме
В. ЛИЗИН

ПУТРЕСЦИН и КАДАВЕРИН являются токсическими веществами. Они входят в состав трупных
ядов.
2.ВОССТАНОВИТЕЛБНОЕ ДЕЗАМИНИРОВАНИЕ.
З.ДЕСУЛЬФИРОВАНИЕ - восстановительный процесс.
4.распад боковой цепи циклических аминокислот.
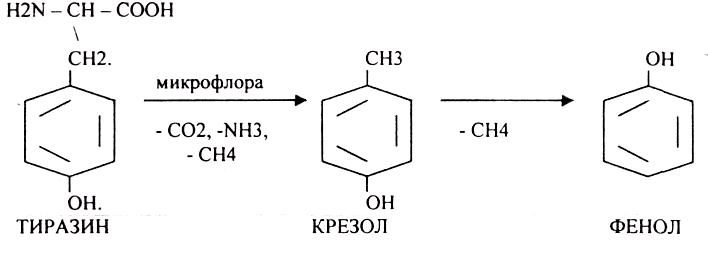
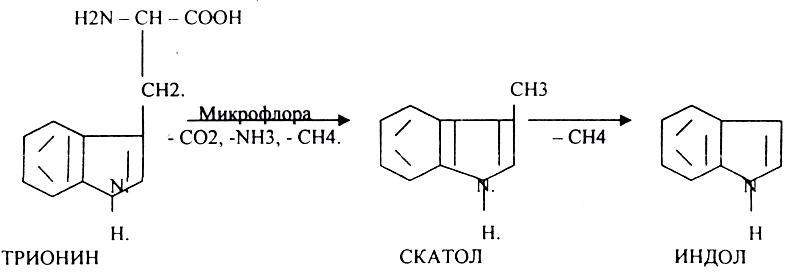
Все эти вещества токсические, образующиеся при гниении поступают в печень, где и происходит их обезвреживание. В печени имеется две системы, участвующие в обезвреживании этих веществ:
1. УДФГК - УРИДИНДИФОСФОГЛЮКУРОНОВАЯ К-ТА.
2. ФАФС - ФОСФОАДЕНОЗИНФОСФОСУЛЬФАТ.
Процесс обезвреживания - это процесс конъюгации токсических веществ с одной из этих систем и образование конъюгатов, которые являются уже нетоксическими веществами.
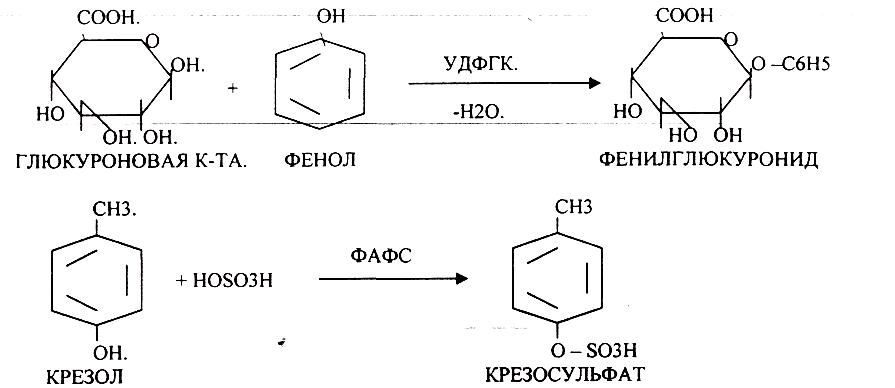
50.
Индол предварительно подвергается ГИДРОКСИЛИРОВАНИЮ.
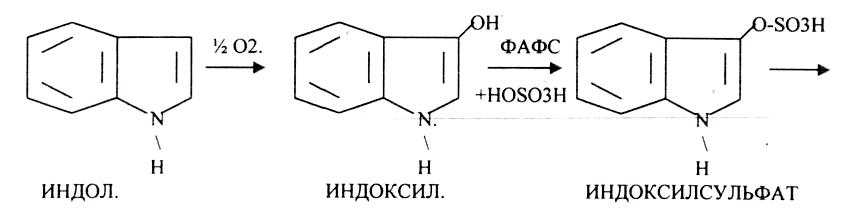
ИНДОКСИЛСУЛЬФАТ нейтрализуется и превращается в натриевую или калиевую соль.
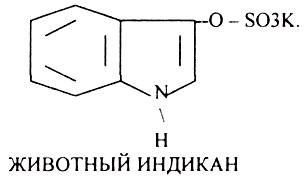
Все эти вещества выводятся из организма с мочой. В норме реакция на индол должна быть отрицательна. При положительной реакции на индол - нарушена детоксикационная функция печени. Положительная реакция на ИНДИКАН наблюдается при очень активном гниении белков в толстом кишечнике.
Лекция № 17.
Обмен белков (продолжение).
1. ИСТОЧНИКИ АМИНОКИСЛОТ В КЛЕТКЕ И ПУТИ ИХ ИСПОЛЬЗОВАНИЯ.
2. МЕТАБОЛИЗМ АМИНОКИСЛОТ.
3. ОБРАЗОВАНИЕ АММИАКА И ПУТИ ЕГО ОБЕЗВРЕЖИВАНИЯ. СИНТЕЗ МОЧЕВИНЫ.
Источниками аминокислот в клетке являются:
1. белки пищи после их гидролиза в органах пищеварения,
2. синтез заменимых аминокислот,
3. распад тканевых белков.
Тканевые белки подвергаются гидролитическому расщеплению при участии тканевых ПРОТЕАЗ - КАТЕПСИНОВ, которые в основном находятся в ЛИЗОСОМАХ, но могут быть и в МИТОХОНДРИЯХ и ЭПС.
Эти ферменты обладают специфичностью действия. Выделяют разные КАТЕПСИНЫ. которые отличаются оптимумом рН и специфичностью действия на ПЕПТИДНЫЕ связи. Распад тканевых белков необходим для обновления белков, а также для устранения дефектных молекул белка.
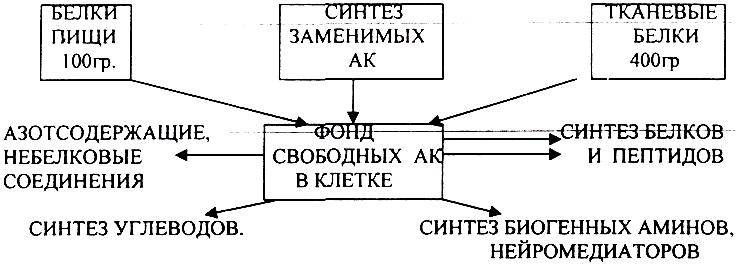
Часть аминокислот в тканях подвергается различным метаболическим превращениям.
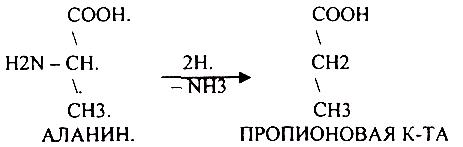
1. Основной путь превращения аминокислот в тканях - это реакции ПЕРЕАМИНИРОВАНИЯ -реакции между АМИНО- и КЕТОКИСЛОТАМИ, когда они обмениваются своими функциональными группами, при этом аминокислоты являются донорами аминогрупп, а кетокислоты - их акцепторами. Эти реакции катализирует фермент -
51.
АМИНОТРАНСФЕРАЗА. Она локализуется в МИТОХОНДРИЯХ и ЦИТОПЛАЗМЕ. ТРАНСАМИНИРОВАНИЮ могут подвергаться все аминокислоты кроме ЛИЗ и ТРЕ. В организме человека обнаружено 10 различных АМИНОТРАНСФЕРАЗ. Наибольшее значение имеют AT, донорами аминогрупп которых являются АЛА, АСП, ГЛУ. ГЛУТАМИНОВАЯ кислота является универсальным донором, а альфа -КГК - универсальным акцептором аминогрупп.
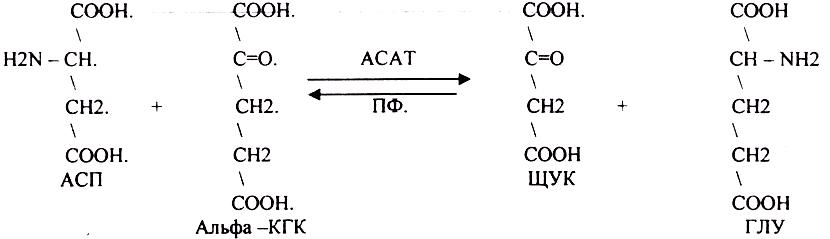
Роль реакций ТРАНСАМИНИРОВАНИЯ:
1. используются для синтеза заменимых аминокислот. При этом происходит перераспределение азота в органах и тканях.
2. Является начальным этапом катаболизма аминокислот
3. В результате ТРАНСАМИНИРОВАНИЯ образуются альфа -КЕТОКИСЛОТЫ, которые поступают в ЦТК и включаются в ГЛЮКОНЕОГЕНЕЗ.
4. Протекают в разных тканях, но более всего в печени. Определение активности AT имеет диагностическое значение в клинике. АСАТ наиболее активна в миокарде, следовательно, повышение в сыворотке крови АСАТ можно предположить патологию в сердечной мышце. АЛАТ (АЛАНИНОВАЯ AT) особенно активна в печени, следовательно, повышение её в сыворотке крови свидетельствует о деструктивных изменениях в печени. При избытке АЛАНИНА или недостатке АСПАРАГИНОВОЙ К-ТЫ:
1. АЛА + альфа-КГК ↔ ГЛУ + ПВК
2. ГЛУ + ЩУК ↔АСП + альфа-КГК
2.Реакции ДЕКАРБОКСИЛИРОВАНИЯ - разрушение СООН-группы с выделением СО2. При этом аминокислоты в тканях образуют биогенные амины, которые являются биологически активными веществами (БАВ). Среди них могут быть соединения, которые выполняют функции:
1. НЕЙРОМЕДИАТОРОВ (СЕРЕТОНИН, ДОФАМИН, ГАМК),
2. Гормоны (АДРЕНАЛИН, НОРАДРЕНАЛИН),
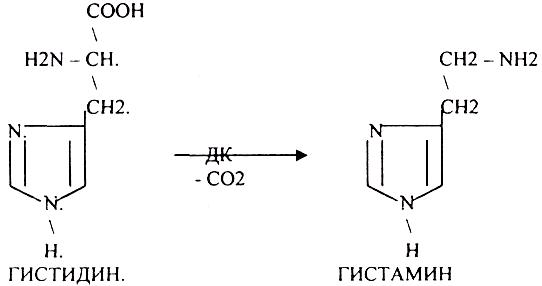
3. Регуляторы местного действия ( ГИСТАМИН).
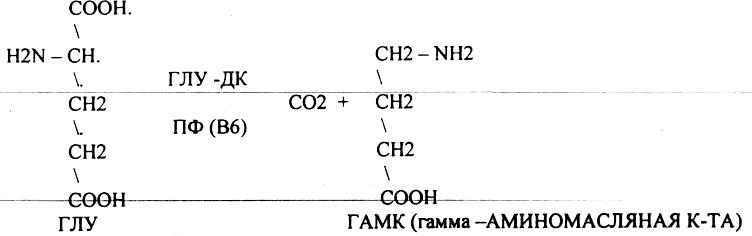
ГАМК является НЕИРОМЕДИАТОРОМ тормозного действия, поэтому препараты на основе ГАМК используются в клинике для лечения некоторых заболеваний ЦНС. Эта реакция используется в педиатрической практике: детям при сильном возбуждении используют раствор витамина В6, который стимулирует процесс образования ГАМК. ДОФАМИН является НЕИРОМЕДИАТОРОМ возбуждающего действия. Он является основой для синтеза АДРЕНАЛИНА и НОР АДРЕНАЛИНА.
52.
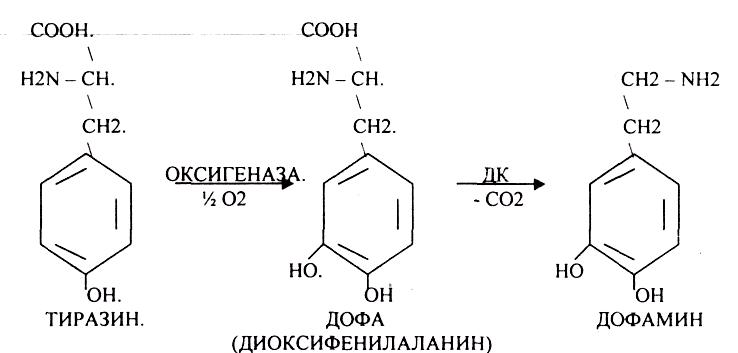
ГИСТАМИН повышает секрецию желудочного сока, поэтому применяется в клинической практике при зондировании. Обладает сосудорасширяющим действием, понижает АД.
3.Реакции ДЕЗАМИНИРОВАНИЯ - разрушение NН2-группы с выделением аммиака. В организме возможны следующие виды ДЕЗАМИНИРОВАНИЯ.
1. Восстановительное
2.ГИДРОЛИТиЧЕСКОЕ:
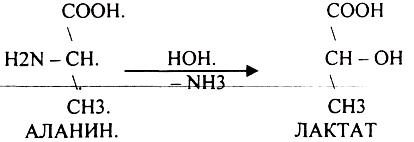
3. Внутримолекулярное:
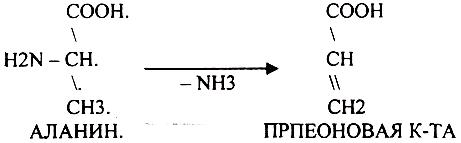
Эти три вида ДЕЗАМИНИРОВАНИЯ имеют место при гниении, т.е. идут в толстой кишке.
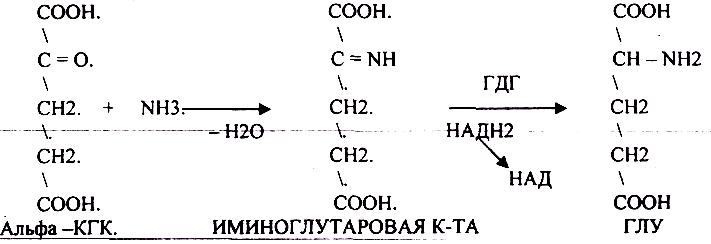
4. Окислительное. Протекает в клетке. Непосредственно, ОКИСЛИТЕЛЬНОМУ ДЕЗАМИНИРОВАНИЮ подвергается только ГЛУ. 53.

ОКИСЛИТЕЛЬНОМУ ДЕЗАМИНИРОВАНИЮ подвергаются и другие аминокислоты, но этот путь является непрямым. Он идёт через ГЛУ и называется процессом НЕПРЯМОГО ОКИСЛИТЕЛЬНОГО ДЕЗАМИНИРОВАНИЯ. Аммиак образуется из аминокислот при распаде других азотсодержащих соединений (биогенных аминов, НУКЛЕОТИДОВ). Значительная часть аммиака образуется в толстой кишке при гниении. Он всасывается в кровь системы воротной вены, здесь концентрация аммиака больше, чем в общем кровотоке.
Аммиак образуется в различных тканях. Концентрация его в крови незначительна, т.к. он является токсичным веществом (0,4 - 0,7мг/л). Особенно выраженное токсическое действие он оказывает на нервные клетки, поэтому значительное его повышение приводит к серьёзным нарушениям обменных процессов в нервной ткани.
ПУТИ ОБЕЗВРЕЖИВАНИЯ АММИАКА.
1. образование АМИДОВ
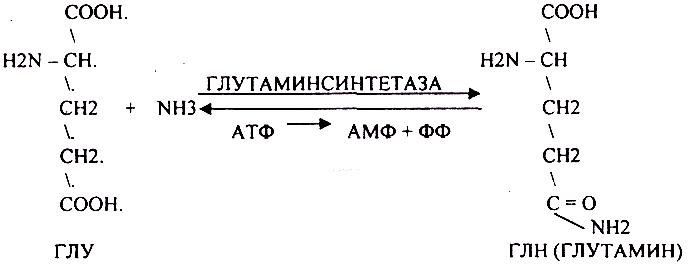
ГЛУТАМИН и АСПАРАГИН - нетоксические вещества. Их называют транспортной формой аммиака в организме. Они не проникают через мембраны и в почках распадаются до аминокислот и аммиака.
2. Восстановительное АМИНИРОВАНИЕ.
3. Образование солей АММОНИЯ.
![]()
4. Синтез мочевины - основной путь обезвреживания аммиака - ОРНИТИНОВЫЙ ЦИКЛ.
КАРБОМОИЛФОСФАТ
![]()
54.
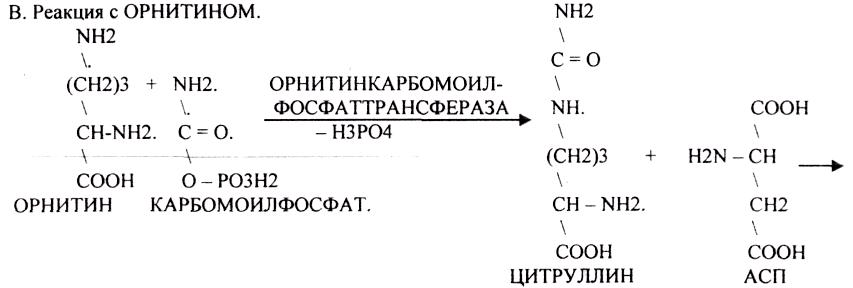
АРГИНАЗА обладает абсолютной специфичностью и содержится только в печени. В составе
мочевины содержится два атома азота: один поступает из аммиака, а другой выводится из АСП.
Образование мочевины идёт только в печени.
Две первые реакции цикла (образование ЦИТРУЛЛИНА и АРГИНИНОСУКЦИНАТА) идут в
МИТОХОНДРИЯХ, остальные в цитоплазме.
В организме в сутки образуется 25гр мочевины. Этот показатель характеризует мочевино-
образующую функцию печени. Мочевина из печени поступает в почки, где и выводится из
организма, как конечный продукт азотистого обмена.
Лекция № 18.
Распад НУКЛЕОПРОТЕИНОВ. Нарушение обмена белков.
1.ОСОБЕННОСТИ МЕТАБОЛИЗМА НУКЛЕОПРОТЕИНОВ.
2.ОБРАЗОВАНИЕ МОЧЕВОЙ КИСЛОТЫ. 3.ОБРАЗОВАНИЕ КРЕАТИНИНА. 4.НАРУШЕНИЕ ОБМЕНА БЕЛКОВ.
ОСОБЕННОСТИ МЕТАБОЛИЗМА НУКЛЕОТИДОВ.
1. НУКЛЕОТИДЫ и АЗОТИСТЫЕ ОСНОВАНИЯ (АО), поступающие с пищей, не включаются в НУКЛЕОТИДЫ и НУКЛЕИНОВЫЕ К-ТЫ организма.
55.
2. Клетки организма человека синтезируют предшественники НУКЛЕОТИДОВ. Исходя из этого, доказательств опасности употребления в пищу генно-инженерных продуктов в настоящий момент нет.
3. Помимо синтеза включаются механизмы реутилизации ПУРИНОВЫХ и ПИРИМИДИНОВЫХ оснований, образующихся при деградации нуклеиновых кислот.
4. Можно использовать аналоги ПУРИНОВ и ПИРИМИДИНОВ как антиканцерогенные вещества путём включения их в ДНК и РНК.
БИОСИНТЕЗ ПУРИНОВЫХ ОСНОВАНИЙ. Для биосинтеза ПУРИНОВЫХ оснований доносами атомов и атомных групп являются:
Для биосинтеза ПИРИМИДИНОВЫХ оснований донорами атомов и атомных групп являются АСП, ГЛУ, производные ФОЛИЕВОЙ кислоты. Распад НП происходит одинаково и в тканях, и в ЖКТ.

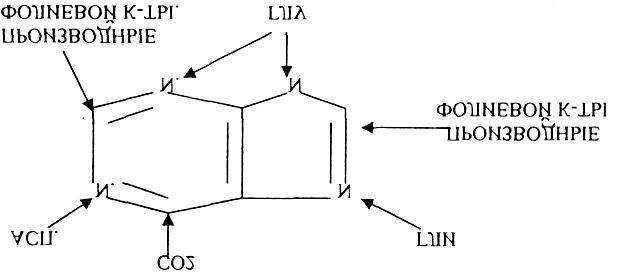
Окисление мочевой кислоты - окисление ПУРИНОВЫХ НУКЛЕОЗИДОВ.
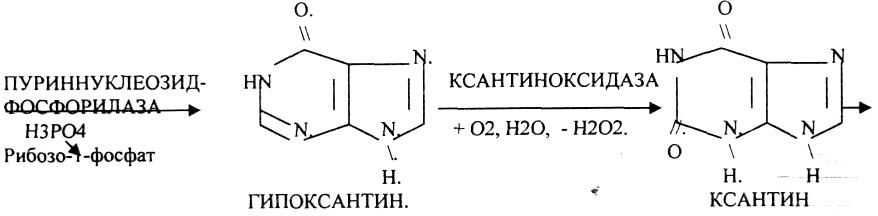
56.
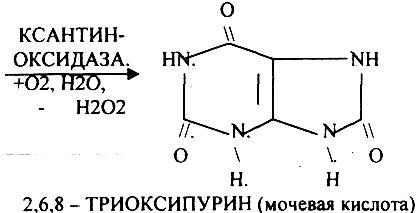
Мочевая кислота является конечным продуктом распада ПУРИНОВЫХ НУКЛ.
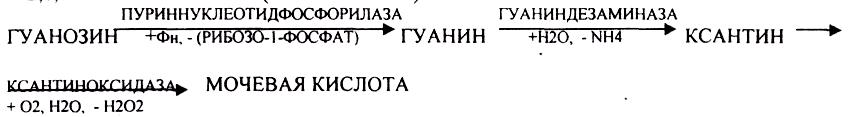
Уровень мочевой кислоты будет свидетельствовать об интенсивности распада ПУРИНОВЫХ оснований тканей организма и пищи. При распаде ПИРИМИДИНОВЫХ оснований из них образуется:
l.B-аланин СО2 NH3 МОЧЕВИНА


2.бета -АМИНОИЗОБУТИРАТ.
НАРУШЕНИЕ ОБМЕНА НУКЛЕОТИДОВ.
ГИПЕРУРИКЕМИЯ - повышение уровня мочевой кислоты в крови указывает на повышенный распад нуклеиновых кислот или пуриновых нуклеотидов. Мочевая кислота плохо растворима и выпадает в кристаллы в кислой среде. Развивается подагра, артриты, инициируется развитие МКБ (моче каменной болезни). В этих случаях рекомендуется содовое питьё. Образуются УРАТЫ натрия, которые являются растворимыми и легко выводятся из организма.
ОБРАЗОВАНИЕ КРЕАТИНИНА.
КРЕАТИНИН образуется из креатина, который в свою очередь синтезируется в печени из аминокислот, затем транспортируется в мышечную ткань, где взаимодействует с АТФ.
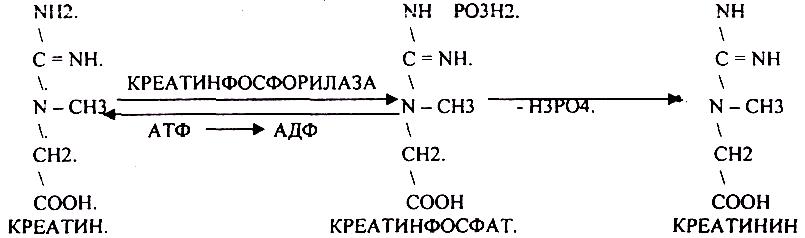
КРЕАТИНИН является конечным продуктом распада креатина. Он поступает в кровь и выделяется с мочой. КРЕАТИНИН не подвергается обратному всасыванию и является показателем фильтрационной способности почек. При её нарушении уровень КРЕАТИНИНА в моче будет понижаться, а в крови - повышаться,._
ОСТАТОЧНЫЙ АЗОТ - это содержание в крови азота всех азотсодержащих соединений, остающихся после осаждения белков. Его содержание колеблется 14 - 28ммоль/л. К остаточному азоту относится:
1.Азот промежуточных продуктов (ПЕПТИДЫ, АО, АК, КРЕАТИН, ИНДОЛ, СКАТОЛ и т.д.)
2.Азот конечных продуктов (МОЧЕВИНА, МОЧЕВАЯ К-ТА, ИНДИКАН, КРЕАТИНИН)—
ГИПЕРАЗОТЕМИЯ - повышение содержания в крови остаточного азота. Она может быть:
1.продукционная - повышение образования компонентов остаточного азота, главным образом
вследствие распада белков.
2.ретенционная - задержка азотистых шлаков из-за нарушения выделительной функции почек.
В клинике чаще встречается РЕТЕНЦИОННАЯ ГИПЕРАЗОТЕМИЯ.
Азотистый баланс - это разность азота, поступившего с пищей, и азота, выделяющегося с мочой. В физиологическом состоянии у здорового человека с пищей поступает 16гр азота и выделяется столько же. Азотистый баланс равен 0. Это называется азотистым равновесием.
57.
Положительный азотистый баланс связан с преобладанием процессов синтеза над процессами
распада. Азот задерживается в организме. Характерно для растущего организма или росте
опухолей. Отрицательный азотистый баланс указывает на преобладание процессов распада над процессами
синтеза. Может наблюдаться в пожилом и старческом возрасте у здоровых людей. В патологии
может быть при ожоговой болезни, деструкции опухоли.
ПАТОЛОГИЯ БЕЛКОВОГО ОБМЕНА.
1. Нарушение на этапе поступления белков. В норме в организм должно поступать 80 - ЮОгр белков. Обязательно поступление всех незаменимых АК.
Клинические проявления при недостатке определённых АК:
Лизин -тошнота, глаукома, повышение чувствительности к шуму: ГИС - понижение гемоглобина; МЕТ - жировая инфильтрация печени и почек.
При общем белковом голодании развивается белковая недостаточность, которая проявляется понижением уровня белка в сыворотке крови, ГИПОПРОТЕИН- и ГИПОГЛОБУЛИНЕМИЕЙ. Понижается онкотическое давление, и вода устремляется в ткани (развиваются отёки).
2. Нарушение на этапе пищеварения:
A) в желудке: ГИПОАЦИДОЗ, следовательно, пепсин неактивен и нарушается распад белков;
АХЛОРГИДРИЯ, следовательно, белки не расщепляются в желудке, подвергаются гниению.
B) в тонком кишечнике:
Связан с поражением ПЖЖ (панкреатиты), следовательно, недостаточность выработки трипсина и других гидролитических ферментов.
C) в толстой кишке:
Запоры, непроходимость, следовательно, усиление процессов гниения.
3. Нарушение МЕЖУТОЧНОГО обмена - нарушение обмена аминокислот в тканях.
A) Приобретенные - часто связаны с отсутствием витаминов (г.о. В6), следовательно, нарушение процессов ПЕРЕАМИНИРОВАНИЯ, ДЕЗАМИНИРОВАНИЯ. Это приводит к ГИПЕРАЦИДОАМИНЕМИИ, АМИНОАЦИДУРИИ.
B) Наследственные. Чаще всего встречаются нарушения обмена ФЕНИЛАЛАНИНА. В норме ФЕН трансформируется в ТИР.
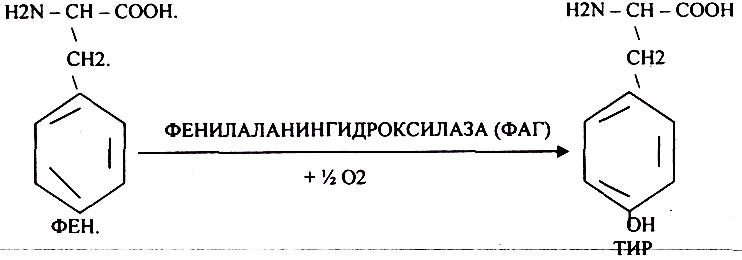
Отсутствие ФАГ приводит к так называемому метаболическому блоку.
![]()
Эти соединения накапливаются в тканях, повышаются в крови, появляются в моче -
ФЕНИЛКЕТОНУРИЯ (ФКУ). Они токсичны, особенно для тканей мозга. Ребёнок отстаёт в умственном развитии ФЕНИЛПИРОВИНОГРАДНАЯ ОЛИГОФРЕНИЯ. Назначается специальная диета, исключающая ФЕНИЛАЛАНИН.
При нарушении метаболизма ТИРОЗИНА не синтезируется МЕЛАНИН, следовательно, нарушается пигментация кожи, радужки. Моча окрашивается в бурый цвет, а затем в чёрный - АЛКАПТОНУРИЯ.
Нарушение на стадии ОРНИТИНОВОГО ЦИКЛА, следовательно накопление промежуточных продуктов (ЦИТРУЛИНА, АРГИНИНСУКЦИНАТА) ЦИТРУЛЛИНУРИЯ, АРГИНИНСУКЦИНАТНОЕ СЛАБОУМИЕ.
Нарушение на уровне выведения конечных продуктов. ЦИСТИНОЗ - нарушение РЕАБСОРБЦИИ АК и повышение их экскреции в 5 -10 раз (ЦИСТИН, ЦИСТЕИН).
58.
Лекция № 19. Матричный биосинтез.
РЕПЛИКАЦИЯ, И ЕЁ ЭТАПЫ.
РЕПАРАЦИЯ ДНК.
ТРАНСКРИПЦИЯ ГЕНА. СОВРЕМЕННЫЕ ПРЕДСТАВЛЕНИЯ О ГЕНЕ.
СОВРЕМЕННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ ДНК.
Генетическая догма: информация записана в ДНК и передаётся на дочерние молекулы ДНК
из поколения в поколение с помощью процесса репликации. ДНК РНК белок
РЕПЛИКАЦИЯ - процесс самоудвоения ДНК. Этот процесс стал полностью изучен только после того, как УОТСОН и КРИК предложили структуру ДНК в виде двойной спирали, полинуклеотидные цепи которой связаны комплиментарными, азотистыми основаниями (А:::Т, Г:::Ц). Если азотистые основания комплиментарны друг другу, то и полинуклеотидные цепи тоже комплиментарны. В основе механизма репликации лежит принцип комплиментарности. К механизму репликации относится матричный биосинтез. Репликация ДНК идёт полуконсервативным способом: на каждой материнской полинуклеотидной цепи синтезируется дочерняя цепь.
Условия необходимые для репликации:
1. Матрица - нити ДНК. Расщепление нити называется РЕПЛИКАТИВНАЯ ВИЛКА. Она
может образовываться внутри молекулы ДНК. Они движутся в разных направлениях,
образуя РЕПЛИКАТИВНЫЙ ГЛАЗОК. Таких глазков в молекуле ДНК ЭУКАРИОТ
несколько, каждый имеет две вилки
![]()
2. Субстрат. Пластическим материалом являются ДЕЗОКСИНУКЛЕОТИДТРИФОСФАТЫ: дАТФ, дГТФ, дЦТФ, дТТФ. Затем происходит их распад до ДЕЗОКСИНУКЛЕОТИДМОНОФОСФАТОВ, двух молекул фосфата неорганического с выделением энергии, т.е. они одновременно являются источником и энергии, и пластического материала.
Д-АТФ Д-АМФ + ФФ + Е.
3. Ионы магния.
Репликативный комплекс ферментов:
A) ДНК -раскручивающие белки:
1. DNA-A (вызывает расхождение нитей)
2. ХЕЛИКАЗЫ (расщепляют цепь ДНК)
3. ТОПОИЗОМЕРАЗЫ 1 и 2 (раскручивают сверх спирали). Разрывают (3',5') -
фосфодиэфирные связи. ТОПОИЗОМЕРАЗА 2 у ПРОКАРИОТ называется ГИРАЗА.
B) Белки, препятствующие соединению нитей ДНК (SSB -белки)
C) ДНК-ПОЛИМЕРАЗА (катализирует образование фосфодиэфирных связей). ДНК- ПОЛИМЕРАЗА только удлиняет уже существующую нить, но не может соединить два свободных НУКЛЕОТИДА.
D) ПРАЙМАЗА (катализирует образование «затравки» к синтезу). Это по своей структуре РНК-ПОЛИМЕРАЗА, которая соединяет одиночные НУКЛЕОТИДЫ.
Е)ДНК-ЛИГАЗА.
5. ПРАЙМЕРЫ - «затравка» для репликации. Это короткий фрагмент, состоящий из РИБОНУКЛЕОТИДТРИФОСФАТОВ (2 - 10). Образование ПРАИМЕРОВ катализируется ПРАЙМАЗОЙ.
Основные этапы репликации.
1.ИНИЦИАЦИЯ репликации.
Происходит под влиянием внешних стимулов (факторов роста). Белки соединяются с рецепторами на плазматической мембране и вызывают репликацию в синтетическую фазу клеточного цикла. Смысл инициации заключается в присоединении в точку репликации DNA-A, стимулирующего расхождение двойной спирали. В этом принимает участие и ХЕЛИКАЗА. Действуют ферменты (ТОПОИЗОМЕРАЗЫ), вызывающие раскручивание сверх спирали. SSB-белки препятствуют соединению дочерних цепей.
Образуется РЕПЛИКАТИВНАЯ ВИЛКА.
Образование дочерних нитей.
Этому предшествует образование ПРАИМЕРОВ с помощью фермента ПРАЙМАЗЫ. Действует ДНК-ПОЛИМЕРАЗА и образуется дочерняя нить ДНК. Этот процесс происходит в соответствии с принципом комплиментарности, и синтез идёт от 5' к 3' концу синтезируемой нити.
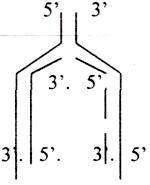
На одной из материнских нитей будет строиться непрерывная цепь, а на противоположной нити - цепь из коротких фрагментов (фрагментов ОКАЗАКИ) Удаление ПРАИМЕРОВ с помощью ЭКЗОНУКЛЕАЗЫ.
Соединение коротких фрагментов с помощью ДНК-ЛИГАЗЫ.
Дочерние нити КОМПЛИМЕНТАРНЫ материнским. Дочерние молекулы ДНК являются копией материнской ДНК. Значение репликации: воспроизведение генотипа в поколениях.
