
- •4.Специфичность действия ферментов. В основе специфичности действия ферментов лежит конформационное соответствие его активного центра молекуле субстрата. Различают следующие виды специфичности:
- •2.На этапе пищеварения.
- •1 .На этапе поступления жиров с пищей:
- •2.На этапе пищеварения.
- •2. Репарация днк.
- •4. Элонгация (продолжение) протекает циклически в виде последовательной смены трёх фаз:
- •1. Углеводный обмен:
- •Витаминоподобные вещества.
- •1.Экскреторная функция - это выделение мочевины, мочевой кислоты, креатина, лекарств, токсинов, избытка воды, микроэлементов, электролитов. Состоит из трёх фаз:
- •2.Регуляторная и гомеостатическая.
0Лекция № 1.
Биохимия, её задачи. Структурная организация белков.
1 .Предмет биохимии.
2.Задачи биохимии.
3.Значение биохимии для медицины.
4.Белки,их биологическая роль.
5.Структурная организация белков.
Биохимия относится к фундаментальным дисциплинам медицины и биологии. В результате научного познания мира выделился ряд фундаментальных дисциплин: философия, физика, химия, биология и д.р. Биохимия выделилась с одной стороны в результате разделения наук. Ей не доставало точности, т.к. длительно она была описательной наукой. Середина 20 в. ознаменовалась глобальными открытиями в физике. В это же время интеграция биологии с точными науками способствовала её бурному развитию. Биохимия возникла как наука, благодаря привлечению в биологию точных знаний, в частности химии.
Биохимия—наука о структуре веществ, входящих в состав живого организма, их превращениях и физико-химических процессах, лежащих в основе жизнедеятельности.
Выделяют три составных компонента общей биохимии:
1.Статическая биохимия (изучает структуру веществ ) - биоорганическая химия.
2.Динамическая биохимия (изучает превращение веществ в организме).
3.Функциональная биохимия ( изучает процессы, лежащие в основе функций органов и тканей). Кроме общей (базисной) биохимии выделяют ещё ряд разделов биохимии, в зависимости от направления проводящихся исследований:
1.Биохимия растений.
2.Биохимия микроорганизмов.
3.Биохимия животных.
4.Медицинская биохимия.
5.Ветеринарская биохимия.
6.Техническая биохимия.
7.Биохимия генетики.
8.Молекулярная биохимия.
Задачи биохимии.
1.Изучение процессов БИОКАТАЛИЗА.
2.Изучение механизмов наследственности на молекулярном уровне.
3.Изучение строения и обмена нуклеиновых кислот.
4.Изучение строения и обмена белков.
5.Изучение превращения углеводов.
6.Изучение обмена жиров.
7.Изучение биологической роли сигнальных молекул (ГОРМОНЫ, НЕЙРОМЕДИАТОРЫ).
8.Изучение роли витаминов в обмене веществ.
9.Изучение роли минеральных веществ.
Значение биохимии для медицины.
Основные вопросы медицины: патогенез, диагностика, лечение и профилактика заболеваний.
1.Значение биохимии для понимания механизма заболевания.
ПРИМЕР. В норме, ГЕМОГЛОБИН-А располагается в эритроцитах равномерно, занимая весь объём клетки. При смене 1 АК ГЛУТАМИНА на ВАЛИН образуется ГЕМОГЛОБИН-S, плохо растворимый и выпадающий в эритроцитах в осадок. Сущность этого заболевания раскрыл Л. ПОЛЛИНГ. Только биохимические исследования позволяют диагностировать это заболевание и раскрыть механизм развития вследствие недостатка гормона инсулина. Сердечно-сосудистые заболевания (атеросклероз). Раньше считали, что важную роль в патогенезе принадлежит накоплению ЛИПОПРОТЕИНОВ низкой плотности и нарушение соотношения между ЛИПОПРОТЕИНАМИ низкой плотности и ЛИПОПРОТЕИНАМИ высокой плотности. В настоящее время предполагают, что важным является чувствительность рецепторов клеток к ЛИПОПРОТЕИНАМ низкой плотности.
2.Значение биохимии для диагностики заболеваний.
Широкое использование биохимических исследований биологических жидкостей.
A. Количество субстратов.
Б. Исследование активности ферментов.
B. Исследование уровня гормонов. Методы РИА, ИФА, ИХЛА, ДНК-зонды.
Важным моментом в настоящее время является выявление ПРЕДЗАБОЛЕВАНИЙ.
3. Значение биохимии для лечения. Выявление нарушенных звеньев метаболизма и создание соответствующих лекарственных препаратов, широкое использование природных препаратов.
4.Значение биохимии для профилактики заболеваний.
ПРИМЕР. Недостаток витамина С —цинга—для профилактики использование витамина С (профилактика простудных заболеваний).
Недостаток витамина D— рахит— использование витамина D.
БЕЛКИ, ИХ БИОЛОГИЧЕСКАЯ РОЛЬ.
Белки - это высокомолекулярные азотсодержащие органические вещества, состоящие из АК. соединённых ПЕПТИДНЫМИ связями в ПОЛИПЕПТИДНУЮ цепь, и имеющие сложную структурную организацию.
Характерные признаки белков, отличающие их от других соединений:
1 .Белки - АЗОТСОДЕРЖАЩИЕ вещества (до 16 %).
2.Структурной единицей белков являются альфа АК L-РЯДА.
![]()
3-.АК связываются ПЕПТИДНЫМИ связями в ПОЛИПЕПТИДНУЮ цепь.
4.Большая молекулярная масса белков (от 20000 до нескольких миллионов дальтон).
5.Сложная структурная организация.
ФУНКЦИИ БЕЛКОВ.
1.Каталитическая. Многие белки являются ферментами
2.Регуляторная. Некоторые гормоны являются белками
3.Структурная. Во все структуры живой клетки входят белки.
4.Рецепторная. Белки являются обязательным компонентом рецепторов, способны узнавать другие молекулы.
5.Транпортная. Транспорт жиров, лекарственных веществ и д.р.
6.Опорная. Коллаген, белки костной ткани.
7.Энергетическая. Окисление 1 грамма белка сопровождается выделением 17 КДЖ энергии. В сутки 15% энергии образуется за счёт распада Б.
8.Сократительная. Актин, миозин мышц.
9.Генно-регуляторная (ГИСТОНЫ).
10.Иммунологическая. Антитела являются белками.
11 .Гемостатическая. Фибриноген.
СТРУКТУРНАЯ ОРГАНИЗАЦИЯ БЕЛКОВ. Свойства белков обусловлены их структурой.
ПЕРВИЧНАЯ СТРУКТУРА - последовательное соединение АК в ПОЛИПЕПТИДНОЙ цепи с помощью ПЕПТИДНЫХ связей.
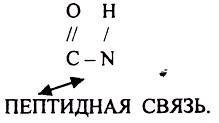
Свойства ПОЛИПЕПТИДНОЙ цепи зависят от составляющих её АК.
Порядок АК в цепи устанавливается с помощью СЕКВЕНИРОВАНИЯ - процедура выявления последовательности АК. Впервые было проведено в 1958 г. Ф. СЕНДЖЕРОМ на инсулине.
ВТОРИЧНАЯ СТРУКТУРА - способ укладки в пространстве ПОЛИПЕПТИДНОЙ цепи. Образуется за счет водородных связей между 1 и 4 АК.
![]()
Выделяют 3 вида вторичной структуры:
1 .Альфа спираль ( Л.ПОЛЛИНГ) - виток составляет от 3 до 6 АК. Терминатором спирали является АК-ПРОЛИН.
2.Бетта складчатый слой.
3.Петли ПОЛИПЕПТИДНОЙ цепи (соединительные петли).
ТРЕТИЧНАЯ СТРУКТУРА - укладка вторичной структуры более компактно, в виде ГЛОБУЛЫ или ФИБРИЛЛЫ. Осуществляется за счёт водородных, ионных, ДИСУЛЬФИДНЫХ и гидрофобных связей.
Домены - это фрагменты ПОЛИПЕПТИДНОЙ цепи, сходные по свойствам с самостоятельными глобулярными белками. Домен автономен. Домены возникают в результате слияния нескольких генов отдельных белков.
ЧЕТВЕРТИЧНАЯ СТРУКТУРА - объединение нескольких доменов. П. Гемоглобин-4 СУБЪЕДИНИЦЫ.
ЛЕКЦИЯ № 2.
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА БЕЛКОВ. КЛАССИФИКАЦИЯ БЕЛКОВ.
1.Физико-химические свойства белков. Их использование для разделения белков.
2.Принципы классификации белков.
3.Характеристика простых белков.
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА БЕЛКОВ.
1.Молекулярная масса белков определяет многие свойства белков: седиментация, диффузия, плотность белковых растворов, коллоидные свойства белков и др. характеристики.
Молекулярная масса: инсулин (5700)
МИОГЛОБИН (17000)
ПЕПСИН (35000)
ГЕМОГЛОБИН (65000).
Молекулярную массу белка можно определить по скорости седиментации (осаждения) при УЛЬТРАЦЕНТРИФУГИРОВАНИИ, т.е. при ускорении 100000-500000 дальтон. На основании этого определяют коэффициент седиментации, который обозначают S ( в честь СВЕДБЕРГА). Он предложил за единицу коэффициента седиментации величину 10-13 степени. S большинства белков колеблется в пределах 1-2 СВЕДБЕРГОВ. Др. методом определения молекулярной массы является метод ГЕЛЬФИЛЬТРАЦИИ (молекулярное просеивание). Используется искусственно созданные гранулы, имеющие поры (гранулы СЕФАДЕКСА). Внутрь гранулы могут проникать только соединения определённого размера: молекулы небольшого размера входят в гранулы, а большие быстрее вымываются. Молекулярная масса рассчитывается ориентировочно. Буфер не задерживается, а белок движется тем медленнее, чем меньше молекулярная масса.
2.Способность белков связываться с ЛИГАНДАМИ,
Белки способны связываться с определенными веществами. Белки специфично узнают свои ЛИГАНДЫ, что обусловлено комплиментарным строением определённого участка белка и ЛИГАНДЫ.
Fe2+ O2. ИЗБИРАТЕЛЬНОСТЬ обеспечивается белковой частью гемоглобина. Центр связывания ЛИГАНДА называется активным центром. Это свойство лежит в основе др. метод разделения белков - АФФИНАЯ ХРОМОТОГРАФИЯ (разделение по сродству).
3.Электрохимические свойства белков.
А. АМФОТЕРНОСТЬ.
Белки - АМФОТЕРНЫЕ ЭЛЕКТРОЛИТЫ.

АМФОТЕРНОСТЬ обусловлена:
1. Концевыми СООН и NH2 группами.
2.Боковыми группами:
ГЛУ, АСП -дополнительные кислотные СВОЙВТВА. АРГ, ЛИЗ, ГИС - основные свойства.
Т.к. белковые молекулы имеют много ИОНОГЕННЫХ групп, следовательно, они ПОЛИЭЛЕКТРОЛИТЫ. БЕЛКИ являются АМФОЛИТАМИ.
Б. Буферные свойства - способность поддерживать РН среды. Наиболее мощным буфером крови является ГЕМОГЛОБИНОВЫЙ буфер, т.к. в большом количестве содержит ГИСТИДИН.
B. Белки содержат заряд, который зависит от соотношения кислотных и основных групп, а оно в свою очередь зависит от их диссоциации, определяющейся РН среды.
Изоэлектрическое состояние - это состояние молекулы белка, при котором её заряд равен 0. Значение РН, при котором белок находится в изоэлектрическом состоянии, называется изоэлектрической точкой.
PI кислые белки<7 (белки протоплазмы)
РI основные белки >7 (ядерные белки).
В изоэлектрическом состоянии белок менее устойчив. Это свойство белков используется при их ФРАКЦИВАНИИ:
1.ИОНООБМЕННАЯ ХРОМАТОГРАФИЯ.
Для неё используется ИОНООБМЕННИКИ, которые изготавливаются из чистой целлюлозы: ДЭАЭ - целлюлоза (содержит катионные группы); КМ - целлюлоза (содержит анионные группы). На ДЭАЭ разделяют отрицательно заряженные белки, на КМ - положительно заряженные. Чем больше в белке СООН групп, тем прочнее он связывается с ДЭАЭ целлюлозой.
2.Разделение белков на основании величины заряда - электрофорез белков. С помощью электрофореза в сыворотке крови выделяют как минимум 5 фракций: АЛЬБУМИНЫ, альфа, альфа-2, гамма, бета - глобулины.
4.Коллоидные свойства белков.
Белковые растворы весьма устойчивы , их иногда относят к истинным растворам , высокая молекулярная масса придаёт белковым растворам коллоидные свойства.
A. Оптические свойства:
- ОПАЛЕСЦЕНЦИЯ - дифракция световых лучей при прохождении через раствор и, следовательно, наблюдение его некоторого потемнения при взгляде под прямым углом к источнику света.
- Рассеивание света ( конус ТИНДАЛЯ).
Оптические свойства используются в световой микроскопии, нефелометрии, ТУРБОДИМЕТРИИ.
При нефелометрии измеряется интенсивность отраженного света. При ТУРБОДИМЕТРИИ измеряется интенсивность проходящего света.
Б. Высокая вязкость растворов белка.
B. Малая скорость диффузии.
Г. Неспособность белков проникать через полупроницаемые мембраны. Давление, обусловленное белками, называется ОНКОТИЧЕСКИМ. Диализ - очистка белковых растворов
от низкомолекулярных веществ. В клинике используется ГЕМОДИАЛИЗ - очистка крови от азотистых компонентов.
Д. Способность белковых растворов переходить из состояния золя в гель. Гель хорошо образует миозин и др. фибриллярные белки.
5. Гидратация белков - способность белков связывать воду. Она осуществляется за счёт:
-полярных групп;
-ПЕПТИДНЫХ связей.
100 г. белка связывает 30-35 г. воды. Способность связывать воду изменяется с возрастом. Вода может проникать в молекулы и связываться с внутренними структурами белка, и образованием раствора воды в белке. Вода может связываться и с наружными структурами белка с образованием ГИДРАТНОЙ оболочки.
6. Растворимость белков в воде (устойчивость белков в водном растворе). Многие белки хорошо растворимы в воде, что определяется количеством полярных групп. Растворимость глобулярных молекул лучше, чем фибриллярных белков. Факторы, определяющие стабильность белковых растворов:
- наличие зарядов в белковой молекуле. Одноименные заряды способствуют растворимости белка, т.к. препятствуют соединению молекул и выпадению в осадок.
- Наличие ГИДРАТНОЙ оболочки, препятствующей объединению белковых молекул. Для осаждения белка, его необходимо лишить этих двух факторов устойчивости. Методом осаждения белка является вливание - осаждение белка с помощью нейтральных солей - (NH4)2-S04.
В полунасыщенном растворе (NH4)2-SO4 осаждаются глобулины, а в насыщенном - альбумины.
После удаления осаждающего фактора, белки переходят в растворённое состояние.
7.ЛАБИЛЬНОСТЬ пространственной структуры белка. Под действием внешних факторов может происходить нарушение высших уровней организации белковой молекулы (вторичной, третичной, четвертичной структур) при сохранении первичной структуры. При этом белок теряет свои НАТИВНЫЕ, физико-химические и биологические свойства. Это явление называется денатурацией. Денатурацию вызывают химические факторы ( повышение температуры, давления, механическое воздействие, УЗ, ионизирующее излучение), химические факторы ( кислоты, щелочи, органические растворители -спирт, фенол; соли тяжёлых металлов).n В некоторых случаях возможна РЕНАТУРАЦИЯ, когда денатурирующий фактор действовал кратковременно и нанёс лёгкое разрушение молекуле. В последние годы установлено, что в организме есть белковые системы предупреждающие денатурацию. Они тоже белковой природы - ШАПЕРОНЫ - класс белков, защищающий в условиях клетки др. белки от денатурации. Они облегчают формирование пространственной конфигурации белков. К ним относятся белки теплового шока или белки стресса.
КЛАССИФИКАЦИЯ БЕЛКОВ.
1 .По функции выделяют:
1. Транспортные белки (гемоглобин О2, альбумин жирные кислоты).
2. Каталитические (ферменты),
3. Регуляторные (гормоны).
4. Структурные (белки соединительной ткани, мембранные белки).
5. Защитные (антитела).
6. Сократительные (актин, миозин).
7. Рецепторные участвуют в образовании рецепторов.
2. По форме выделяют:
1. Глобулярные.
2. Фибриллярные белки.
3. По структуре белки делятся:
1.Простые (ПРОТЕИНЫ) состоят только из АК (ГИСТОНЫ, ПРОТАМИНЫ, АЛЬБУМИНЫ, ГЛОБУЛИНЫ, ГЛЮТЕМИНЫ, ПРОЛОНГИНЫ, ПРОТЕИНОИДЫ).
2.Сложные (ПРОТЕИДЫ) состоят из белков и небелковой части. Белковая часть -АПОПРОТЕИНЫ+ ПРОСТЕТИЧЕСКАЯ группа = ХОЛОПРОТЕИНЫ. Это НУКЛЕОПРОТЕИНЫ, ЛИПОПРОТЕИНЫ, ГЛИКОПРОТЕИНЫ, ХРОМОПРОТЕИНЫ, ФОСФОПРОТЕИНЫ, МЕТАЛЛОПРОТЕИНЫ.
Лекция № 3.
ФЕРМЕНТЫ (F).
1. Понятие о F.
2.Строение F.
3.Коферменты (KO-F).
ПОНЯТИЕ О ФЕРМЕНТАХ.
Ферменты - это биологические катализаторы (КАТ) белковой природы. Роль ферментов в организме огромна. В каждой клетке организма находится до 10000 молекул ферментов, которые катализируют более 2000 различных химических реакций. Ферменты начинают своё каталитическое действие в ЖКТ, продолжают его в тканях, на этапе выведения и образования конечных продуктов. Все реакции в организме ферментативные. Энзимология (ферменты - энзимы) - раздел науки, изучающий ферменты.
ОБЩИЕ ЧЕРТЫ ФЕРМЕНТОВ И НЕБИОЛОГИЧЕСКИХ КАТАЛИЗАТОРОВ.
1. Повышают скорость реакции.
2. В реакциях они не расходуются.
3. Для обратимых процессов и прямая, и обратная реакция катализируется одним и тем же ферментом.
ОТЛИЧИТЕЛЬНЫЕ ПРИЗНАКИ ФЕРМЕНТОВ.
1 .Ферменты обладают более высокой эффективностью действия (повышают скорость реакции в большее число раз, чем неорганические КАТ).
УРЕАЗА (гидролиз мочевины) повышает скорость реакции в 10 раз.
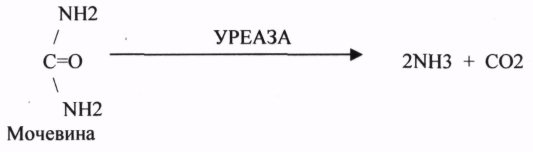
2.Ферменты чувствительны к температуре (ТЕРМОЛАБИЛЬНЫ)
3.Ферменты чувствительны к значениям РН среды.
4.Ферменты, в отличие от неорганических КАТ, обладают высокой специфичностью действия.
5.Ферменты - это катализаторы с регулируемой активностью.
Ферменты, являясь белками, повторяют все особенности структуры и состава белков (состоят из АК, имеют 4 уровня структурной организации), физико-химические свойства белков. Ферменты, как и все функциональные белки, могут быть простыми и сложными.
Простые ферменты представлены только белковой частью (состоят из АК) - ПЕПСИН, ТРИПСИН, ФОСФАТАЗЫ. В структурном отношении имеют 3 уровня организации (ГЛОБУЛА).
Сложные ферменты представлены:
1 .Белковой частью (состоит из АК) - АПОФЕРМЕНТ;
2.Небелковой частью - КОФАКТОР.
Выделяют 2 основных КОФАКТОРА:
А. Ионы металлов (К, Na, Ca, Mg, Mn) большинство всех ферментов являются МЕТАЛЛОФЕРМЕНТАМИ. В продуктах питания должны обязательно содержаться микроэлементы.
В. КОФЕРМЕНТЫ - низкомолекулярные органические вещества не белковой природы.
Для многих ферментов его АПОФЕРМЕНТ вместе с КОФАКТОРОМ образуют каталитически активную молекулу, которая называется ХОЛОФЕРМЕНТОМ.
АПОФЕРМЕНТ+КОФАКТОР=ХОЛОФЕРМЕНТ.
СТРОЕНИЕ ФЕРМЕНТОВ.
В пространственной структуре фермента можно выделить отдельные участки, которые выполняют те или иные функции (активный центр, контактный участок, каталитический участок, АЛЛОСТЕРИЧЕСКИЙ центр).
Активный центр - это участок в молекуле фермента, где происходит связывание и превращение субстрата. АКТ. Ц обычно располагается в гидрофобном углублении ( недоступном для молекул воды), изолируя субстрат от воды. В образовании АКТ. Ц, участвуют боковые группы АК (12-20 АК), причём эти АК могут находиться на разных участках ПОЛИПЕПТИДНОЙ цепи, но при формировании пространственной конфигурации фермента они укладываются т.о., что располагаются в области активного центра. В образовании активного центра принимают участие следующие группы боковых цепей АК:
- NH2 (АРГ,ЛИЗ)
- СООН (АСП, ГЛУ)
- SH (ЦИС)
- ОН (СЕР,ТРЕ)
- ИМИДАЗОЛ (ГИС)
- ГУАНИДИНО группа Фенольное кольцо (ТИР)
Остальные АК поддерживают пространственную конфигурацию активного центра фермента
и обеспечивают его реакционную способность.
Контактный ( субстрат связывающий ) участок -это место в активном центре фермента, где происходит связывание субстрата с его активным центром. Контактный участок обеспечивает специфическое сродство субстрата к ферменту.
Каталитический участок - место, где проходит сама каталитическая реакция.
АЛЛОСТЕРИЧЕСКИЙ (регуляторный) центр - участок в молекуле фермента, расположенный в др. месте, в отличие от активного центра. К АЛЛОСТЕРИЧЕСКОМУ центру могут присоединяться различные вещества, которые отличаются по структуре от молекул субстрата. Эти вещества называются АЛЛОСТЕРИЧЕСКИЕ ЭФФЕКТОРЫ. Они могут влиять на КОНФОРМАЦИЮ активного центра фермента, изменяя её, т.е. могут или повышать скорость реакции, или тормозить её. В роли АЛЛОСТЕРИЧЕСКИХ ЭФФЕКТОРОВ чаще всего выступают гормоны, лекарственные вещества и др. химические соединения.
КОФЕРМЕНТЫ (Ko-F).
КОФЕРМЕНТЫ являются или акцепторами, или донорами различных атомов, или даже атомных групп. Они чаще всего содержат в своём составе различные витамины, следовательно, их делят на две группы:
1.Витаминные.
2.Невитаминные.
Витаминные КОФЕРМЕНТЫ:
1.ТИАМИНОВЫЕ КОФЕРМЕНТЫ содержат в своём составе витамин В1 (ТИАМИН).
A.ТМФ - ТИАМИНМОНОФОСФАТ.
Б.ДФ или ТПФ - ТИАМИНДИФОСФАТ или ТИАМИНПИРОФОСФАТ
B.ТТФ - ТИАМИНТРИФОСФАТ.
ТПФ связана с ферментами ДЕКАРБОКСИЛАЗАМИ альфа КЕТОКИСЛОТ (ПВК, альфа КГК)
2.ФЛАВИНОВЫЕ КОФЕРМЕНТЫ содержат в своём составе витамин В 2.
1 .ФМН - ФЛАВИНМОНОНУКЛЕОТИД.
2.ФАД - ФЛАВИИАДЕНИНДИНУКЛЕОТИД. ФАД*Н2
ФМН и ФАД связанны с ферментами ДЕГИДРОГЕНАЗАМИ. Участвуют в реакциях ДЕГИДРИРОВАНИЯ, т.е. отнятия Н — ОВР.
3. ПАНТОТЕИНОВЫЕ КОФЕРМЕНТЫ содержат в своём составе витамин ВЗ (ПАНТОТЕИНОВАЯ К-ТА). KO-F A (HSK.O-A - HS КОЭНЗИМ А). КОФЕРМЕНТ АЦИЛИРОВАНИЯ.
4. НИКОТИНАМИДНЫЕ КОФЕРМЕНТЫ содержат в своём составе витамин РР
(НИАЦИН).
1.НАД (НИКОТИНАМИДАДЕНИНДИНУКЛЕОТИД). НАД * Н2. 2.НАДФ (НИКОТИНАМИДАДЕНИНДИНУКЛЕОТИДФОСФАТ). НАДФ*Н2.
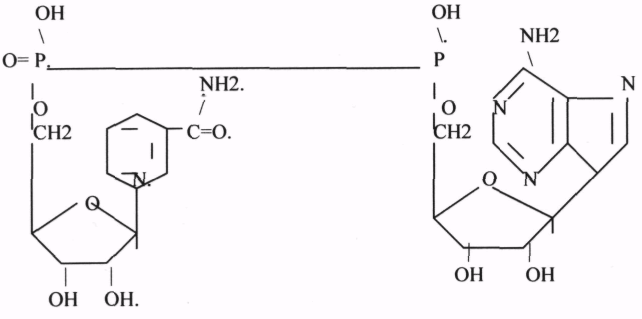
НАД и НАДФ также связаны с ферментами ДЕГИДРОГЕНАЗАМИ, которые в окислительно-восстановительных реакциях (реакции ДЕГИДРИРОВАНИЯ) - анаэробные ДГ.
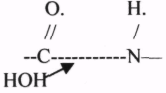
5.ПИРИДОКСИНОВЫЕ КОФЕРМЕНТЫ содержат в своём составе витамин В6. ПАФ - ПИРИДОКСАМИНОФОСФАТ.
ПФ - ПИРИДОКСАЛЬФОСФАТ.Участвует в реакциях превращения АК:
1.Реакции ПЕРЕАМИНИРОВАНИЯ (ТРАНСАМИНИРОВАНИЕ). Связан с ферментами АМИНОТРАНСФЕРАЗАМИ.
2.РЕАКЦИИ ДЕКАРБОКСИЛИРОВАНИЯ АК.
НЕВИТАМИНЫЕ КОФРМЕНТЫ:
Не содержат в своём составе витаминов, но участвуют в каталитических превращениях.
1 .НУКЛЕОТИДЫ: АТФ, ЦТФ (синтез ФОСФОЛИПИДОВ); УДФ, УТФ, ГТФ (синтез
ГЛИКОГЕНА).
2.ПРОИЗВОДНЫЕ ПОРФИРИНА: ГЕМ, ЦИТОХРОМЫ, КАТАЛАЗА.
3.ПЕПТИДЫ:
ГЛУТАТИОН - ТРИПЕПТИД, содержащий ГЛУ-ЦИС-ГЛИ. Он связан с ферментами ОКСИДОРЕДУКТАЗАМИ. Участвует в окислительно-восстановительных реакциях.
4.ИОНЫ РАЗЛИЧНЫХ МЕТАЛЛОВ.
Лекция № 4.
ФЕРМЕНТЫ (продолжение).
1.СВОЙСТВА ФЕРМЕНТОВ.
2.МЕХАНИЗМ ДЕЙСТВИЯ ФЕРМЕНТОВ.
З.МОЛЕКУЛЯРНЫЕ ЭФФЕКТЫ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ.
СВОЙСТВА ФЕРМЕНТОВ.
1 .Высокая каталитическая активность. УРЕАЗА повышает скорость реакции в 10 раз.
2.Ферменты, являясь белками, проявляют ТЕРМОЛАБИЛЬНЫЕ свойства - чувствительность к изменению температуры.
При повышении температуры на каждые 10 градусов, скорость ферментативных реакций повышает в 1,5-2 раза (правило ВАНТ - ГОФФА). Это правило применимо для ферментов в очень узком интервале температуры, т.к. уже при 50-60 градусах наблюдается денатурация, а при 100 гр. - полная денатурация с потерей активности. При 1-3 гр. Активность фермента также понижается, но при понижении температуры структура его сохраняется, поэтому при последующем повышении Т. активность восстанавливается. Это свойство используется в клинической практике при проведении оперативных вмешательств. Температура, при которой фермент проявляет максимальную активность, называется ОПТИМАЛЬНОЙ.
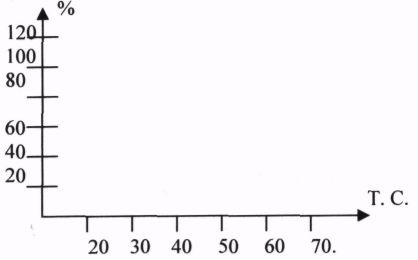
3.Ферменты чувствительны к изменениям РН среды. Для большинства ферментов оптимальные значения РН лежат в нейтральной среде (для КАТАЛАЗЫ РН=7).
Есть ферменты, для которых оптимальные значения РН лежат в кислой среде (пепсин РН=1,5-2,5). Некоторые ферменты проявляют активность в щелочной среде (АРГИНАЗА РН=10-11). Изменения РН приводит к изменению степени ионизации кислых и основных групп в активном центре фермента, т.к. эти группы участвуют в связывании субстрата и его превращении. Изменение РН приводит к конформационной перестройке не только активного центра фермента, но и всей молекулы фермента. Это может сопровождаться нарушением третичной структуры фермента. При оптимальном значении РН функциональные группы активного центра находятся в наиболее реакционно-способном состоянии, и это обеспечивает образование фермент-субстратного комплекса.
4.Специфичность действия ферментов. В основе специфичности действия ферментов лежит конформационное соответствие его активного центра молекуле субстрата. Различают следующие виды специфичности:
А). Абсолютная специфичность. Ей обладают ферменты, которые действуют только на 1 субстрат и не действуют на другие субстраты.
УРЕАЗА ГИДРОЛИЗУЕТ МОЧЕВИНУЮ.
АРГИНАЗА ОТЩЕПЛЯЕТ АРГ.
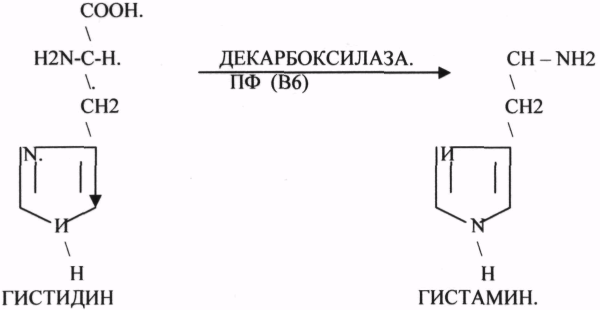
ФУМАРАЗА - ГИДРАТАЦИЯ ФУМАРОВОЙ КИСЛОТЫ.
В). СТЕРИОСПЕЦИФИЧНОСТЬ. Ей обладают ферменты, действующие на пространственные или стереоизомеры. ЦИС и ТРАНС изомеры; оптические изомеры (ЭНАНТИОМЕРЫ).
С). Групповая специфичность. Ей обладают ферменты, которые катализируют однотипные реакции сходных по строению субстратов, т.е. эти субстраты могут содержать в своём составе одинаковые группы атомов.
Пример: ЛИПАЗА - участвует в расщеплении ЛИПИДОВ, содержащих в своём
составе СЛОЖНОЭФИРНУЮ связь.
![]()
ПЕПТИДАЗЫ действуют на субстраты, содержащие ПЕПТИДНЫЕ связи.
Их действию подвергаются ПЕПТИДЫ,Б.
![]()
МЕХАНИЗМ ДЕЙСТВИЯ ФЕРМЕНТОВ.
С термодинамической точки зрения, действие любого фермента направлено на понижение энергии активации. Энергия активации - это то дополнительное количество энергии, которое нужно сообщить молекуле, чтобы перевести её из неактивного состояния в состояние активности. Чем ниже энергия активации, тем выше скорость реакции. Теория действия ферментов была предложена БЕЙЛИСОМ и ВАНБУРГОМ. Эта теория получила название АДСОРБЦИОНОЙ. Согласно ей, фермент представляет собой "губку", которая адсорбирует на своей поверхности молекулы реагирующих веществ. Она как бы стабилизирует их, способствует взаимодействию. Эта гипотеза не могла объяснить специфичность действия ферментов. 70 лет назад была предложена др. теория МИХАЭЛИСОМ и МЕНТЕНОМ. Они выдвинули понятие о F-S комплексе. Фермент взаимодействует с субстратом, образуя нестойкий промежуточный F-S комплекс, который затем распадается с образованием продуктов реакции (Р) и освобождением фермента. В этом процессе выделяют несколько стадий:
1.Диффузия S к F и их СТЕРИЧЕСКОЕ взаимодействие с образованием F-S комплекса. Эта стадия не продолжительна. Её скорость зависит от концентрации субстрата и скорости диффузии его к активному центру фермента. На этой стадии практически не происходит понижения энергии активации.
![]()
2.Преобразование F-S комплекса в один, или несколько, активированных комплексов.
![]()
Они называются переходными. Эта стадия является наиболее продолжительной по времени. При этом происходит разрыв связей в молекуле субстрата, образование новых связей, т.е. образуются Р реакции. Е активации .
3.Освобождение продуктов реакции от фермента и поступление их в окружающую среду.
![]()
МОЛЕКУЛЯРНЫЕ ЭФФЕК ТЫ ФЕРМЕНТАТИВНОГО ДЕЙСТВИЯ.
1. Эффект концентрации. Чтобы произошло взаимодействие между молекулами реагирующих веществ, они должны обязательно столкнуться. В обычных условиях без участия фермента столкновение этих молекул является медленным, что замедляет реакцию. Поэтому основная роль ферментов заключается в притяжении молекул реагирующих веществ на свою поверхность и концентрация этих молекул в области активного центра фермента.
2. Эффект, сближения и ориентации. Это характерное свойство ферментов, которое позволяет ускорить превращение субстрата и повышение скорости реакции в 1000 и 10000 раз. Контактные участки активного центра фермента связывают специфически молекулы субстрата, сближают их и обеспечивают взаимную ориентацию так, чтобы это было выгодно для действия каталитических групп фермента. Такое упорядоченное расположение S приводит к снижению энергии активации.
3. Эффект натяжения ("дыбы"). До присоединения субстрата к активному центру фермента, его молекула как бы в расслабленном состоянии. После связывания молекула субстрата растягивается и принимает напряжённую деформированную конфигурацию. При этом увеличивается длина межатомных связей, следовательно, понижается Е активации.
4. Кислотно-основной катализ. В активном центре фермента содержатся группы кислотного и основного типа. Группы кислотного типа отщепляют Н+ и имеют отрицательный заряд. Группы основного типа присоединяют Н+ и имеют положительный заряд. Кроме основных групп, положительный заряд несут ионы металлов. После связывания субстрата с активным центром фермента, молекулы субстрата перестраиваются, т.к. они подвергаются действию каталитических групп активного центра: одни группы присоединяют Н+, др. его отщепляют. Это приводит к ускорению образования продукта реакции, т.е. способствует понижению энергии активации.
5.Ковалентный катализ (ФОСФОТАЗЫ). Наблюдается у ферментов, которые образуют ковалентные связи между каталитическими группами активного центра и субстрата. В результате формируется промежуточный F-S комплекс, который неустойчив, легко распадается, продукты реакции быстро освобождаются. 6.Эффект индуцированного соответствия.
Он объясняет специфичность действия ферментов. По этому поводу имеется 2 точки зрения:
А). Гипотеза ФИШЕРА. Согласно ей имеется строгое СТЕРИЧЕСКОЕ соответствие субстрата и активного центра фермента. По ФИШЕРУ, фермент - это жёсткая структура, а субстрат является как бы слепком его активного центра. Если субстрат подходит к активному центру фермента как ключ к замку, то реакция возможна. Но эта теория не могла объяснить групповую специфичность фермента.
В). Теория индуцированного соответствия КОШЛЕНДА дополнила теорию ФИШЕРА. Согласно ей молекула фермента - это не жёсткая, а гибкая структура. После связывания фермента с субстратом, изменяется КОНФОРМАЦИЯ активного центра фермента и всей молекулы субстрата. Они находятся в состоянии индуцированного соответствия. Это происходит в момент взаимодействия. Гипотеза КОТЛЕНДА получила название "рука-перчатка".
Лекция № 5.
ФЕРМЕНТЫ (продолжение).
1.Ингибиторы ферментативной активности.
2.Виды ИНГИБИРОВАНИЯ.
3.Активаторы ферментов.
4.Понятие об ИЗОФЕРМЕНТАХ.
ИНГИБИТОРЫ ФЕРМЕНТАТИВНОЙ АКТИВНОСТИ.
Ферменты - это катализаторы с регулируемой активностью. Ею можно управлять с помощью различных веществ. Действие фермента можно подавить или частично, или полностью, т.е. ИНГИБИРОВАТЬ определёнными химическими веществами, находящимися в организме или поступающими извне. Эти вещества называются ИНГИБИТОРАМИ.
По характеру действия ингибиторы делятся на 2 большие группы:
1.Обратимые - это соединения, которые НЕКОВАЛЕНТНО взаимодействуют с ферментом, при этом образуется комплекс, способный к диссоциации.
2.Необратимые - это соединения, которые могут специфически связывать определенные функциональные группы активного центра фермента. Они образуют с ним прочные КОВАЛЕНТНЫЕ связи, поэтому такой комплекс трудно разрушить.
ВИДЫ ИНГИБИРОВАНИЯ. По механизму действия выделяют следующие виды ИНГИБИРОВАНИЯ:
1. КОНКУРЕНТНОЕ ИНГИБИРОВАНИЕ - это торможение ферментативной реакции, вызванное связыванием с активным центром фермента ингибитора, который по своей структуре близок к структуре субстрата. При этом и субстрат, и ингибитор могут взаимодействовать с ферментом, но они будут конкурировать за активный центр фермента, и связываться будет то вещество, которого больше.
![]()
ПРИМЕР: СУКЦИНАТДЕГИДРОГЕНАЗНАЯ реакция.
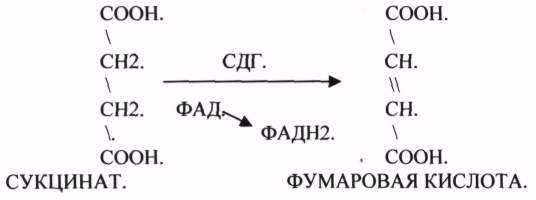
Конкурентным ингибитором данной реакции является МАЛОНОВАЯ кислота, поэтому с активным центром фермента связывается и та, и другая кислота, в зависимости от их соотношения в растворе. Чтобы снять частично или полностью действие конкурентного ингибитора, нужно повысить концентрацию субстрата. При этом весь фермент будет находиться в форме фермент-субстратного комплекса, а доля комплекса фермент-ингибитор будет резко понижаться, поэтому скорость ферментативной реакции может быть максимальной даже в присутствии ингибитора. Многие лекарственные препараты действуют по типу конкурентного ингибитора. При этом они тормозят активность ряда ферментов, необходимых для функционирования бактериальных клеток. Примером является применение СУЛЬФАНИЛА (СА). При различных инфекционных заболеваниях, которые вызываются бактериями, применяются СА препараты. Эти препараты имеют структурное сходство с ПАРААМИНОБЕНЗОЙНОЙ кислотой, которая используется бактериями для синтеза ФОЛИЕВОЙ кислоты, необходимой для роста и размножения бактерий.
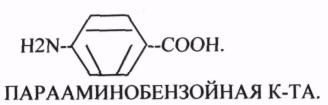

Введение СА приводит к ИНГИБИРОВАНИЮ фермента бактерий, которые синтезируют ФОЛИЕВУЮ кислоту. Нарушение синтеза этой кислоты проводит к нарушению роста микроорганизмов и их гибели.
По принципу конкурентных ингибиторов действует целая группа различных препаратов -это АНТИХОЛИНЭСТЕРАЗЫ. Они являются конкурентными ингибиторами фермента
ХОЛИНЭСТЕРАЗЫ, катализирующего ГИДРОЛИЗ АЦЕТИЛХОЛИНА. АЦЕТИЛХОЛИН обеспечивает проведение нервного импульса. АНТИХОЛИНЭСТЕРАЗЫ конкурируют с АЦЕТИЛХОЛИНОМ за активный центр фермента ХОЛИНЭСТЕРАЗЫ. В результате этого распад АЦЕТИЛХОЛИНА тормозится, он накапливается в организме, вызывая нарушение проведения нервного импульса.
2.НЕКОНКУРЕНТНОЕ ИНГИБИРОВАНИЕ - это торможение ферментативной реакции, вызванное влиянием ингибитора на каталитическое превращение субстрата. При этом ингибитор не влияет на связывание фермента с субстратом. Неконкурентный ингибитор может связываться либо с каталитическими группами активного центра фермента, либо вне активного центра фермента, но при этом он изменяет КОНФОРМАЦИЮ фермента и затрагивает каталитический участок его активного центра. При неконкурентном ИНГИБИРОВАНИИ, возможно образование тройного комплекса.
![]()
В качестве неконкурентного ингибитора выступают ЦИАНИДЫ. Они прочно связываются с ионами железа, которые входят в состав каталитического ГЕМИНОВОГО фермента -ЦИТОХРОМОКСИДАЗЫ. Этот фермент является одним из компонентов дыхательной цепи. Блокирование дыхательной цепи выключает её из работы, что приводит к мгновенной гибели организме. Примером неконкурентного ингибитора являются соли тяжёлых металлов. Они блокируют -SH группы, которые входят в каталитический участок фермента. При этом образуется F-I комплекс. Он способен присоединять субстрат, но дальнейшего превращения субстрата не происходит, т.к. каталитические группы фермента заблокированы. Реакция непродуктивна. Снять действие неконкурентного ингибитора очень сложно, т.к. ионы металлов очень прочно связываются с активным центром фермента. Действие этого ингибитора можно снять только с помощью специальных веществ - РЕАКТИВАТОРОВ.
3.СУБСТРАТНОЕ ИНГИБИРОВАНИЕ - это торможение ферментативной реакции, вызванное избытком субстрата. При этом образуется F-S комплекс, но он не подвергается каталитическим превращениям, т.к. делает молекулу фермента неактивной. Действие субстратного ингибитора снимается путём уменьшения концентрации субстрата.
4.АЛЛОСТЕРИЧЕСКОЕ ИНГИБИРОВАНИЕ характерно для ферментов, имеющих четвертичную структуру, молекула которых состоит из нескольких единиц (ПРОТОМЕРОВ). АЛЛОСТЕРИЧЕСКИЕ ферменты могут иметь 2 и более единиц. При этом одна имеет каталитический центр и называется каталитической, а другая - АЛЛОСТЕРИЧЕСКИЙ центр и называется регуляторной. В отсутствии АЛЛОСТЕРИЧЕСКОГО ИНГИБИТОРА субстрат присоединяется к каталитическому центру, и идёт обычная каталитическая реакция. При появлении АЛЛОСТЕРИЧЕСКОГО ИНГИБИТОРА, он присоединяется к регуляторной единице, т.е. к АЛЛОСТЕРИЧЕСКОМУ центру, и изменяет КОНФОРМАЦИЮ центра фермента, в результате этого активность фермента снижается.
АКТИВАТОРЫ ФЕРМЕНТОВ.
Это вещества, повышающие скорость ферментативной реакции. Выделяют несколько групп активаторов:
1. Соляная кислота - активатор пепсина. Желчные кислоты - активаторы ЛИПАЗЫ.
2. Ионы различных металлов
Некоторые ферменты для проявления ферментативной активности требуют присутствия ионов нескольких металлов. Ионы металлов в разных случаях могут быть или донорами, или акцепторами электронов. Некоторые ионы металлов способны присоединять субстрат к активному центру фермента, т.е. способствуют образованию F-S комплекса.
3. Активация некоторых ферментов осуществляется путём частичного ПРОТЕОЛИЗА. Эти ферменты действуют в основном в ЖКТ. Они вырабатываются в неактивной форме, а именно, в форме ПРОФЕРМЕНТА. Активация таких ферментов происходит путём разрыва одной или нескольких ПЕПТИДНЫХ связей.
![]()
Из оставшейся части, после отнятия ГЕКСАПЕПТИДА, формируется новый фермент, отличающийся по ПРОСТРАНСТВЕННОЙ КОНФИГУРАЦИИ от неактивного ТРИПСИНОГЕНА, а также формой активного центра ТРИПСИНА.
4. АЛЛОСТЕРИЧЕСКАЯ АКТИВАЦИЯ ферментов характерна для АЛЛОСТЕРИЧЕСКИХ ферментов. Активатор присоединяется к АЛЛОСТЕРИЧЕСКОМУ центру и влияет на КОНФОРМАЦИЮ активного центра фермента, делает её КОМПЛЕМЕНТАРНОЙ молекуле субстрата.
ПОНЯТИЕ ОБ ИЗОФЕРМЕНТАХ.
ИЗОФЕРМЕНТЫ - это семейство или группа ферментов, катализирующих одну реакцию, но различающихся по некоторым физико-химическим свойствам:
по А К составу;
по последовательности АК;
по молекулярной массе;
по электрофоретической подвижности;
по способам регуляции.
ИЗОФЕРМЕНТЫ называют ещё молекулярными формами фермента, причём физико-химические различия в их формах возникли, вследствие генетического различия в первичной структуре белка. Множественные формы ферментов - это модификации одного фермента, у которого различия в физико-химических свойствах возникли не вследствие генетических причин, а вследствие каких-то внешних воздействий.
ЛДГ (ЛАКТАТДЕГИДРОГЕНАЗА) имеет 5 ИЗОФОРМ, каждая из которых является ТЕТРОМЕРОМ - состоит из 4 СУБЪЕДИНИЦ Н и М типов.
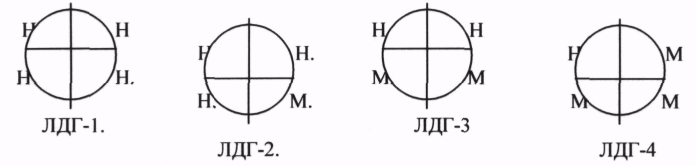
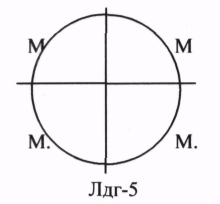
ИЗОФЕРМЕНТЫ отличаются строгой органной специфичностью. В миокарде, почках наиболее активна ЛДГ-1, ЛДГ-2. Для печени и мышц наиболее активны ЛДГ-4, ЛДГ-5. Определение активности ИЗОФЕРМЕНТОВ имеет диагностическое значение. При патологии печени в сыворотке крови резко возрастает активность ЛДГ-4, ЛДГ-5.
Лекция № 6.
ФЕРМЕНТЫ (продолжение).
1. КЛАСИФИКАЦИЯ ФЕРМЕНТОВ.
2. НОМЕНКЛАТУРА ФЕРМЕНТОВ.
3. ФЕРМЕНТЫ ВМЕДИЦИНЕ.
КЛАССИФИКАЦИЯ ФЕРМЕНТОВ.
Всего насчитывается 1800 ферментов, из них в чистом виде выделено 150. В 1961 г. в Москве состоялась международная комиссия по классификации и номенклатуре ферментов.
Согласно её работе, все ферменты были разделены на 6 классов, каждый из которых указывает тип каталитической реакции.
1. ОКСИДОРЕДУКТАЗЫ.
2. ТРАНСФЕРАЗЫ.
3. ГИДРОЛАЗЫ.
4. ЛИАЗЫ.
5. ИЗОМЕРАЗЫ.
6. ЛИГАЗЫ.
Каждый класс делится на подклассы. Они уточняют действие ферментов и указывают на химическую природу группы, которую атакует фермент. Подклассы делятся на ПОДПОДКЛАССЫ, которые ещё более конкретизируют действие ферментов, указывают на связь в молекуле субстрата, которая подвергается действию фермента. ПОДПОДКЛАСС может указывать на химическую природу акцептора.
1 .ОКСИДОРЕДУКТАЗЫ.
Ферменты этого класса участвуют в ОВР (окислительно-восстановительные реакции), т.е. в реакциях транспорта электронов и протонов. Это наиболее многочисленный класс ферментов: насчитывается более 400 ОКСИДОРЕДУКТАЗ. Здесь выделяют 17 подклассов.
1.АЭРОБНЫЕ ДЕГИДРОГЕНАЗЫ.
Они участвуют в реакциях ДЕГИДРИРОВАНИЯ, при этом они отнимают атомы Н2 от окисленного субстрата и транспортируют их на О2.

Некоторые АЭРОБНЫЕ ДЕГИДРОГЕНАЗЫ называют ОКСИДАЗАМИ. Например, ОКСИДАЗЫ АК.
![]()
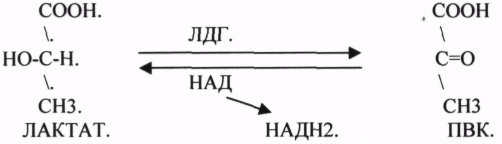
2.АНАЭРОБНЫЕ ДГ.
Эти ферменты также участвуют в реакциях ДЕГИДРИРОВАНИЯ, т.е. отнятия Н2 от окисляемого субстрата и транспортировка его на любой др. субстрат, кроме О2.
3.ПЕРОКСИДАЗЫ.
Это группа ферментов, которые отнимают Н2 от окисляемого субстрата и транспортируют его на ПЕРОКСИД.

КАТАЛАЗА катализирует разложение Н2О2 до Н2О и молекулярного О2
![]()
4.ЦИТОХРОМЫ.
Они содержат в своем составе ГЕМ а следовательно ионы железа, степень окисления которого может изменяться. ЦИТОХРОМЫ участвуют в транспорте только электронов.
2.ТРАНСФЕРАЗЫ.
Ферменты этого класса участвуют в транспорте атомных групп от одного субстрата к другому. Субстрат, от которого группа отнимается, является донором, а субстрат, который её принимает, является акцептором. В зависимости от переносимых групп, ТРАНСФЕРАЗЫ делятся на несколько подклассов:
1.АМИНОТРАНСФЕРАЗЫ. Они участвуют в реакциях ПЕРЕАМИНИРОВАНИЯ.
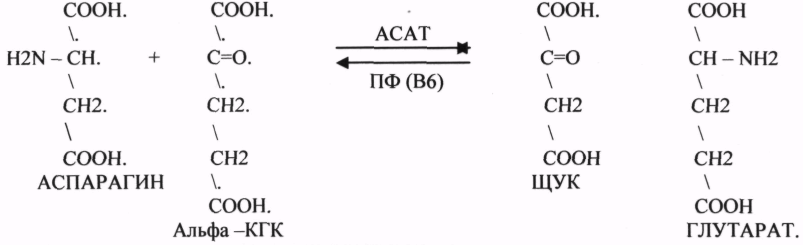
АСАТ - АСПАРАГИНОВАЯ АМИНОТРАНСФЕРАЗА.
2.МЕТИЛТРАНСФЕРАЗЫ (СНЗ группы).
3.ФОСФОТРАНСФЕРАЗЫ (ФОСФАТНЫЕ группировки).
4.АЦИЛТРАНСФЕРАЗЫ (кислотные остатки).
3.ГИДРОЛАЗЫ.
Ферменты этого класса участвуют в реакциях разрыва связей в молекулах субстратов при участии воды. При этом элементы воды присоединяются к свободным единичным валентностям, образовавшимся после разрыва связей. Т.о. сложные органические соединения распадаются на простые - каталитические реакции гидролиза. В зависимости от разрушаемых связей, различают следующие подгруппы ГИДРОЛАЗ.
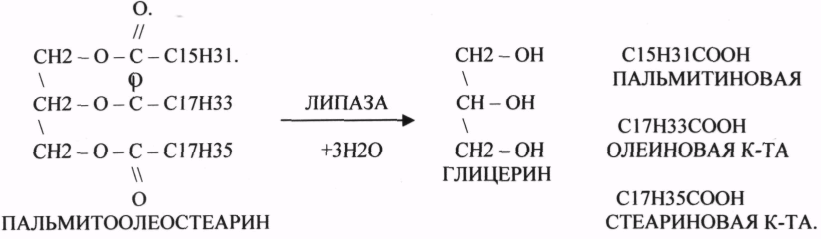
1.ЭСТЕР АЗЫ действуют на СЛОЖНО-ЭФИРНЫЕ связи. К ним относятся ЛИПАЗЫ, ФОСФОЛИПАЗЫ, ХОЛЕСТЕРАЗЫ.
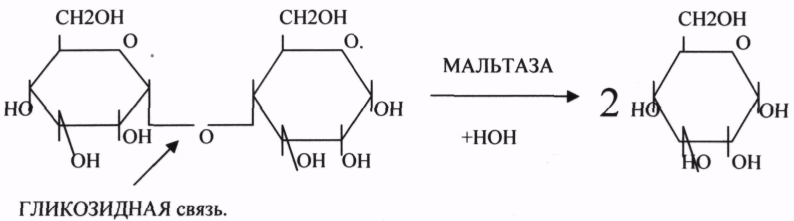
2.ГЛИКОЗИДАЗЫ - действует на ГЛИКОЗИДНУЮ связь, находящуюся в сложных углеводах. К ним относятся АМИЛАЗА, САХАРАЗА, МАЛЬТАЗА, ГЛИКОЗИДАЗЫ, ЛАКТАЗА.
3.ПЕПТИДАЗЫ участвуют в разрыве ПЕПТИДНЫХ связей в белках. К ним относятся ПЕПСИН, ХИМОТРИПСИН, АМИНОПЕПТИДАЗА, КАРБОКСИПЕПТИДАЗА и т.д.
4.ЛИАЗЫ.
1 .ДЕКАРБОКСИЛАЗЫ участвуют в реакциях ДЕКАРБКСИЛИРОВАНИЯ.
2.Ферменты, участвующие в разрыве связей между атомами углеводов не ГИДРОЛИТИЧЕСКИМ путём без участия воды. К ним относится АЛЬДОЛАЗА.
3.Ферменты, участвующие в реакциях ГИДРАТАЦИИ и ДЕГИДРАТАЦИИ.
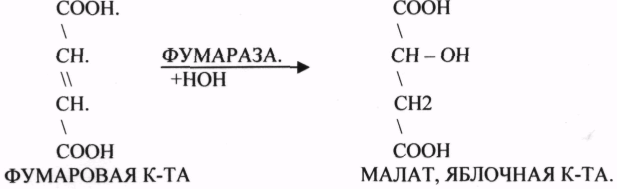
5.ИЗОМЕРАЗЫ.
Ферменты этого класса участвуют в ИЗОМЕРИЧЕСКИХ превращениях. При этом один структурный изомер может превращаться в другой, за счёт внутри молекулярной перегруппировки атомов.
6.ЛИГАЗЫ.
Ферменты этого класса участвуют в реакциях соединения двух и более простых веществ с образованием нового вещества. Эти реакции требуют затрат энергии извне в виде АТФ.
НОМЕНКЛАТУРА ФЕРМЕНТОВ.
1.Тривиальная номенклатура. ПРИМЕР: пепсин, трипсин.
2.Рабочая номенклатура:
название S + тип превращения + окончание «аза».
ПРИМЕР: ЛАКТАТДЕГИДРОГЕНАЗА.
3.Систематическая номенклатура.
Название всех S, + тип каталитического + окончание «аза» участвующих в реакции превращения
ЕДИНИЦЫ АКТИВНОСТИ ФЕРМЕНТОВ. Мерой активности фермента могут быть скорость превращения субстрата и концентрация образующегося продукта реакции. Согласно современной классификации по системе СИ, единицей активности является КАТАЛ. КАТАЛ - это количество фермента, которое способно осуществить превращение 1 молекулы субстрата в 1 секунду при стандартных условиях.
ФЕРМЕНТЫ В МЕДИЦИНЕ.
Основное направление медицинской ЭНЗИМОЛОГИИ:
1.ЭНЗИМОПАТОЛОГИЯ (патологическое состояние, связанное с полным отсутствием фермента в организме).
2.ЭНЗИМОДИАГНОСТИКА (определение активности ферментов в диагностических целях). 3.ЭНЗИМОТЕРАПИЯ (использование ферментов в лечебных целях).
Лекция № 7. Основной путь катаболизма (ОПК).
1 .ПОНЯТИЕ ОБ ОБМЕНЕ ВЕЩЕСТВ.
2.ЭТАПЫ ОБМЕНА ВЕЩЕСТВ.
3.ОПК, ЦИКЛ ТРИКАРБОНОВЫХ КИСЛОТ (ЦТК).
ПОНЯТИЕ ОБ ОБМЕНЕ ВЕЩЕСТВ.
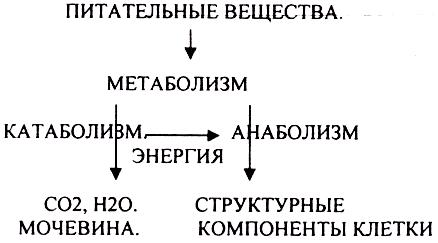
Обмен веществ - необходимое условие жизни, но он протекает и вне живой природы. Обмен веществ всегда связан с обменом энергии. Системы, обменивающиеся с окружающей средой веществом и энергией, называются открытыми (живой организм). Закрытые системы обмениваются только энергией. В соответствии со 2 законом термодинамики, открытые системы являются более устойчивыми. Отличительной особенностью обмена веществ в живой природе от обмена веществ в неживой системе является способность образовывать дочерние структуры из поступивших веществ.
Обмен веществ - это процессы взаимоотношения организма с внешней средой, представляющие совокупность химических реакций, которым подвергаются различные вещества с момента их поступления в организм до момента их выделения в виде конечных продуктов. Основные компоненты живых систем - белки, жиры, углеводы. В организм человека должно поступать: Белков - 100 г. в сутки, Жиров - 100 г. в сутки, Углеводов - 400 г. в сутки.
За сутки при обмене этих веществ образуется 2000-3000 ккал энергии.
ЭТАПЫ ОБМЕНА ВЕЩЕСТВ.
1.Поступление веществ из внешней среды посредством питания и дыхания.
2.Превращение веществ в организме - МЕЖУТОЧНЫЙ обмен
3.Выделение конечных продуктов.
Распад БЖУ до ПИРУВАТА идёт индивидуально для каждой группы органических соединений и носит название специфического пути катаболизма. С образованием ПИРУВАТА начинается общий путь катаболизма, идентичный для обмена всех питательных веществ.
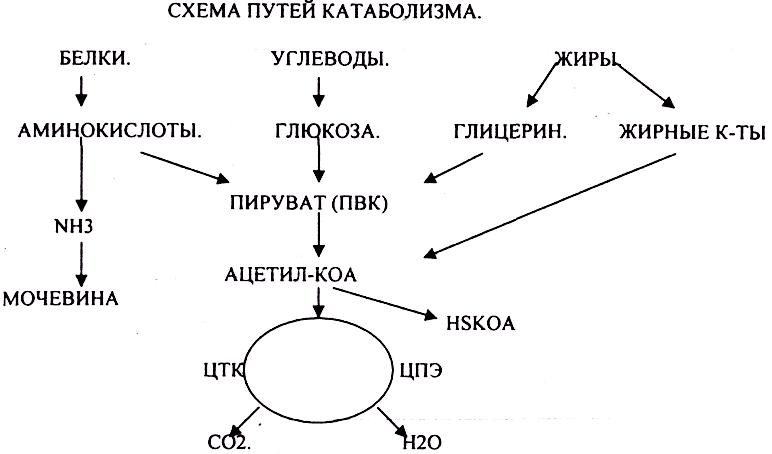
ЦИКЛ ТРИКАРБОНОВЫХ КИСЛОТ. ОПК можно разделить на несколько стадий:
1.Превращение ПВК в АЦЕТИЛ-КОА.
2.Распад АЦЕТИЛ-КОА в ЦТК (образование СО2).
3.Образование воды как конечного продукта в ЦПЭ— цикле пере носа электронов. ПРЕВРАЩЕНИЕ ПИРУВАТА В АЦЕТИЛ-КОА.
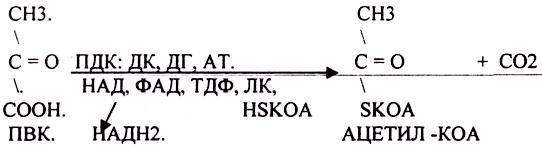
ПИРУВАТ подвергается реакции ОКИСЛИТЕЛЬНОГО ДЕКАРБОКСИЛИРОВАНИЯ. Этот процесс катализируется комплексом ферментов - ПИРУВАТДЕКАРБОКСИЛАЗНЫМ комплексом (ПДК), с участием в процессе 5 КОФЕРМЕНТОВ:
1 .ДЕКАРБОКСИЛАЗЫ (включают КОФЕРМЕНТ - ТДФ).
2.АЦЕТИЛТРАНСФЕРАЗЫ (включают КОФЕРМЕНТ - ЛК, HSK.OA).
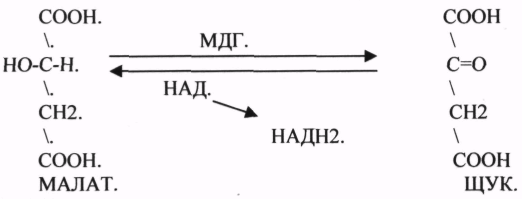
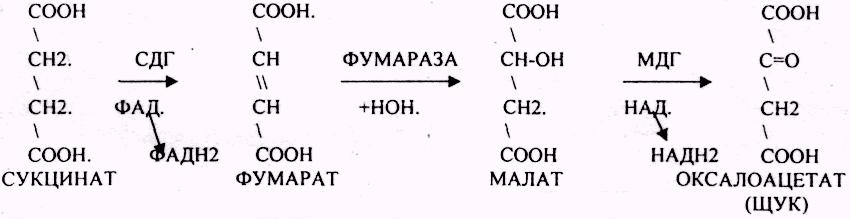
3.ДЕГИДРОГЕНАЗЫ (включают КОФЕРМЕНТ - НАД, ФАД, ЛК). ЦТК (цитратный цикл, цикл КРЕБСА).
В цикле КРЕБСА АЦЕТИЛ-КОА распадается до СО2 с образованием восстановленных КОФЕРМЕНТОВ - НАДН

АТФ в реакции не участвует, а используется энергия макроэргической связи АЦЕТИЛ-КОА ЦИТРИЛ-КОА не устойчив и очень быстро распадается под влиянием воды.
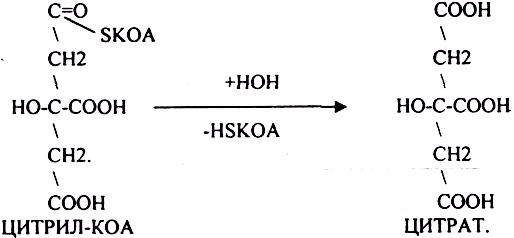
Лимонная кислота далее превращается в свой изомер (ИЗОЦИТРАТ) под влиянием фермента АКОНИТАЗЫ.
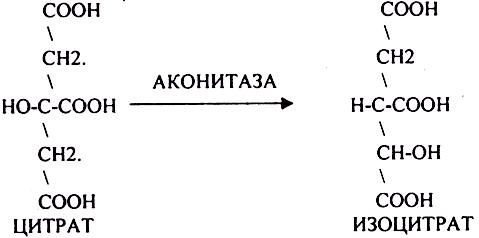
ИЗОЦИТРАТ подвергается далее ДЕГИДРИРОВАНИЮ под влиянием фермента -ИЗОЦИТРАТДЕГИДРОГЕНАЗЫ.
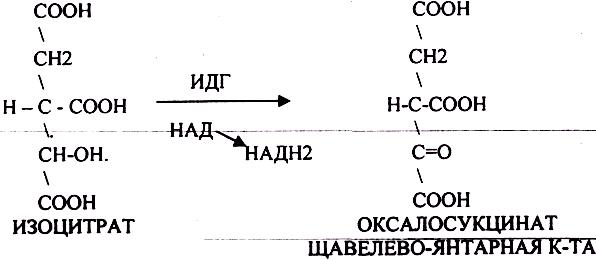
ЩЯВЕЛЕВО-ЯНТАРНАЯ К-ТА подвергается ДЕКАРБОКСИЛИРОВАНИЮ достаточно легко и не требует участия дополнительных ферментов - ПРЯМОЕ ДЕКАРБОКСИЛИРОВАНИЕ.
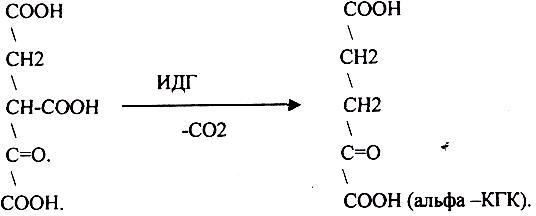
-КГК подвергается реакции ОКИСЛИТЕЛЬНОГО ДЕКАРБОКСИЛИРОВАНИЯ, катализируемой комплексом ферментов (КЕТОГЛУТАРАТДЕГИДРОГЕНАЗНЫЙ комплекс), включающий 3 фермента и 5 КОФЕРМЕНТОВ.

СУКЦИНИЛ-КОА подвергается реакции субстратного ФОСФОРИЛИРОВАНИЯ.
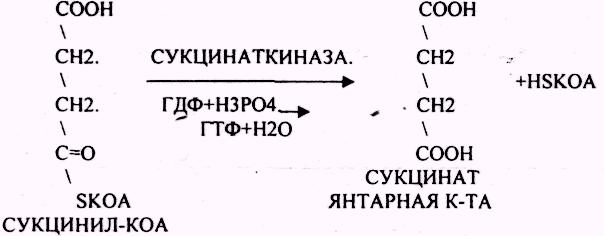
ГТФ + АДФ = ГДФ + АТФ
Т.о. происходит распад АЦЕТИЛ-КОА до СО2 и восстановленного HSKOA.
ФУНКЦИИ ЦТК.
1 .Катаболическая - распад АЦЕТИЛА.
2.Анаболическая. Компоненты ЦТК могут использоваться для синтеза др. соединений
ЩУК - синтез АСП, МАЛAT - синтез глюкозы и т.д.
3.Интегративная. Взаимосвязь обмена БЖУ.
4.Энергетическая. Образование 1 молекулы АТФ. Если ЦТК работает вместе с дыхательной цепью, то образуется ещё 1 молекул АТФ.
5.ВОДОРОДГЕНЕРИРУЮЩАЯ - в результате ЦТК образуется 3 молекулы НАДН2 и 1 молекула ФАДН2, т.е. 4 пары молекул водорода. Они транспортируются в ЦТЭ.
Лекция № 8.
Образование воды как конечного продукта биологического окисления.
1.ИСТОРИЯ УЧЕНИЯ О БИОЛОГИЧЕСКОМ ОКИСЛЕНИИ.
2.СОВРЕМЕННЫЕ ПРЕДСТАВЛЕНИЯ О БИОЛОГИЧЕСКОМ ОКИСЛЕНИИ.
3.КОМПОНЕНТЫ ДЫХАТЕЛЬНОЙ ЦЕПИ.
4.ОКИСЛИТЕЛЬНОЕ ФОСФОРИЛИРОВАНИЕ. ИСТОРИЯ УЧЕНИЯ О БИОЛОГИЧЕСКОМ ОКИСЛЕНИИ.
Первые представления о биологическом окислении были высказаны ЛАВУАЗЬЕ, который говорил, что биологическое окисление - медленное горение. С химической точки зрения, горение - это взаимодействие углерода с кислородом с образованием СО2. Но в организме образование СО2 идёт путём ДЕКАРБОКСИЛИРОВАНИЯ, а биологическое окисление протекает при низкой температуре, не путём образования СО2, в присутствии воды и без образования пламени. Исходя из этого, были выдвинуты следующие настоящие представления о биологическом окислении в начале 20 в.:
1.Теория «активации» кислорода академика БАХА. Ведущей ролью в процессе биологического окисления он представлял образование ПЕРОКСИДОВ.
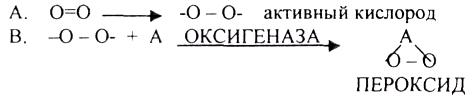
![]()
Эти взгляды поддержали ботаники, т.к. в растениях много ПЕРOКСИДАЗ, а учёные, изучающие животные ткани, не поддержали эти взгляды, т.к. в них не обнаруживаются ПЕРОКСИДАЗЫ.
2.Теория активирования водорода академика ПАЛЛАДИНА. Он исходил из того, что в животных тканях много фермента - ДГ.
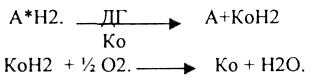
Конечным продуктом биологического окисления является вода. Взгляды БАХА и ПАЛЛАДИНА трансформировали. В настоящее время считается, что в биологическом окислении принимают участие ДГ и ОКСИДАЗЫ.
СОВРЕМЕННЫЕ ПРЕДСТАВЛЕНИЯ О БИОЛОГИЧЕСКОМ ОКИСЛЕНИИ.
1. Биологическое окисление, как и окисление вообще, есть процесс переноса электронов. То вещество, что отдаёт электроны, окисляется, то, что принимает, восстанавливается. Если акцептором электронов является кислород, то такой процесс называется ТКАНЕВЫМ ДЫХАНИЕМ. Биологическое окисление предполагает ДЕГИДРИРОВАНИЕ с образованием воды.
![]()
Если водород взаимодействует с кислородом с образованием воды вне организма, то это сопровождается взрывом.
2. Биологическое окисление - это процесс многоступенчатый - многоступенчатая передача электронов с постепенным выделением энергии, что исключает взрыв.
3. Биологическое окисление - это процесс, требующий много ферментов. Т.о. биологическое окисление - это многоступенчатый процесс транспорта электронов, осуществляемый комплексов ферментов. Этот комплекс ферментов называется ЭЛЕКТРОН-ТРАНСПОРТНОЙ ЦЕПЬЮ (ЭТЦ), или ЦЕПЬЮ ПЕРЕНОСА ЭЛЕКТРОНОВ (ЦПЭ), или дыхательной цепью. ЭТЦ - это своеобразный КОНВЕЕР по переносу электронов и протонов от субстрата к кислороду.
КОМПОНЕНТЫ ДЫХАТЕЛЬНОЙ ЦЕПИ.
1 .НИКОТИНЗАВИСИМЫЕ ДГ, т.е. содержащие КОФЕРМЁНТЫ - НАД, НАДФ 2.ФЛАВИНЗАВИСИМЫЕ ДГ, т.е. содержащие КОФЕРМЁНТЫ - ФМН, ФАД.
З.УБИХИНОН (Ko-Q).
4.ЦИТОХРОМЫ: в, с, c1., а, а3.
Почти все эти компоненты, за исключением первого, встроены во внутреннюю мембрану МИТОХОНДРИЙ. В печени таких дыхательных цепей до 5000, а в сердце - до 20000.
СТРОЕНИЕ КОМПОНЕНТОВ ДЫХАТЕЛЬНОЙ ЦЕПИ.
1 .В НАД и НАДФ рабочей частью является витамин РР - НИКОТИНАМИД.
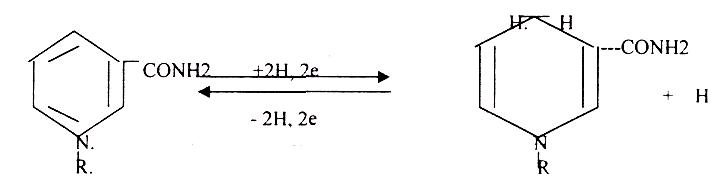
НАД*2Н + 2е = НАДН+Н
2.В ФАД и ФМН рабочей частью является ФЛАВИИ (компонент витамина В2)
ФАД + 2Н + 2е = ФАДН2
3.УБИХИНОН легко переходит в восстановленную форму KOQ +2Н +2е =KOQ*H2
4.ЦИТОХРОМЫ - это ГЕТЕРОПРОТЕИНЫ. Их белковой частью является ГЕМ, структура которого представляет собой 4 ПИРРОЛЬНЫХ кольца и атом железа, который легко меняет валентность. Также могут включать медь.
ФЕРМЕНТЫ ДЫХАТЕЛЬНОЙ ЦЕПИ.
1 .ДГ субстратов находятся в цитоплазме клетки, могут быть в МАТРИКСЕ МИТОХОНДРИЙ.
2.НАДН-ДГ(ФМН).
3.KOQ
4.Q*H2 - ДГ (ЦИТОХРОМЫ в, с 1).
5.ЦИТОХРОМ с.
6.ЦИТОХРОМОКСИДАЗА участвует в передаче электронов на кислород (включает ЦИТОХРОМЫ а, а3).
ФУНКЦИОНИРОВАНИЕ ДЫХАТЕЛЬНОЙ ЦЕПИ.
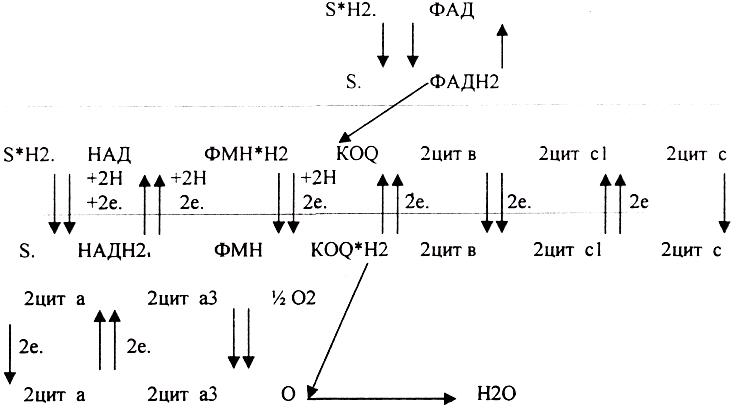
Полная ЭТЦ - взаимодействие субстрата с НАД. Укороченная ЭТЦ - взаимодействие субстрата с ФАД и последующий транспорт электронов и протонов сразу на КОФЕРМЕНТ Q,
Порядок компонентов дыхательной цепи обусловлен величиной их red-ox потенциалов. Он изменяется от -0,32В до +0,81В
-0,32 характерно для НАДН2
+0,81 характерно для О2.
ОКИСЛИТЕЛЬНОЕ ФОСФОРИЛИИАНИЕ.
В дыхательной цепи создаются условия для синтеза АТФ, т.е. выделяется достаточное количество энергии. Процесс образования АТФ из АДФ и Н3РО4 за счёт энергии переноса электронов дыхательной цепи называется ОКИСЛИТЕЛЬНЫМ ФОСФОРИЛИРОВАНИЕМ.
СУБСТРАТНОЕ ФОСФОРИЛИРОВАНИЕ - это процесс образования АТФ из АДФ и Н3РО4 за счёт энергии распада какого-либо субстрата. В дыхательной цепи выделяются 3 пункта, где может образоваться АТФ:
1.НАД KOQ
2.ЦИТ. в. ЦИТ. с
З.ЦИТ. а. ЦИТ. A3
НАДН2 — 3 АТФ
ФАДН2 — 2 АТФ
Процесс освобождения АТФ с транспортом электронов в дыхательной цепи называется
СОПРЯЖЕНИЕМ ОКИСЛЕНИЯ И ФОСФОРИЛИРОВАНИЯ. Но может быть разобщение
ОКИСЛИТЕЛЬНОГО ФОСФОРИЛИРОВАНИЯ (свободное окисление), т.е. окисление идёт, а
ФОСФОРИЛИРОВАНИЯ нет, вся энергия выделяется в виде тепла. Это обуславливает
ПИРОГЕННЫЙ эффект ряда лекарственных веществ.
Лекция № 9. Биологическое окисление (продолжение).
1 .МЕХАНИЗМ ОКИСЛИТЕЛЬНОГО ФОСФОРИЛИРОВАНИЯ.
2.АЛЬТЕРНАТИВНЫЕ ПУТИ БИОЛОГИЧЕСКОГО ОКИСЛЕНИЯ.
3.СВОБОДНО-РАДИКАЛЬНОЕ ОКИСЛЕНИЕ.
МЕХАНИЗМ ОКИСЛИТЕЛЬНОГО ФОСФОРИЛИРОВАНИЯ.
Теория ОКИСЛИТЕЛЬНОГО ФОСФОРИЛИРОВАНИЯ выдвинута английским учёным П. МИТЧЕЛОМ в 1961 г. и названа ХЕМИООСМОТИЧЕСКОЙ ТЕОРИЕЙ ОКИСЛИТЕЛЬНОГО ФОСФОРИЛИРОВАНИЯ. Он объяснил процесс синтеза АТФ с биохимической позиции, но его взгляды не получили признания. Однако в последующем его теория подтвердилась, и через 17 лет он был удостоен Нобелевской премии.
Основные положения теории:
1.Мембрана МИТОХОНДРИЙ не проницаема для протонов.
2.Образуется протонный потенциал в процессе транспорта электронов и протонов.
3.Обратный транспорт протонов в МАТРИКС сопряжен с образованием АТФ.
Процесс транспорта электронов происходит во внутренней мембране. Первые реакции окисления происходят в матрице. Протоны переносятся в межмембранное пространство, а электроны продвигаются по дыхательной цепи. В процессе работы дыхательной цепи внутренняя мембрана со стороны матрицы заряжается отрицательно, а со стороны межмембранного пространства положительно. Следовательно, возникает разность потенциалов, градиент концентрации ионов, и, соответственно, градиент РН. Т.о. РН со стороны матрицы будет менее кислая. Во время дыхания создаётся ЭЛЕКТРО-ХИМИЧЕСКИЙ градиент: концентрационный и разности потенциалов. Электрический и концентрационный градиент составляет ПРОТОНДВИЖУЩУЮ силу, которая даёт силу для синтеза АТФ. На определённых участках внутренней мембраны есть протонные каналы, образованные АТФ-СИНТЕТАЗОЙ. Протоны могут проходить обратно в матрицу, при этом образующаяся энергия идёт на синтез АТФ.
УСЛОВИЯ ОБРАЗОВАНИЯ АТФ.
1. Целостность мембраны - непроницаемость её для протонов.
2. Наличие специальных каналов.
3. Движение протонов в матрицу сопровождается выделением энергии, используемой для синтеза АТФ.
Вопрос о том, что позволяет протонам переходить в межмембранное пространство остаётся не вполне ясным.
Основные компоненты ЭТЦ представляют собой интегральные белки и фиксированные в мембране: 1.НАДН-ДГ.
2.QН2-ДГ.
3.ЦИТОХРОМОКСИДАЗА.
4.KOQ не связан с белками.
5.ЦИТОХРОМ с - не фиксирован к мембране.
Выдвигается теория Q-цикла транспорта протонов.
2Н + 2е + KOQ KOQ*H2
KOQ*H2 KOQ + 2Н + 2е - на наружной поверхности внутренней мембраны.
Т.о. в соответствии с ХЕМООСМОТИЧЕСКОЙ теорией МИТЧЕЛА окисление НАДН2 и ФАДН2 в дыхательной цепи создаёт сначала ЭЛЕКТРОНО-ХИМИЧЕСКИЙ протонный потенциал, градиент концентрации ионов на внутренней мембране, а обратный транспорт протонов через мембрану сопряжен с ФОСФОРИЛИРОВАНИЕМ, т.е. образованием АТФ.
АЛЬТЕРНАТИВНЫЕ ПУТИ БИОЛОГИЧЕСКОГО ОКИСЛЕНИЯ.
В организме возможен и ОКСИГЕНАЗНЫЙ путь биологического окисления. Он не относится к процессам, сопровождающимся выделением энергии, он не снабжает клетку энергией. Ферменты этого пути включают кислород и субстрат. Этот путь характерен для ДЕГИДРАТАЦИИ различных метаболитов, чаще всего чужеродных.
Стадии ОКСИГЕНАЗНОГО ПУТИ:
1.Связывание кислорода с активным центром фермента.
2.Восстановление кислорода и перенос его на субстрат.
Выделяют 2 типа ОКСИГЕНАЗ:
1.ДИОКСИГЕНАЗЫ - ферменты, включающие в субстрат молекулу кислорода.
А + О2 = АО2
В живых тканях этот процесс практически не встречается.
2.МОНООКСИГЕНАЗЫ - они катализируют включение в субстрат 1 атома кислорода, др. атом кислорода восстанавливается до воды. Для реакций катализируемых МОНООКСИГЕНАЗАМИ необходим КОСУБСТРАТ - донор электронов.
А-Н + О2 + ZH2 А-ОН + Z + Н2О
Где А-Н - субстрат
ZH2 - КОСУБСТРАТ
А-ОН - окисленный субстрат.
В организме есть несколько видов МОНООКСИГЕНАЗ и прежде всего МИКРОСОМАЛЬНЫЕ МОНООКСИГЕН АЗЫ, содержащие ЦИТОХРОМ Р-450.Т.к. образуется -ОН группа, то реакции называются ещё реакциями ГИДРОКСИЛИРОВАНИЯ. МИКРОСОМАЛЬНАЯ система участвует в деградации многих умеренно токсических соединений, лекарственных веществ. Восстановленным КОСУБСТРАТОМ в этих реакциях является НАДФ*Н2. Этот путь окисления иногда называют ГИДРОКСИЛАЗНЫМ ЦИКЛОМ.
СВОБОДНОЕ РАДИКАЛЬНОЕ ОКИСЛЕНИЕ.
Свободные радикалы - это молекулярные частицы, у которых на внешней оболочке имеется не спаренный электрон. Они могут образовываться: при окислении (отрывании атома водорода)
![]()
при восстановлении
О2 + е О2-
Атомарный кислород имеет на внешнем электронном уровне 2 неспареных электрона. Он
не слишком активный, но может образовывать высоко активные формы.
О2+4е + 4Н 2Н2О
Этот процесс, в тканях, идёт постепенно, с переносом 1е на каждом этапе.
О2 + е = 02- - СУПЕРОКСИДНЫЙ АНИОН
2-02 + 2е = 022- - ПЕРОКСИДНЫЙ АНИОН
НО, - ГИДРОКСИЛ РАДИКАЛ
Н2О2, О2-, О22-, ОН, - активные формы кислорода (АФК)
Они образуются в организме при различных физиологических и патологических процессах. Все свободные радикалы в организме классифицируют:
1. Первичные радикалы (О2, N,O). Они образуются в результате ферментативных реакций. Они являются физиологическими. Способствуют образованию РАДИКАЛОБРАЗНЫХ молекул, к которым относятся НООН, они вызывают образование вторичных радикалов.
2. Вторичные радикалы (ОН, ЛИПИДНЫЕ радикалы – L,, LO,, LOO,) Их образование происходит с участием железа (11). Это патологические продукты.
3. Третичные радикалы (АНТИОКСИДАНТЫ) - образуются под влиянием вторичных радикалов.
СУПЕРОКСИДНЫЙ АНИОН легко присоединяет Н+, е. Он хорошо растворяется в жирах, следовательно, следовательно, легко взаимодействует с ЛИПИДАМИ мембран, и особенно хорошо взаимодействует с ПОЛИНЕНАСЫЩЕННЫМИ ЖИРНЫМИ КИСЛОТАМИ, отнимая у них водород.
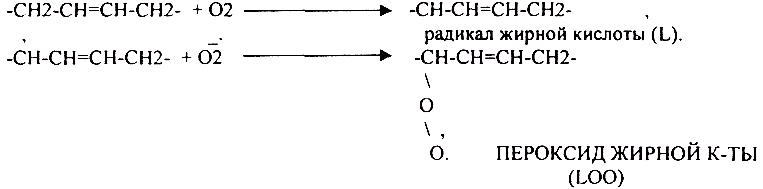
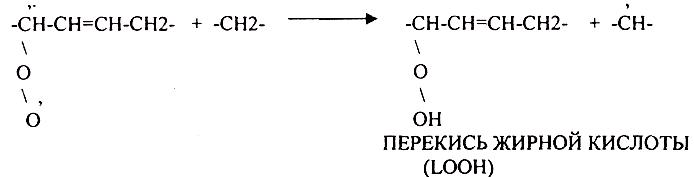
Этот процесс называется ПЕРЕКИСНЫМ ОКИСЛЕНИЕМ ЛИПИДОВ (ПОЛ). Это патологическое явление, приводящее к нарушению целостности мембран клеток. Процессы свободного радикального окисления идут в норме, но на низком уровне. Поэтому в организме есть система, которая предотвращает ПОЛ - АНТИОКИСЛИТЕЛЬНАЯ СИСТЕМА (АОС), препятствующая образованию свободных радикалов.
Она включает:
1 .Фермент - СУПЕРОКСИДДИСМУТАЗА (СОД).
![]()
ГЛУТАТИОНПЕРОКСИДАЗА (восстановление Н2О2 за счет окисления ГЛУТАТИОНА).
2.Альфа- ТОКОФЕРРОЛ (вит. Е) - основной не ферментный АНТИОКСИДАНТ.
3.УБИХИНОН.
4.МОЧЕВАЯ К-ТА.
5.БИЛИРУБИН.
6.ГЛУТАТИОН.
7.КОМПЛЕКСОНЫ ЖЕЛЕЗА (связывают железо, потенцирующего образование свободных радикалов).
СЕНЕРГИСТЫ АНТИОКСИДАНТОВ соединения, которые восстанавливают АНТИОКСИДАНТЫ, способствуя возвращению их в активную форму. В организме основным источником свободных радикалов являются фагоциты. При встрече фагоцита с чужеродным субстратом, он прикрепляется к нему и начинает выделять АФК. Они активируют свободно-радикальный процесс ПОЛ, поражают мембрану чужеродного агента, вызывая его гибель. К активации свободных радикалов в организме приводят:
1. НЕДОСТАТОК БИООКСИДАНТОВ.
2. ВНЕШНИЕ ФАКТОРЫ.
3. ХРОНИЧЕСКИЙ СТРЕСС.
4. ГИПОДИНАМИЯ.
5. ИЗБЫТОК ЖИРНОЙ ПИЩИ.
6. МНОГИЕ ПАТОЛОГИЧЕСКИЕ СОСТОЯНИЯ.
Лекция № 10. Обмен углеводов.
1. ОСНОВНЫЕ УГЛЕВОДЫ ЖИВОТНОГО ОРГАНИЗМА, ИХ КЛАССИФИКАЦИЯ И БИОЛОГИЧЕСКАЯ РОЛЬ.
2. ПРЕВРАЩЕНИЕ УГЛЕВОДОВ В ОРГАНАХ ПИЩЕВАРИТЕЛЬНОЙ СИСТЕМЫ.
3. БИОСИНТЕЗ И РАСПАД ГЛИКОГЕНА.
4. ГЛИКОГЕНОВЫЕ БОЛЕЗНИ.
ОСНОВНЫЕ УГЛЕВОДЫ ЖИВОТНОГО ОРГАНИЗМА.
Углеводы - это ПОЛИОКСИКАРБОНИЛЬНЫЕ соединения и их производные.
![]()
МОНОСАХАРИДЫ: ТРИОЗЫ (ГЛИЦЕРАЛЬДЕГИД, ДИОКСИАЦЕТОН), ТЕТРОЗЫ (ЭРИТРУЛОЗА), ПЕНТОЗЫ (РИБОЗА, ДЕЗОКСИРИБОЗА, КСИЛУЛОЗА), ГЕКСОЗЫ (ГЛЮКОЗА, ГАЛАКТОЗА, ФРУКТОЗА).
ОЛИГОСАХАРИДЫ (в состав молекулы входят 2-12 МОНОСАХАРИДОВ, соединённых между собой): МАЛЬТОЗА, ЛАКТОЗА, САХАРОЗА. ПОЛИСАХАРИДЫ делятся на ГОМОПОЛИСАХАРИДЫ и ГЕТЕРОПОЛИСАХАРИДЫ. ГОМОПОЛИСАХАРИДЫ - КРАХМАЛ, ГЛИКОГЕН. ГЕТЕРОПОЛИСАХАРИДЫ ХОНРОЭТИНСЕРНАЯ К-ТА, ГИАЛУРОНОВАЯ К-ТА, НЕЙРАМИНОВАЯ К-ТА, ГЕПАРИН.
БИОЛОГИЧЕСКАЯ РОЛЬ УВ.
1. ЭНЕРГЕТИЧЕСКАЯ. При окислении 1 гр. УВ до конечных продуктов (СО2 и Н2О) выделяется 4,1-ккал-60-70 % всей калорийности пищи. Суточная потребность в УВ для взрослого человека с массой 60-70 кг составляет около 400-500 гр.
2. Структурная. УВ используется как строительный материал для образования структурных компонентов клеток (ГЛИКОЛИПИДЫ, ГЛИКОПРОТЕИНЫ, ГЕТЕРОПОЛИСАХАРИДЫ межклеточного вещества).
3.Резервная. УВ в виде гликогена могут откладываться в запас.
4. Защитная. ГЛИКОПРОТЕИНЫ принимают участие в образовании антител. ГИАЛУРОНОВАЯ К-ТА препятствует проникновению чужеродных веществ. ГЕТЕРОПОЛИСАХАРИДЫ участвуют в образовании слизи слизистых оболочек дыхательных путей, ЖКТ.
5. Регуляторная. Некоторые гормоны являются ГЛИКОПРОТЕИНАМИ (ТИРИОГЛОБУЛИН)
6.Участвуют в процессах распознавания клеток (СИАЛОВАЯ и НЕЙРОЛИНОВАЯ К-ТЫ).
7 Входя в состав оболочек эритроцитов, определяют группы крови.
8. Участвуют в процессах свёртывания крови, входя в состав ФИБРИНОГЕНА и ПРОТРОМБИНА. Препятствуют свёртыванию крови, входя в состав ГЕПАРИНА.
ПРЕВРАЩЕНИЕ УГЛЕВОДОВ В ОРГАНАХ ПИЩЕВАРИТЕЛЬНОЙ СИСТЕМЫ.
Основными УВ для организма человека являются УВ пищи: крахмал, сахароза, лактоза.
Поступивший с пищей крахмал в ротовой полости будет подвергаться гидролизу под действием альфа -АМИЛАЗЫ слюны. Она расщепляет альфа (1,4)-ГЛИКОЗИДНЫЕ связи. РН оптимум в слабощелочной среде (6,8). Поскольку пища в ротовой полости задерживается недолго, то крахмал здесь переваривается лишь частично. Гидролиз крахмала завершается образованием АМИЛОДЕКСТРИНОВ (с йодом дают фиолетовое окрашивание). Далее пища поступает в желудок. Слизистой оболочкой желудка ГЛИКОЗИДАЗЫ не вырабатываются. В желудке среда резко кислая, поэтому действие альфа -АМИЛАЗЫ прекращается. Однако в более глубоких слоях действие фермента продолжается (пищевой комок полностью желудочным соком не пропитывается), крахмал проходит следующую стадию гидролиза- ЭРИТРОДЕКСТРИНОВ (с йодом дают красное окрашивание). Основным местом переваривания крахмала служит тонкий отдел кишечника. Здесь наиболее важная фаза гидролиза крахмала. В 12 п.к. открываются протоки ПЖЖ. Под действием фермента в её секрете будет идти гидролиз крахмала. Выделяющийся панкреатический сок содержит БИКАРБОНАТЫ, которые нейтрализуют желудочное кислое содержимое. Образующийся при этом Н2СОЗ распадается. СО2 «вспенивает» пищевой комок, способствуя его перемешиванию. Создаётся слабощелочная среда. Катионы натрия и калия способствуют активации панкреатических ГЛИКОЗИДАЗ: альфа -АМИЛАЗЫ, АМИЛО-1,6-ГЛИКОЗИДАЗЫ, ОЛИГО-1,6-ГЛИКОЗИДАЗЫ. Эти ферменты завершают гидролитический разрыв внутренних ГЛИКОЗИДНЫХ связей. ЭРИТРОДЕКСТРИНЫ переходят в ОХРОДЕКСТРИНЫ (с йодом жёлтое окрашивание).
Альфа -АМИЛАЗА завершает разрыв внутренних альфа(1,4)-ГЛИКОЗИДНЫХ связей с образованием ДИСАХАРИДОВ (МАЛЬТОЗ). Альфа(1,6)-ГЛИКОЗИДНЫЕ связи в точках ветвления крахмала гидролитически расщепляются под действием АМИЛО-(1,6)-ГЛИКОЗИДАЗЫ и ОЛИГО-(1,6)-ГЛИКОЗИДАЗЫ, которая является терминальной в этом процессе. Т.о. 3 панкреатических фермента завершают гидролиз крахмала в кишечнике с образованием МАЛЬТОЗ. Образованная МАЛЬТОЗА - временный продукт гидролиза, т.к. она в клетках кишечника быстро гидролизуется под действием МАЛЬТАЗ. Из тех же остатков, которые в молекулах крахмала были соединены альфа(1,6)-ГЛИКОЗИДНЫМИ связями, образуются ДИСАХАРИДЫ -ИЗОМАЛЬТОЗЫ. Они будут гидролизоваться ИЗОМАЛЬТАЗАМИ. В составе пищи в организм человека поступают и ДИСАХАРИДЫ: лактозы и сахарозы, которые подвергаются гидролизу только в тонком кишечнике. В ЭНТЕРОЦИТАХ синтезируются ЛАКТАЗЫ и САХАРАЗЫ, которые осуществляют гидролиз с образованием глюкозы, галактозы, фруктозы.
Продукты полного гидролиза - МОНОСАХАРИДЫ - всасываются в кровь. На этом завершается начальный этап пищеварения. С пищей в организм человека поступает клетчатка, которая в ЖКТ не переваривается, поскольку отсутствуют бета -ГЛИКОЗИДАЗЫ. Однако биологическая роль клетчатки велика: 1.формирование пищевого комка,
2.она раздражает слизистую оболочку ЖКТ, усиливая секрецию желёз.
3.усиливает сокращение кишечника,
4.в толстом кишечнике под действием ферментов условно-патогенной микрофлоры клетчатка подвергается брожению с образованием глюкозы, лактозы и газообразных веществ.
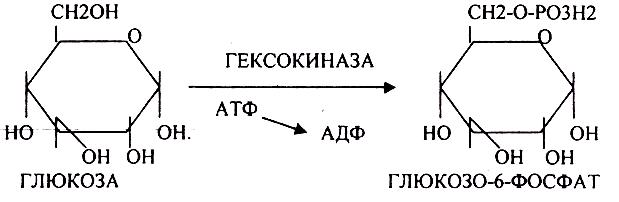
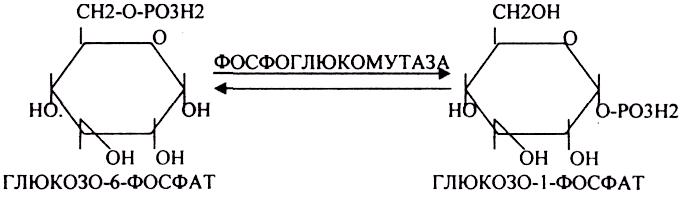
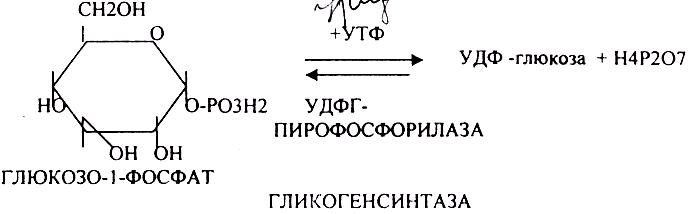
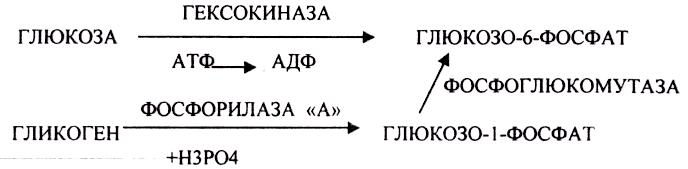
БИОСИНТЕЗ ГЛИКОГЕНА.
Было установлено, что гликоген может синтезироваться практически во всех органах и тканях. Однако наибольшая его концентрация обнаружена в печени (2-6%) и мышцах (0,5-2%). Т.к. мышечная масса велика, то большая часть гликогена содержится в мышцах. Глюкоза из крови легко проникает в клетки органов и тканей, проходя через биологические мембраны клеток. Как только глюкоза заходит в клетку, она запирается в ней в результате первой метаболической реакции - ФОСФОРИЛИРОВАНИЕ в присутствии АТФ и фермента -ГЕКСОКИНАЗЫ. Глюкоза превращается в глюкозо-6-фосфат. Теперь он будет использоваться в АНАБОЛИЧЕСКИХ и КАТАБОЛИЧЕСКИХ реакциях. Глюкоза из клетки может выйти, если в реакции гидролиза при участии глюкозо-6-фосфатазы освободится от остатка фосфорной кислоты. Этот фермент находится в печени, почках, эпителии кишечника. В других органах его нет. Проникновение глюкозы в клетки этих органов и тканей необратимы. Процесс биосинтеза протекает в 4 стадии:
![]()
![]()
ГЛИКОГЕНСИНТАЗА - ТРАНСФЕРАЗА, которая переносит остатки глюкозы, входящие в УДФ- глюкозу, на ГЛИКОЗИДНУЮ связь остаточного в клетке гликогена, при этом образуется альфа(1,4)-ГЛИКОЗИДНЫЕ связи. Образование альфа(1,6)-ГЛИКОЗИДНЫХ связей в точках ветвления гликогена катализирует специальный ГЛИКОГЕН-ВЕТВЯЩИЙ фермент. Образовавшийся в последней реакции УДФ, превращается в УТФ, при этом поглощается I молекула АТФ. На каждую молекулу глюкозы, включающуюся в структуру гликогена, расходуется 2 молекулы АТФ. Гликоген в клетках накапливается во время пищеварения и рассматривается как резервная форма глюкозы, которая используется клетками в промежутках между приёмами пищи.
РАСПАД ГЛИКОГЕНА. Может идти 2 путями:
1. ОСНОВНОЙ ФОСФОРОЛИТИЧЕСКИЙ ПУТЬ
Он протекает в печени, почках, эпителии кишечника. Схематично можно записать в виде 3 реакций.
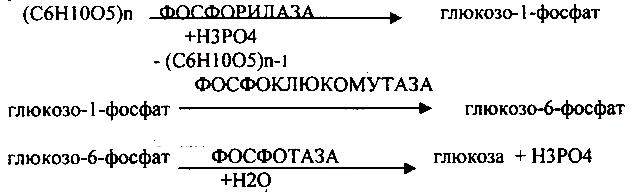
2.НЕОСНОВНОЙ АМИЛОЛИТИЧЕСКИЙ.
Его доля мала и незначительна. Протекает в печени при участии 3 ферментов: альфа -
АМИЛАЗА, АМИЛО-1,6-ГЛИКОЗИДАЗА, гамма -АМИЛАЗА.
ГЛИКОГЕНОВЫЕ БОЛЕЗНИ.
Это наследственное нарушение обмена гликогена, которое связано с недостатком какого-либо из ферментов, участвующих в синтезе или распаде гликогена. Как правило эта недостаточность выражается либо в снижении активности, либо в полном отсутствии какого либо фермента. ГЛИКОГЕНОЗЫ - болезни, связанные с нарушением процессов распада гликогена, при этом в клетках печени, почек, мышц гликоген накапливается в большом количестве. Клинически проявляются увеличением печени, мышечной слабостью, ГИПОГЛЮКОЗЭМИЕЙ натощак. В норме уровень глюкозы в крови равен 3,3 - 5,5 ммоль/л. Смерть наступает в раннем детском возрасте. Наиболее часто встречаются:
1.болезнь ФЕРСА - ФОСФОРИЛАЗА ПЕЧЕНИ.
2.Болезнь МАК-АРДЛЯ - ФОСФОРИЛАЗА МЫШЦ.
3.Болезнь ПОМПЕ- альфа- 1,4-ГЛИКОЗИДАЗА.
4.Болезнь КОРИ - АМИЛО-1.6-ГЛИКОЗИДАЗА.
5.Болезнь ГИРКЕ - ГЛЮКОЗО-6-ФОСФОТАЗА.
АГЛИКОГЕНОЗЫ характеризуются признаками нарушения синтеза. Клинически проявляются резкой ГИПОГЛЮКОЗЭМИЕЙ натощак, рвотой, судорогами, потерей сознания, углеводное голодание клеток, следовательно, отставание психо-физического развития, смерть в раннем детском возрасте. Наиболее часто встречаются:
1 . болезнь ЛЬЮИСА - ГЛИКОГЕНСИНТЕТАЗА.
2. Болезнь АНДЕРСЕНА - ГЛИКОГЕН-ВЕТВЯЩИЙ фермент.
Лекция №11. Обмен углеводов (продолжение).
1. АНАЭРОБНЫЙ ГЛИКОЛИЗ, ХИМИЗМ РЕАКЦИИ И БИОЛОГИЧЕСКАЯ РОЛЬ.
2.АЭРОБНЫЙ ГЛИКОЛИЗ, (ГЕКСОЗОДИФОСФАТНЫЙ ПУТЬ), ХИМИЗМ РЕАКЦИИ И БИОЛОГИЧЕСКАЯ РОЛЬ.
В зависимости от функционального состояния организма, клетки органов и тканей могут находиться в условиях достаточного снабжения кислородом, так и испытывать кислородное голодание. Т.о. катоболизм глюкозы или глюкозного остатка гликогена может рассматриваться с двух позиций:
1.В АНАЭРОБНЫХ УСЛОВИЯХ
2.В АЭРОБНЫХ УСЛОВИЯХ.
АНАЭРОБНЫЙ ГЛИКОЛИЗ протекает в цитоплазме клеток. Окисление глюкозы или глюкозного остатка гликогена всегда завершается образованием конечного продукта этого процесса- молочной кислоты.
Окисление глюкозы и глюкозного остатка гликогена в тканях отличается начальных стадиях превращения, до образования глюкозо-6-фосфата. Дальнейшее окисление с этого этапа в тканях как в АНА-, так и в АЭРОБНЫХ условиях полностью совпадает до стадии образования ПИРУВАТА.
Процесс АНАЭРОБНОГО ГЛИКОЛИЗА сложный и многоступенчатый. Условно его можно
разделить на 2 стадии:
-первая стадия заканчивается образованием из ГЕКСОЗЫ двух ТРИОЗ -ДИОКСИАЦЕТОНФОСФАТА и ГЛИЦЕРАЛЬДЕГИД-3-ФОСФАТА.
-Вторая стадия наиболее важная. Её называют стадией ГЛИКОЛИТИЧЕСКОЙ ОКСИДОРЕДУКЦИИ. Она сопряжена с образованием АТФ за счёт реакций СУБСТРАТНОГО ФОСФОРИЛИРОВАНИЯ, окислением ГЛИЦРАЛЬДЕГИД -3-ФОСФАТА, восстановлением ПИРУВАТА до ЛАКТАТА.
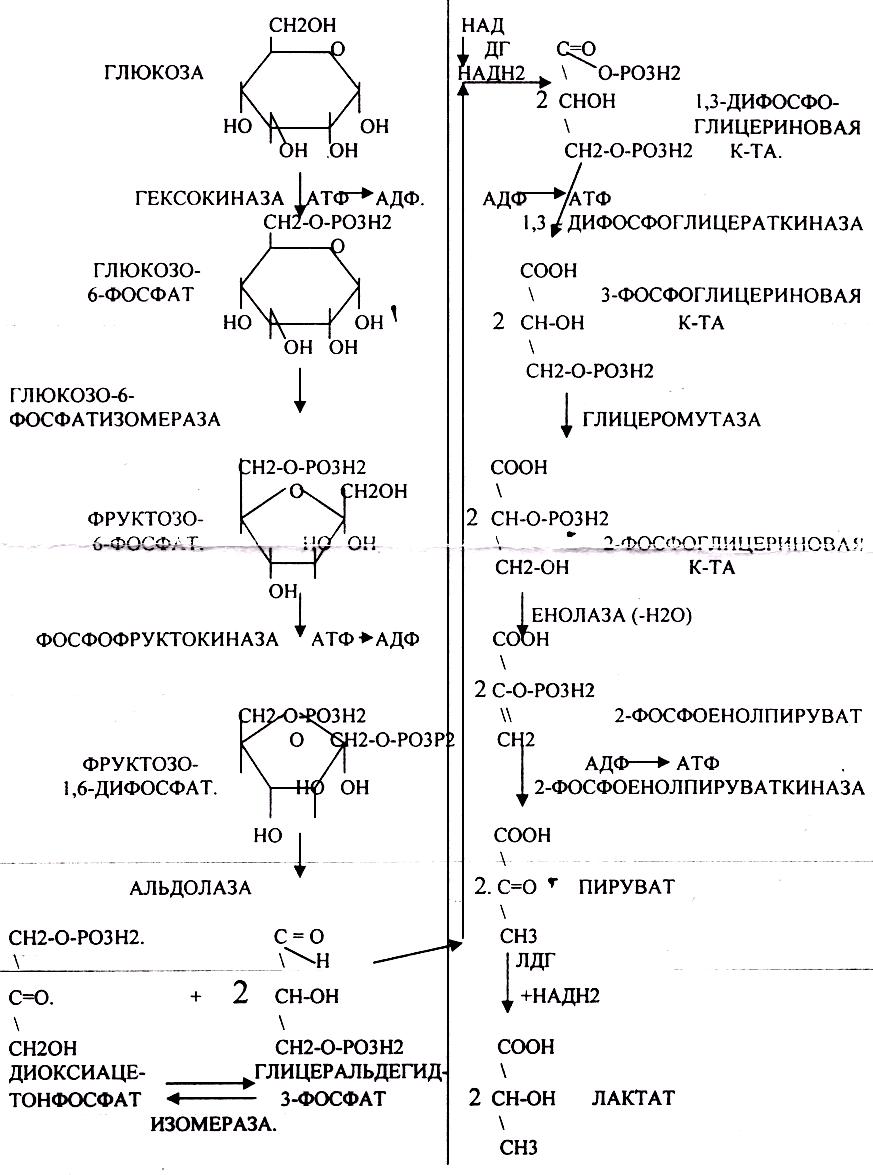
Т.о. окислительный процесс в без кислородных условиях завершается образованием ЛАКТАТА. В процессе превращения глюкозы было израсходовано 2 молекулы АТФ (ГЕКСОКИНАЗНАЯ и ФОСФОФРУКТОКИНАЗНАЯ реакции). С этапа образования ТРИОЗ идёт одновременное их окисление. В результате этих реакций образуется энергия в виде АТФ за счёт реакций СУБСТРАТНОГО ФОСФОРИЛИРОВАНИЯ (ГЛИЦЕРАТКИНАЗНАЯ и ПИРУВАТКИНАЗНАЯ).
На этапе ГЛИКОЛИТИЧЕСКОЙ ОКСИДОРЕДУКЦИИ идёт окисление ГЛИЦЕРАЛЬДЕГИД-3-ФОСФАТА в присутствии НЗРО4 и НАД- зависимой ДГ. которая на этом этапе восстанавливается до НАДН2. МИТОХОНДРИИ в АНАЭРОБНЫХ условиях блокированы, поэтому НАДН2 находится в среде до тех пор, пока не образуется субстрат, способный принять его. ПВК, принимая НАДН2, восстанавливается с образованием ЛАКТАТА, завершая тем самым внутренний-окислительно-восстановительный этап ГЛИКОЛИЗА. НАД окисленный выделяется и может участвовать в окислительном процессе, выполняя роль переносчиков водорода.
3 реакции ГЛИКОЛИЗА являются необратимыми:
1.ГЕКСОКИНАЗНАЯ.
2.ФОСФОФРУКТОКИНАЗНАЯ.
3.ПИРУВАТКИНАЗНАЯ.
Энергетический эффект глюкозы и глюкозного остатка гликогена:
АТФ = (2*2)-2 = 2 глюкоза
АТФ = (2*2)-1 =3 гликоген
Биологическая роль АНАЭРОБНОГО ГЛИКОЛИЗА энергетическая. АНАЭРОБНЫЙ ГЛИКОЛИЗ является единственным процессом продуцирующим энергию в форме АТФ в клетке в бес кислородных условиях в кризисных ситуациях. А в эритроцитах ГЛИКОЛИЗ является единственным процессом поддерживающим биоэнергетику, для сохранения их функции и целостности.
ГЕКСОЗОДИФОСФАТНЫЙ ПУТЬ - это аэробное превращение глюкозы в тканях. При поступлении кислорода в клетки происходит подавление анаэробного ГЛИКОЛИЗА. При этом понижается потребление глюкозы, блокируется образование ЛАКТАТА. Эффект торможения анаэробного гликолиза дыханием получил название эффекта ПАСТСРА. Процесс окисления начинается в цитоплазме до стадии образования ПИРУВАТА. Затем ПВК поступает в МИТОХОНДРИИ, где в матрице подвергается ОКИСЛИТЕЛЬНОМУ ДЕКАРБОКСИЛИРОВАНИЮ. Образующийся АЦЕТИЛ-КОА поступает для дальнейшего окисления в основной метаболический ЦТК КРЕБСА. С участием ферментов ЦТК и сопряженных с ним ферментов дыхательной цепи происходит образование конечных продуктов (СО2 иН2О) и выделяется 38 АТФ, а при окислении глюкозного остатка гликогена - 39 АТФ. Н2О образуется на этапе превращения:
1. ГЛИЦЕРАЛЬДЕГИД-3-ФОСФАТ
2. 2-ФОСФОГЛИЦЕРИНОВАЯ К-ТА
3. ПИРУВАТА
4. Альфа- КЕТОГЛУТАРОВАЯ К-ТА
5. СУКЦИНАТ
4. ИЗОЦИТРАТ
7. МАЛАТ
СО2 образуется на этапе превращения:
1. ПИРУВAT
2. ОКСАЛОСУКЦИНАТ
3. Альфа - КЕТОГЛУТАРОВАЯ К-ТА. АТФ образуется:
А. За счёт реакций субстратного ФОСФОРИЛИРОВАНИЯ на этапе превращения:
1. 1,3-ДИФОСФОГЛИЦЕРИНОВАЯ К-ТА
2. 2-ФОСФОЕНОЛПИРУВАТ
3. СУКЦИНИЛ-КОА
В. За счёт реакций ОКИСЛИТЕЛЬНОГО ФОСФОРИЛИРОВАНИЯ на этапе превращения:
1. ГЛИЦЕРАЛЬДЕГИД-3-ФОСФАТ
2. ПИРУВАТ
3. ИЗОЦИТРАТ
4. альфа -КГК
5. СУКЦИНАТ
6. МАЛАТ.
Энергетический эффект окисления глюкозы и глюкозного остатка гликогена в аэробных условиях:
АТФ = 2*(3+1 +1 +3+12) - 2 = 38 глюкоза
АТФ = 2*(3+1+ 1 +3+12) - 1 =39 гликоген
Лекция
№
12.
Обмен углеводов (продолжение).
1.ГЕКСОЗОМОНОФОСФАТНЫЙ ПУТЬ ПРЕВРАЩЕНИЯ УГЛЕВОДОВ В ТКАНЯХ. ХИМИЗМ РЕАКЦИЙ, БИОЛОГИЧЕСКАЯ РОЛЬ.
2.ОСНОВНЫЕ ИСТОЧНИКИ ГЛЮКОЗЫ ДЛЯ ОРГАНИЗМА ЧЕЛОВЕКА, ГЛЮКОНЕОГЕНЕЗ И ЕГО БИОЛОГИЧЕСКАЯ РОЛЬ.
3.ПАТОЛОГИЯ УГЛЕВОДНОГО ОБМЕНА.
ГЕКСОЗОМОНОФОСФАТНЫЙ ПУТЬ (ПЕНТОЗНЫЙ, АПОТОМИЧЕСКИЙ) протекает в цитоплазме клетки и представлен 2 ветвями: окислительной и неокислительной. Особенно активно этот путь протекает в тех органах и тканях, в которых активно синтезируются жиры (печень, почки, жировая и эмбриональная ткань, молочные железы). Биологическая роль этого пути окисления глюкозы связывается прежде всего с производством двух веществ:
1.НАДФ*Н2, который в отличии от НАДН2 не используется вдыхательной цепи МИТОХОНДРИЙ, а поступает клетке для реакций синтеза и восстановления веществ.
2.РИБОЗО-5-ФОСФАТА и др. ПЕНТОЗ, которые используются в клетке для синтеза важнейших биологических молекул: ДНК, РНК, НТФ (АТФ, ГТФ, ЦТФ, ТТФ),Н5КОА, НАД, ФАД).
Следовательно, основная биологическая роль - АНАБОЛИЧЕСКАЯ. Неокислительная стадия ПЕНТОЗНОГО ПУТИ окисления глюкозы даёт субстраты, которые в анаэробных условиях поддерживают ГЛИКОЛИЗ (ФРУКТОЗО-6-ФОСФАТ, ГЛИЦЕРАЛЬДЕГИД-3-ФОСФАТ). Т.о. поддерживается биоэнергетика клетки в ГИПОКСИЧЕСКИХ ситуациях. Окислительная стадия представляет 5 реакций и предусматривает образование ПЕНТОЗ. ГЕКСОЗОМОНОФОСФАТНЫЙ путь отличается от ГЕКСОЗОДИФОСФАТНОГО пути с этапа превращения глюкозо-6-фосфата.
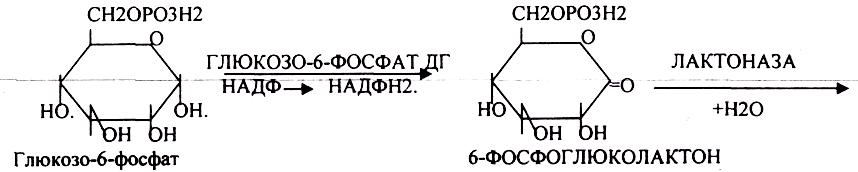

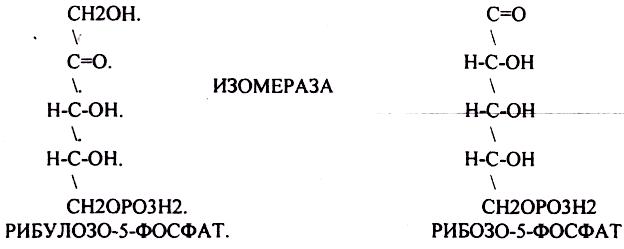
При определенных условиях на этом заканчивается окислительная стадия. Между ПЕНТОЗАМИ устанавливается подвижное равновесие.
![]()
Неокислительная стадия ГЕКСОЗОМОНОФОСФАТНОГО пути представлена двумя ТРАНСКЕТЛАЗНЫМИ реакциями и одной ТРАНСАЛЬДОЛАЗНОЙ. Особенно активно эти реакции протекают в анаэробных условиях. В результате этих реакций образуются субстраты для ГЛИКОЛИЗА, а также вещества характерные для ПЕНТОЗНОГО пути.
1. ТРАНСКЕТОЛАЗНЫЕ реакции:
![]()
2. ТРАНСАЛЬДОЛАЗНАЯ реакция:
А) СЕДОГЕПТУЛОЗО-7-Ф + ГЛИЦЕРАЛЬД-3-Ф = ФРУКТОЗО-6-Ф + ЭРИТРОЗО-4-Ф.
Было установлено, что за счёт ГЕКСОЗОМОНОФОСФАТНОГО пути клетки на 100% обеспечиваются ПЕНТОЗАМИ, на 50% - молекулами НАДФ*Н2. Баланс окислительной и неокислительной стадий ПЕНТОЗНОГО пути превращения ПЕНТОЗЫ можно записать в виде суммарного уравнение:
![]()
Основные источники глюкозы для организма человека:
1. УВ пищи,
2. гликоген тканей
3. ГЛЮКОНЕОГЕНЕЗ.
ГЛЮКОНЕОГЕНЕЗ - это биосинтез глюкозы из не углеводных предшественников, главными из которых являются ПИРУВАТ, ЛАКТАТ, ГЛИЦЕРИН, ряд АК (АСП, ФЕН, АЛА, ТИР, ТРИ, ВАЛ, ЛЕЙ, ИЛЕ, МЕТ, ПРО, ГИС, АРГ), тем или иным путем превращающиеся в метаболит ЦТК - ФУМАРАТ, который в дальнейшем превращается в ЩУК. Другие АК превращаются в ПИРУВАТ –субстрат ГЛЮКОНЕОГЕНЕЗА, ГЛЮКОНЕОГЕНЕЗ возможен не во всех тканях. Главным местом синтеза глюкозы является печень, в меньшей степени процесс идёт в почках и слизистой кишечника. ГЛЮКОНЕОГЕНЕЗ обеспечивает синтез глюкозы, а также возврат ЛАКТАТА, образованного в реакциях анаэробного ГЛИКОЛИЗА, в клеточный фонд углеводов. За счет этого процесса поддерживается уровень глюкозы при углеводном голодании, сахарном диабете. Большинство реакций ГЛЮКОНЕОГЕНЕЗА представляют собой обратные реакции ГЛИКОЛИЗУ, за исключением трёх (ГЕКСОКИНАЗНОЙ, ФОСФОФРУКТОКИНАЗНОЙ, ПИРУВАТКИНАЗНОЙ), которые при ГЛКЖОНЕОГЕНЕЗЕ имеют обходные пути. Первая обходная реакция ГЛЮКОНЕОГЕНЕЗА связана с образованием 2-ФОСФОЕНОЛ ПВК и протекает в две стадии:


Вторая обходная реакция связана с образованием фруктозо-6-фосфата.
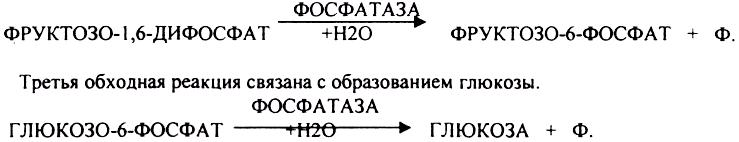
Образовавшаяся глюкоза может вновь использоваться клетками как пластический и энергетический материал, откладываться про запас в виде гликогена. В организме взрослого человека за сутки может быть образованно 80 гр. глюкозы.
ПАТОЛОГИЯ УГЛЕВОДНОГО ОБМЕНА.
Глюкоза является основным углеводом пищи, который используется всеми тканями для метаболизма. Концентрация глюкозы в крови для взрослого человека с массой 70 кг. составляет 3,3-5,5 ммоль/л.
Концентрация глюкозы в крови поддерживается за счёт УВ пищи, гликогена тканей и ГЛЮКОНЕОГЕНЕЗА и зависит от содержания УВ в пище, частоты приёма пищи и интенсивности затрат энергии. Нарушение углеводного обмена может быть на различных этапах. Объективными показателями этих нарушений является нарушение доступных биологических сред на содержание глюкозы. ГИПО-, ГИПЕРГЛЮКОЗЭМИЯ, ГЛЮКОЗУРИЯ является показателями углеводного иомена. ГЛЮКОЗУРИЯ возможна в том случае, если превышается величина почечного порога больше 10 ммоль/л.
Наиболее часто нарушения углеводного обмена возможны на следующих этапах:
1.на этапе поступления углеводов с пищей. Причины, которые могут вести к АЛИМЕНТАРНОМУ ОЖИРЕНИЮ, связаны прежде всего с употреблением пищи богатой углеводами и малоподвижным образом жизни, когда интенсивность окисления понижается. Большая нагрузка углеводов ведёт к переполнению резервом гликогена клеток печени, мышц, развитию ГИПЕРГЛЮКОЗЕМИИ, ГЛЮКОЗУРИИ, усиленному биосинтезу жира, развитию ожирения.
2.При поражении слизистых оболочек ЖКТ. При поражении слизистой желудка нарушается выработка соляной кислоты. Она обладает антибактериальным действием. Поступающие с пищей углеводы при недостатке соляной кислоты под действием ферментов микрофлоры сбраживаются с образованием ЛАКТАТА, что создаёт благоприятные условия для развития анаэробной микрофлоры и расстройства пищеварения в целом. При поражении слизистой оболочки тонкого отдела кишечника нарушается всасывание и гидролиз ДИСАХАРИДОВ пищи: переваривание МАЛЬТОЗ, ЛАКТОЗ, САХАРОЗ, а также транспорт глюкозы, галактозы, фруктозы через БИОМЕМБРАНУ ЭНТЕРОЦИТОВ в капиллярную сеть. При поражении ПЖЖ нарушается переваривание гликогена, крахмала пищи под влиянием ферментов.
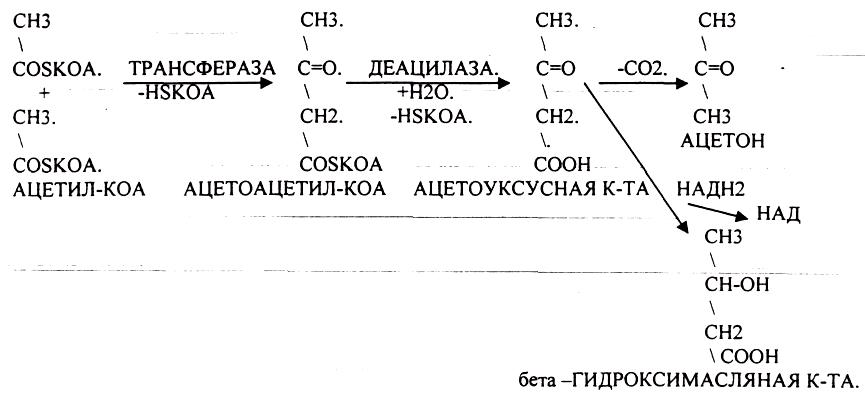
Наиболее грозным заболеванием, ведущим к нарушению углеводного обмена, является сахарный диабет. В ПЖЖ в В -клетках синтезируется белок - инсулин, который обеспечивает транспорт глюкозы из крови в ткани. В случае недостаточной выработки инсулина развивается ГИПЕРГЛЮКОЗЕМИЯ, ГЛЮКОЗУРИЯ, КЕТОНУРИЯ. В клетках развивается энергетический голод, который компенсируется за счёт процессов ГЛЮКОНЕОГЕНЕЗА и усиления процессов окисления белков и жиров, что сопровождается избыточной продукцией АЦЕТИЛ-КОА, NH3. NH3 токсичный продукт, для связывания которого откликаются основные КЕТОКИСЛОТЫ цикла КРЕБСА, а это в свою очередь понижает интенсивность окислительных процессов и создаёт предпосылки для конденсации АЦЕТИЛ-КОА и образования кетоновых тел (АЦЕТОУКСУСНАЯ К-ТА, АЦЕТОН, бета -ГИДРОКСИМАСЛЯНАЯ К-ТА).
При поражении печени нарушается процесс биосинтеза и распада гликогена. Наследственные заболевания наблюдаются при генетических дефектах ферментов, участвующих в метаболизме углеводов. Наиболее часто встречаются ГЛИКОГЕНОЗЫ (ГИРКЕ, ПОМПЕ) и АГЛИКОГЕНОЗЫ (ЛЬЮИСА, АНДЕРСЕНА), которые связаны с недостаточной активностью или полным отсутствием ферментов, участвующих в распаде или синтезе гликогена. У детей встречается АЛАКТОЗИЯ - непереносимость лактозы в виду генетического дефекта ЛАКТАЗЫ ЭНТЕРОЦИТОВ. Наблюдается вздутие живота, обезвоживание, резкое похудание. Лечение заключается в замене лактозы на другие сахара.
Лекция№ 13. Обмен ЛИПИДОВ.
1.ЛИПИДЫ, ИХ КЛАССИФИКАЦИЯ И БИОЛОГИЧЕСКАЯ РОЛЬ.
2.ПРЕВРАЩЕНИЕ ЛИПИДОВ В ОРГАНАХ ПИЩЕВАРЕНИЯ.
З.ЖЕЛЧНЫЕ КИСЛОТЫ, ИХ БИОЛОГИЧЕСКАЯ РОЛЬ. РЕСИНТЕЗ ЖИРА В СТЕНКАХ
КИШЕЧНИКА.
ЛИПИДАМИ называются сложные органические вещества биологической природы нерастворимые в воде, но растворимые в органических растворителях. ЛИПИДЫ являются основным продуктом питания. Они поступают в организм с продуктами растительного и животного происхождения. Суточная потребность в ЛИПИДАХ для взрослого человека составляет 80-100 гр.
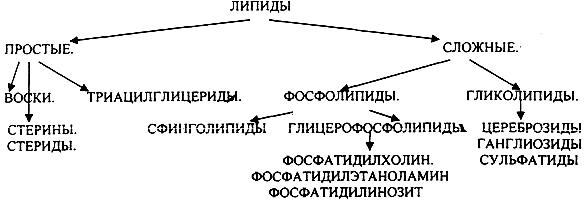
Воска - это сложные эфиры одно- или двухатомных спиртов с количеством углеводных звеньев в цепи 16-35 и ВЖК. Они входят в состав ЛИПИДОВ, покрывающих листья и плоды растений, шерсть животных, перья птиц. К природным воскам относятся пчелиный воск, спермацет, ланолин. В организме человека ЛИПИДЫ представлены:
1.структурными липидами.
2.резервными липидами.
3.свободными липидами. — хиломикроны,
- липопротеины низкой плотности (лпнп),
- липопротеины очень низкой плотности (лпонп),
- липопротеины высокой плотности (лпвп).
ЛИПИДЫ - трудно растворимые в воде вещества, поэтому для транспорта их кровью нужны —специальные-транспортные частицы. Ими являются ЛИПОПРОТЕИНЫ крови, где роль стабилизатора выполняют белки. ЛИПОПРОТЕИНЫ осуществляют транспорт ЛИПИДОВ от органов и тканей, где они синтезируются к местам их потребления. С их помощью осуществляется транспорт ВЖК и жирорастворимых витаминов A, D, Е, К..
БИОЛОГИЧЕСКАЯ РОЛЬ ЛИПИДОВ.
1 .Структурная. ЛИПИДЫ являются обязательным структурным компонентом биологических мембран клеток.
2.Резервная. ЛИПИДЫ могут откладываться в запас.
3.Энергетическая. Было установлено, что при окислении 1 гр. ЛИПИДОВ до конечных продуктов выделяется 9,3 ккал энергии.
4.Механическая. ЛИПИДЫ подкожной жировой клетчатки, соединительной ткани предохраняют внутренние органы от механических повреждений.
5 .Теплоизолирующая. Защищают организм от переохлаждения и перегревания.
6.Транспортная. ЛИПИДЫ мембран клеток участвуют в транспорте катионов.
7.Регуляторная. Некоторые гормоны являются СТЕРОИДАМИ (АНДРОГЕНЫ, ЭСТРОГЕНЫ, ГЛЮКО- и МИНЕРАЛОКОРТИКОИДЫ), «Местные» гормоны - ПРОСТАГЛАНДИНЫ, ПРОСТАЦИКЛИНЫ, тромбоксаны, лейкотриены образуются в организме из ПОЛИНЕНАСЫЩЕННЫХ ВЖК, входящих в состав ЛИПИДОВ.
8.Участвуют в передаче нервного импульса.
9.Являются источником эндогенной воды. При окислении 100 гр. ЛИПИДОВ выделяется 107гр эндогенной воды.
10.Растворяющая роль. В ЛИПИДАХ растворяются витамины A, D, E, К.
11.Питательная. С пищей в организм поступают незаменимые ВЖК, которые имеют 2 и более связи (ЛИНОЛЕВАЯ, ЛИНОЛЕНОВАЯ, АРАХИДОНОВАЯ).
БИОЛОГИЧЕСКАЯ РОЛЬ ПОЛИНЕНАСЫЩЕННЫХ ВЖК:
1. Они являются обязательным структурным компонентом мембран клеток.
2. Являются источником гормон подобных веществ.
3. Стимулируют синтез желчных кислот в печени.
4. Предупреждают развитие атеросклероза, ограничивая всасывание холестерина пищи в кишечнике, тормозя образование АТЕРОГЕННОЙ фракции ЛИПОПРОТЕИНОВ.
5. Понижают свёртываемость крови и уменьшают возможность тромб образования.
6. Повышают защитные силы организма.
ПЕРЕВАРИВАНИЕ ЛИПИДОВ.
Поступающие с пищей ЛИПИДЫ в ротовой полости подвергаются только механической переработке. ЛИПОЛИТИЧЕСКИЕ ферменты - ЭСТЕРАЗЫ - в ротовой полости не образуются. Переваривание жиров у взрослого человека будет происходить в кишечнике, где для этого имеются все условия:
1. Наличие желчных кислот.
2. Наличие ферментов.
3. Оптимальная рН среды.
У детей до 1 года в кишечнике выделяется ЛИПАЗА, рН оптимум которой = 5-5,5. Под влиянием этого фермента расщепляются только жиры молока. У взрослого человека она не активна, т.к. рН желудочного содержимого =1,5 - 2,5. Следовательно, переваривание жиров в желудке не происходит (в норме).
Переваривание ЛИПИДОВ пищи в кишечнике происходит при наличии желчных кислот, образованных печенью, и ЛИПОЛИТИЧЕСКИХ ферментов ПЖЖ. При поступлении пищи из желудка в двенадцатиперстную кишку в слизистой оболочке тонкой кишки начинают выделяться регуляторы: СЕКРЕТИН, ХОЛЕЦИСТОКИНИН, ХИМОДЕНИН, ИНТЕРОКЛИИН. Они обеспечивают:
-образование желчи в печени,
-сокращение желчного пузыря,
-выделение панкреатического сока,
-секрецию желез тонкого отдела кишечника. Всё это в целом обеспечивает быстрое переваривание пищи.
Особую роль в переваривании играют желчные кислоты. Все они образуются в печени и являются конечным продуктом окисления холестерина в организме. В основе их строения лежит структура ЦИКЛОПЕНТАНПЕРГИДРОФЕНАНТРЕН.
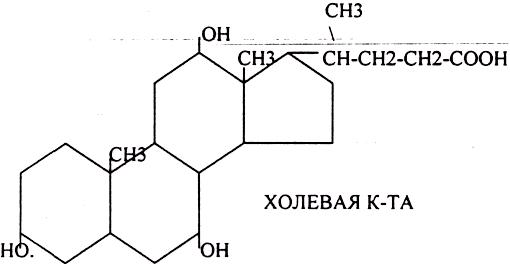
По своей химической природе все желчные кислоты являются производными ХОЛЕВОЙ К-ТЫ, у которой в 3, 7, 12 положениях имеются ОКСИГРУППЫ. Если у ХОЛЕВОЙ кислоты присутствует две группы в 3 и 7 положениях, то её называют ХЕНОДЕЗОКСИХОЛЕВОЙ. Если присутствует две группы в 3 и 12 положении, то она называется ДЕЗОКСИХОЛЕВОЙ. Если одна группа в 3 положении, кислота называется ЛИТОХОЛЕВАЯ.
БИОЛОГИЧЕСКАЯ РОЛЬ ЖЕЛЧНЫХ КИСЛОТ:
1. Эмульгируют пищевые жиры.
2. Активируют ЛИПОЛИТИЧЕСКИЕ ферменты.
3. Выполняют роль переносчиков трудно растворимых в воде продуктов гидролиза жира и жирорастворимых витаминов A, D, Е, К.
При ЭМУЛЬГИРОВАНИИ жир дробится на мелкие частички. Желчные кислоты адсорбируются на поверхности жира, значительно уменьшает поверхностное натяжение, при этом жир дробится на частички, которые вновь обволакиваются желчными кислотами, препятствуя их слиянию. В результате происходит стабилизация жира и значительно увеличивается поверхность контактов с ЛИПОЛИТИЧЕСКИМИ ферментами. Стабилизированная эмульсия жира далее подвергается гидролизу под влиянием панкреатических ферментов (ЛИПАЗ, ФОСФОЛИПАЗ, ХОЛЕСТЕРОЛЭСТЕРАЗ).
В переваривании жира принимает участие и КОЛИПАЗЫ кишечника. Помогают гидролизу жира ионы кальция, которые образуют комплексы со свободными ВЖК.
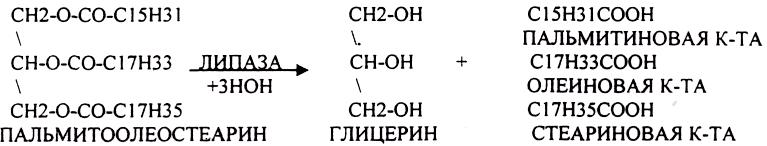
Т.о. в результате гидролиза пищевого жира образуются глицерины, холестерины, ВЖК, фосфаты, азотистые основания. Необходимо отметить, что в расщеплении жиров принимают участие и кишечные ЛИПАЗЫ, но их активность невысока, к тому же они расщепляют только МОНОГЛИЦЕРИДЫ и не действуют на ДИ- и ТРИГЛИЦЕРИДЫ. Установлено, что всасывание продуктов гидролиза жира имеет свою особенность. Легко всасываются слизистой кишечника спирты, фосфаты, АК, коротко цепочные ВЖК, азотистые основания. Трудно растворимые в воде продукты гидролиза (холестерин, ВЖК, МОНОГЛИЦЕРИДЫ), жирорастворимые витамины всасываются только в комплексе с желчными кислотами. Эти комплексы называются ХОЛЕИНОВЫМИ. В таком виде трудно растворимые в воде соединения проходят через мембраны ЭНТЕРОЦИТОВ. В этих клетках ворсинок кишечника происходит их распад. При этом желчные кислоты сразу же поступают в ток крови и через систему воротной вены доставляются в печень. Оттуда они в составе желчи вновь попадают в кишечник и могут участвовать в новом акте переваривания жира, либо удаляются из организма в составе каловых масс – КОПРОСТЕРИН. Установлено, что обязательный фонд желчных кислот у взрослого человека составляет 2,8 -3,5гр., при этом они совершают 5-6 оборотов в сутки за счёт печёночно-кишечной циркуляции. После того как продукты гидролиза жира поступили в ЭНТЕРОЦИТЫ, в стенке кишечника начинают синтезироваться жиры, специфические для данного организма, которые по своему строению отличаются от пищевого жира. Механизм синтеза жира в стенке кишечника сводится к следующему: Сначала происходит активация глицерина и ВЖК затем последовательно будет происходить АЦИЛИРОВАНИЕ альфа -ГЛИЦЕРОФОСФАТА с образованием МОНО- и ДИГЛИЦЕРИДОВ. Активная форма ДИГЛИЦЕРИДА - ФОСФАТИДНАЯ К-ТА занимает центральное место в синтезе жира к стенке кишечника. Из неё после активации в присутствии ЦТФ образуется ЦДФ -ДИАЦИЛГЛИЦЕРИД, который даёт начало сложным жирам.
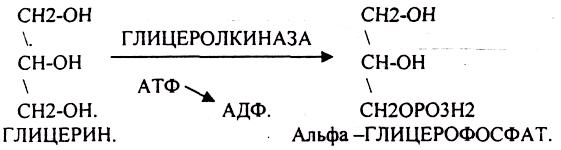
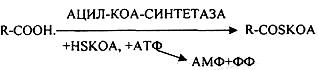
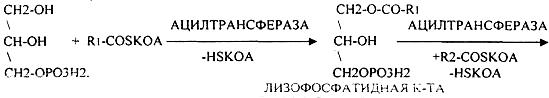

При укусе змей повышается активность ФОСФОРИЛАЗЫ А2. При этом в положении С2 у ФОСФАТИДИЛХОЛИНОВ и ФОСФАТИДИЛЭТАНОЛАМИНОВ отщепляется ПОЛИНЕНАСЫЩЕНЫЕ ВЖК и образуются токсические соединения -ЛИЗОФОСФОЛИПИДЫ, обладающие ГЕМОЛИТИЧЕСКИМ действием.
Лекция № 14. Обмен ЛИПИДОВ (продолжение).
1.ТРАНСПОРТНЫЕ ЛИПОПРОТЕИНЫ КРОВИ. СОСТАВ И БИОЛОГИЧЕСКАЯ РОЛЬ. 2.ПРОСТАГЛАНДИНЫ, ПРОСТАЦИКЛИНЫ, ТРОМБОКСАНЫ, ЛЕЙКОТРИЕНЫ. МЕХАНИЗМ ИХ ОБРАЗОВАНИЯ И БИОЛОГИЧЕСКАЯ РОЛЬ.
3.ОКИСЛЕНИЕ ГЛИЦЕРИНА И ВЖК В ТКАНЯХ.
ЛИПИДЫ являются нерастворимыми в воде соединениями, поэтому для их переноса кровью необходимы специальные переносчики, которые растворимы в воде. Такими транспортными формами являются ЛИПОПРОТЕИНЫ. Они относятся к свободным ЛИПИДАМ. Синтезированный жир в стенке кишечника, либо жир синтезированный в других тканях органах может быть транспортирован кровью лишь после включения в состав ЛИПОПРОТЕИНОВ, где роль стабилизатора играют белки.
По своему строению мицеллы ЛИПОПРОТЕИНЫ имеют наружный слой и ядро. Наружный слой формируется из БЕЛКОВ, ФОСФОЛИПИДОВ и ХОЛЕСТЕРИНА, которые имеют гидрофильные полярные группы и проявляют сродство к воде. Ядро состоит из ТРИГЛИЦЕРИДОВ, ЭФИРОВ ХОЛЕСТЕРИНА, ВЖК, витаминов A, D, Е, К. Т.о. нерастворимые жиры легко транспортируются по всему организму после синтеза в стенке кишечника, а также синтеза в других тканях между клетками, которые их синтезируют и используют.
Выделяют 4 класса ЛИПОПРОТЕИНОВ крови, которые отличаются друг от друга по своему химическому состоянию, размерам мицелл и транспортируемым жирам. Поскольку они имеют различную скорость оседания в растворе поваренной соли, их разделяют на:
1. ХИЛОМИКРОНЫ. Образуются в стенке кишечника и имеют самый крупный размер частиц.
2. ЛПОНП. Синтезируются в стенке кишечника и печени.
3. ЛПНП. Образуются в эндотелии капилляров из ЛПОНП.
4. ЛПВП. Образуются в стенке кишечника и печени.
Т.о. транспортные ЛП крови синтезируются двумя видами клеток - ЭНТЕРОЦИТАМИ и
ГЕПАТОЦИТАМИ. Было установлено, что ЛП крови при электрофорезе белков движутся в зоне
альфа и бета -ГЛОБУЛИНОВ, поэтому их по электрофоретической подвижности ещё
обозначают как:
Пре бета- ЛП - ЛПОНП,
Бета-ЛП-ЛПНП,
Альфа-ЛП-ЛПВП.
ХИЛОМИКРОНЫ как самые крупные частицы при электрофорезе остаются на старте.
Максимальная их концентрация достигается к 4 - 6 часам после приёма пищи. Расщепляются они
под действием фермента - ЛИПОПРОТЕИДЛИПАЗЫ, которая образуется в печени, легких,
эндотелии сосудов, жировой ткани.
Принято считать, что ХИЛОМИКРОНЫ отсутствуют в крови натощак и появляются только
после приёма пищи. В основном они транспортируют ТРИГЛИЦЕРИДЫ (83 - 85 %).
ЛПОНП и ЛПНП в основном транспортируют холестерин и его эфиры в клетки органов и
тканей. Эти фракции относятся к АТЕРОГЕННЫМ. ЛПВП в основном осуществляют транспорт ФОСФОЛИПИДОВ и ХОЛЕСТЕРИНА. Холестерин транспортируется в печень для последующего окисления с образованием желчных кислот и выделяется из организма в виде КОПРОСТЕРИНОВ. Эту фракцию называются АНТИАТЕРОГЕННОЙ.
Распадаются ЛИПОПРОТЕИНЫ крови:
ХИЛОМИКРОНЫ - под действием ЛИПОПРОТЕИДЛИПАЗЫ печени, жировой ткани, эндотелия капилляров. Продукты гидролиза вовлекаются в клеточный метаболизм. ЛПНП и ЛПВП путём эндоцитоза поглощаются клетками печени, почек, надпочечников, жировой ткани и кишечника, разрушаются в ЛИЗОСОМАХ и МИКРОСОМАХ.
ПРОСТАГЛАНДИНЫ , ПРОСТАЦИКЛИНЫ, ТР0МБОКСАНЫ , относящиеся к ПРОСТАНОИДАМ, а также ЛЕЙКОТРИЕНЫ являются гормон подобными веществами, которые в организме человека образуются из ЭССЕНЦИАЛЬНЫХ ВЖК. Главным их предшественником являются АРАХИДОНОВАЯ кислота (С19Н31СООН). Она не может существовать в клетке в свободном виде. Она очень активная и как только, выделяется в результате гидролиза, сразу же включается в клеточный метаболизм - образование гормон подобных веществ.
В настоящее время установлено, что они могут образовываться практически во всех клетках организма, за исключением эритроцитов. Образуются они в микро-количествах и по мере необходимости. Свой биологический эффект они оказывают в клетках тех органов и тканей, в которых образуются. Они выполняют роль местных гормонов, которые координируют функцию соседних клеток или удалённых на незначительные расстояния друг от друга органов. Все эти
40
вещества коротко живущие, т.е. они имеют период полураспада от нескольких секунд
(ТРОМБОКСАНЫ) до 20 минут (ПРОСТАГЛАНДИНЫ). Выполнив свою роль, они инактивируются и выводятся из организма с мочой. Биосинтез этих соединений начинается с того момента, когда из ФОСФОЛИПИДА под действием ФОСФОЛИПАЗЫ А2 высвобождается АРАХИДОНОВАЯ кислота. Центральные реакции метаболизма кислоты катализирует фермент: ЦИКЛООКСИГЕНАЗА. а в лейкоцитах ЛИПООКСИГЕНАЗА. В результате реакции синтеза в структуру АРАИДОНОВОЙ кислоты включается молекула кислорода. В случае образования ПРОСТАНОИДОВ происходит циклизация. ПРОСТАГЛАНДИНЫ и ПРОСТАЦИКЛИНЫ представляют собой пяти-членные циклы, ТРОМБОКСАНЫ - шести членные циклы, ЛЕЙКОТРИЕНЫ - ненасыщенные производные, ациклические соединения АРАХИДОНОВОЙ К-ТЫ.
Биологическая роль:
1.ПРОСТАГЛАНДИНЫ:
A) В эндокринных железах стимулируют образование гормонов (щитовидная железа, ПЖЖ, надпочечники).
Б) В жировой ткани тормозят ЛИПОЛИЗ.
B) Регулируют сокращение гладких мышц кишечника, бронхов, матки.
Г) Оказывают влияние на сокращение миокарда.
Д) Регулируют кровоток в почках, контролируют выведение электролитов и воды с мочой.
Е) Регулируют тромб-образование и проницаемость капилляров.
Ж) В ЦНС раздражают центры терморегуляции, вызывая повышение температуры тела -
лихорадку.
3) Повышая чувствительность нервных окончаний к ГИСТАМИНУ, они вызывают боль.
2.ПРОСТАЦИКЛИНЫ образуются в сердце и сосудах. Препятствуют образованию тромбов,
способствуют расширению сосудов, понижению артериального давления.
3.ТРОМБОКСАНЫ образуются из тучных клеток и тромбоцитов. Они запускают механизм
тромбобразования, способствуя слипанию тромбоцитов.
4.ЛЕЙКОТРИЕНЫ. Их биологическая роль связывается с воспалительными реакциями,
аллергическими реакциями и иммунитетом. Они способствуют прилипанию лейкоцитов к стенке
сосудов в местах воспаления. Они способствуют сокращению гладкой мускулатуры дыхательных
путей, ЖКТ. Регулируя тонус сосудов, они вызывают их сужение, повышение АД, стимулируют сокращение
коронарных сосудов.
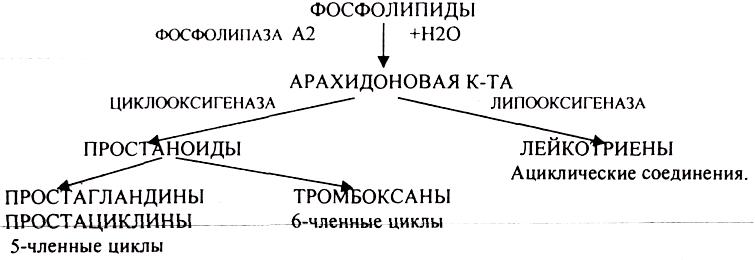
Основную массу ЛИПИДОВ организма человека составляют нейтральные жиры, которые в клетках находятся в виде включений. Период обновления ТРИГЛИЦЕРИДОВ в разных тканях составляет от 2 до 18 суток. В клетках постоянно идут процессы распада и синтеза жиров. Распад жиров в клетках происходит в лизосомах, меньше в микросомах и цитоплазме при участии тканевых ЭСТЕРАЗ. В результате гидролиза жира образуются общие метаболиты: глицерины и ВЖК, окисление которых сопровождается образованием конечных продуктов -воды и углекислого газа -и выделением энергии в форме АТФ. Окисление глицеринов в тканях тесно связано с ГЛИКОЛИЗОМ, в который вовлекаются метаболиты обмена глицерина по следующей схеме:
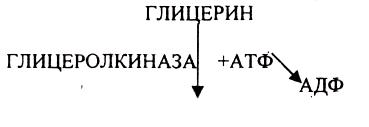
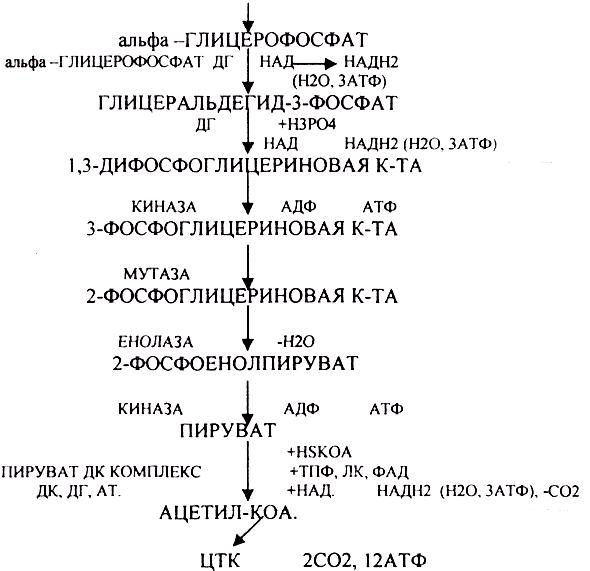
Т.о. при окислении глицерина образовались конечные продукты:
Н2О на этапе превращения:
1 . альфа -ГЛИЦЕРОФОСФАТА
2. ГЛИЦЕРАЛЬДЕГИД-3-ФОСФАТА
3. 2-ФОСФОГЛИЦЕРИНОВОЙ К-ТЫ
4. ПВК
5. ИЗОЦИТРАТА
6. Альфа-КЕТОГЛУТАРАТА
7. СУКЦИНАТА
8. МАЛАТА
СО2 на этапе превращения:
1. ПВК
2. ОКСАЛОСУКЦИНАТА
3. Альфа-КЕТОГЛУТАРАТА АТФ на этапе превращения:
1 . альфа -ГЛИЦЕРОФОСФАТА
2. ГЛИЦЕРАЛЬДЕГИД-3-ФОСФАТА
3. 1,3-ДИФОСФОГЛИЦЕРИНОВОЙ К-ТЫ (СУБСТРАТНОЕФОСФОРИЛИРОВАНИЕ)
4. 2-ФОСФОЕНОЛПИРУВАТА (СУБСТРАТНОЕ ФОСФОРИЛИРОВАНИЕ)
6. ИЗОЦИТРАТА
7. Альфа-КЕТОГЛУТАРАТА
8. СУКЦИНИЛ-КОА (СУБСТРАТНОЕ ФОСФОРИЛИРОВАНИЕ)
9. СУКЦИНАТА
10. МАЛАТА
АТФ = (3+3+1 + 1+3+12) -1 =22
Окисление ВЖК в тканях изучалось Ф. КНООПОМ (1904г.), который назвал окисление ВЖК бета- окислением. Он показал, что процесс этот циклический, что все ВЖК, имеющие чётное количество углеродных звеньев в цепи обязательно проходят окисление, когда цепь периодически укорачивается на 2 углеродных звена. Последняя стадия окисления - стадия превращения масляной кислоты имеет свои особенности, когда в результате 1 цикла окисления образуется 2 молекулы АЦЕТИЛ-КОА. Одна проходит окисление с выделением 5 АТФ, а другая нет.
В 1949г. А. ЛЕНИНДЖЕР установил, что бета-окисление ВЖК происходит в МИТОХОНДРИЯХ. Д. ЛИНЕН (1954г.) детально описал все стадии бета-окисления.
В настоящее время бета-окисление называют ЦИКЛОМ КНООПА - ЛИНЕНА. Установлено, что процесс бета -окисления начинается в цитоплазме клеток с активации ВЖК. Мембрана МИТОХОНДРИЙ для ВЖК не проницаема. Транспорт ВЖК внутрь возможно только при участии азотистого основания - КАРНИТИНА. АЦИТИЛ-КОА в цитоплазме соединяется с КАРНИТИНОМ при участии фермента АЦЕТИЛ-КОА-КАРНИТИНТРАНСФЕРАЗЫ. Образуется комплекс, который легко проникает через мембрану. В межмембранном пространстве уже при участии МИТОХОНДРИАЛЬНОЙ ТРАНСФЕРАЗЫ комплекс распадается. КАРНИТИН возвращается в цитоплазму, а ВЖК в матрице подвергается окислению.
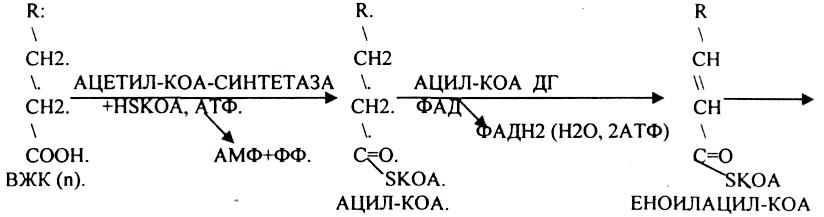
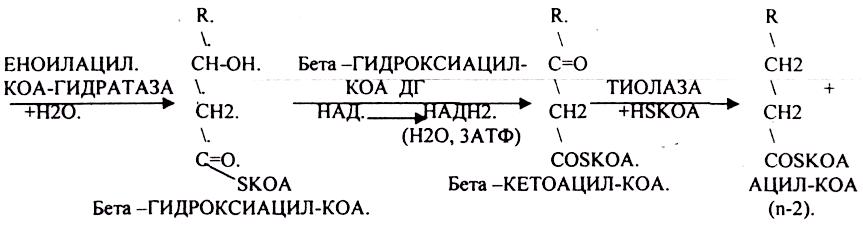
![]()
Т.о. завершая 1 цикл бега -окисления ВЖК, в результате которого ВЖК укоротилось на 2 углеродных звена. При бета -окислении выделилось 5АТФ и 12АТФ выделилось при окислении АЦЕИЛ-КОА в ЦТК и сопряженных с ним ферментов дыхательной цепи. Окисление ВЖК будет происходить циклически одинаково, но только до последней стадии - стадии превращения масляной кислоты (БУТИРИЛ-КОА), которая имеет свои особенности. Их надо учитывать при подсчёте энергетического эффекта окисления ВЖК, когда в результате одного цикла образуется 2 молекулы АЦЕТИЛ-КОА, одна из них проходила бета -окисление с выделением 5АТФ, а другая нет.
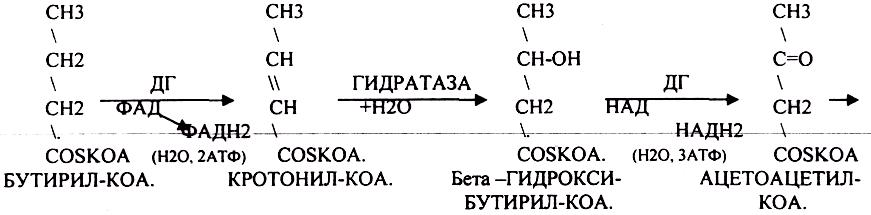
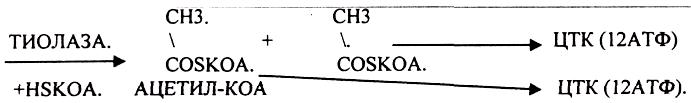
Энергетический эффект окисления ВЖК: АТФ = n/2 * 17 - 6, где n - число углеродных звеньев в цепи ВЖК, 17 - количество молекул АТФ, которые выделяются в результате окисления 2 углеродных звеньев цепи до конечных продуктов 5АТФ+12АТФ, 6 - то количество АТФ, которое не выделяется, поскольку 1 АТФ тратится на активацию ВЖК, а 5 АТФ не выделяются на последнем этапе - превращения молочной кислоты.
ВЖК, имеющие нечётное количество углеродных звеньев, поступают в организм человека в составе пищи. Окисление таких ВЖК происходит также как и ВЖК, имеющих чётное количество углеродных звеньев в цепи, но только до последней стадии - стадии превращения ПРОПИОНИЛ-КОА. которая имеет свои особенности:
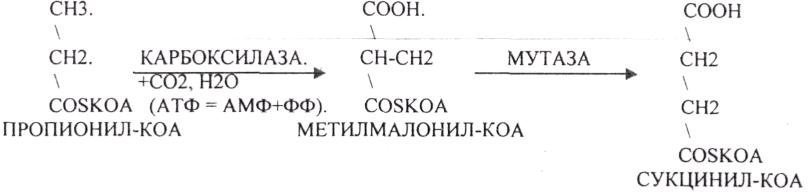
Т.о. образованная молекула СУКЦИНИЛ-КОА, которая для дальнейшего окисления в МИТОХОНДРИЯХ поступает в ЦТК КРЕБСА, одним из основных субстратов которого она является.
Лекция № 15.
Обмен ЛИПИДОВ (продолжение).
1.БИОСИНТЕЗ ВЖК В ТКАНЯХ, ХИМИЗМ РЕАКЦИЙ, БИОЛОГИЧЕСКАЯ РОЛЬ. 2.ХОЛЕСТЕРИН, БИОЛОГИЧЕСКАЯ РОЛЬ, БИОСИНТЕЗ, ОКИСЛЕНИЕ. 3.ПАТОЛОГИЯ ЛИПИДНОГО ОБМЕНА.
Биосинтез ВЖК протекает в ЭПС клеток. Исходным материалом для синтеза заменимых ВЖК является АЦЁТИЛ-КОА, который поступает для биосинтеза при распаде белков, жиров и углеводов.
Условия для биосинтеза ВЖК:
1.Наличие АТФ, СО2, Н2О, НАДФ*Н2, поступающий из ГЕКСОЗОМОНОФОСФАТНОГО пути превращения глюкозы.
2.Наличие специальных белков-переносчиков (HS -АПБ). 3.Наличие специальных ферментов синтеза.
Процесс биосинтеза циклический. Каждый цикл включает в себя 6 этапов. АЦЕТИЛ-КОА используется на первом этапе, как «затравка» синтеза.
Первый этап. Этап образования 3-углеродного соединения - МАЛОНИЛ-КОА.
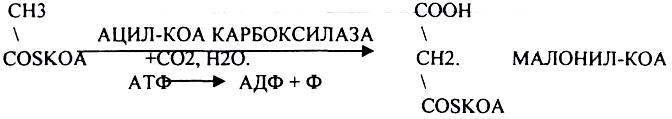
Второй этап. Этап переноса МАЛОНИЛА и АЦЕТИЛА на специальные белки - HS-АПБ.
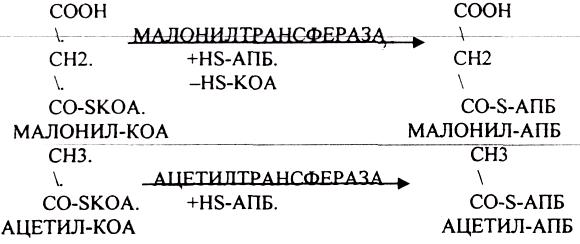
Третий этап. Этап конденсации МАЛОНИЛА-АПБ и АЦЕТИЛА-АПБ с участием ТРАНСФЕР АЗЫ - СИНТАЗЫ.
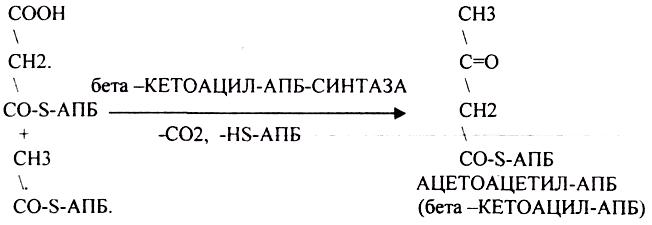
Четвёртый этап. Этап восстановления бета -КЕТОАЦИЛ-АПБ.
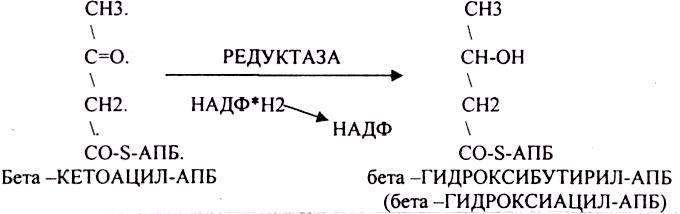
Пятый этап. Этап ДЕГИДРАТАЦИИ бета-ГИДРОКСИАЦИЛ-АПБ.

Шестой этап. Этап восстановления ЕНОИЛАЦИЛ-АПБ.
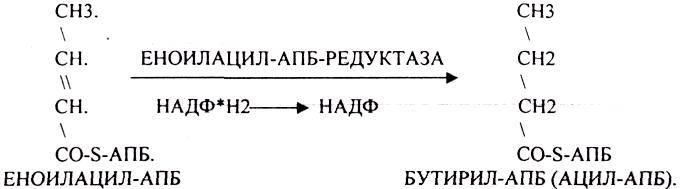
Т.о. завершается 1 цикл синтеза ВЖК образованием масляной кислоты (БУТИРИЛ-АПБ). В дальнейшем последовательно и циклично к 4-углеродному фрагменту будут присоединяться молекулы МАЛОНИЛ-КОА. Для подсчёта количества циклов синтеза ВЖК, подсчёта молекул АТФ, МАЛОНИЛ-КОА можно пользоваться формулой: N/2 - 1, где N-это число углеродных звеньев в молекуле ВЖК. Завершается биосинтез любой ВЖК в тканях ДЕАЦИЛАЗНОЙ реакцией.
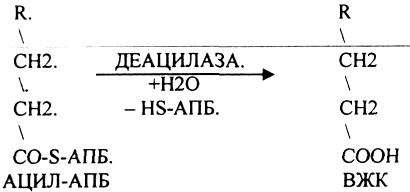
Так в организме человека происходит синтез всех заменимых ВЖК - всех предельных и непредельных ВЖК, имеющих одну двойную связь.
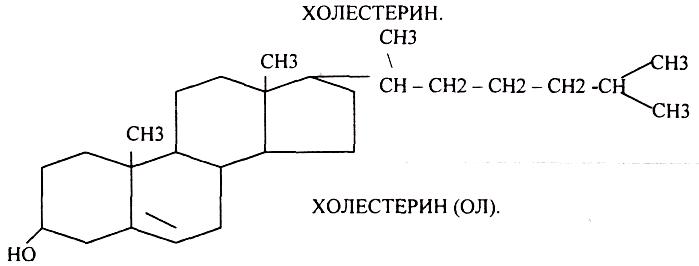
Холестерин является одноатомным циклическим спиртом, который в тканях легко образует ХОЛЕСТЕРИДЫ (в положении 3). В организм человека поступает в составе пищи и синтезируется г.о. в печени, тонком отделе кишечника и коже.
Биологическая роль холестерина:
1.Структурная. Свободный холестерин является, обязательным структурным компонентом мембран клеток.
2.Метаболическая. Холестерин является предшественником биологически активных веществ: витамина D3
СТЕРОИДНЫХ гормонов (АНДРОГЕНОВ, ЭСТРОГЕНОВ, КОРТИКОИДОВ) При окислении холестерина в печени при участии ЦИТОХРОМА Р-450 образуются желчные кислоты, которые принимают участие в переваривании жиров пищи. Наиболее богаты холестерином плазматические мембраны ГЕПАТОЦИТОВ, где на его долю приходится 30% всех мембранных липидов. Содержание холестерина в миелине составляет 20%. В свободном виде холестерин транспортируется по организму с помощью транспортных ЛИПОПРОТЕИНОВ крови.
Источники холестерина:
1. Пища. За сутки в организм взрослого человека поступает 0,3гр. холестерина.
2. У человека в среднем с массой 65-70кг за сутки синтезируется 3.5 -4,2гр. холестерина. Печень занимает главное место в синтезе холестерина (85%), в меньшей степени холестерин синтезируется в кишечнике (10%) и коже (5%). На экспорт холестерин синтезируется только в печени и кишечнике.
Процесс биосинтеза сложен и многоступенчат. Он включает в себя 35 реакций. Схематично его можно представить следующим образом:

Образовавшийся в результате распада мембранных ЛИПИДОВ, а также излишки холестерина с помощью ЛПВП доставляется для окисления в печень, и в составе желчных кислот удаляется из организма с каловыми массами в виде КОПРОСТЕРИНОВ.
ПАТОЛОГИЯ ЛИПИДНОГО ОБМЕНА.
1 .На этапе поступления жиров с пищей:
A. Обильная жирная пища на фоне ГИПОДИНАМИИ приводит к развитию АЛИМЕНТАРНОГО ОЖИРЕНИЯ.
B. Недостаточное поступление жиров или их отсутствие приводит к ГИПО- и АВИТАМИНОЗАМ A, D. Е, К. Могут развиваться ДЕРМАТИТЫ, СКЛЕРОЗ сосудов, когда с пищей не поступают ЭССЕНЦИАЛЬНЫЕ ВЖК. Также нарушается процесс синтеза ПРОСТАГЛАНДИНОВ, ПРОСТАЦИКЛИНОВ, ТРОМБОКСАНОВ и ЛЕЙКОТРИЕНОВ местных гормонов.
C. Недостаточное поступление с пищей ЛИПОТРОПНЫХ веществ приводит к развитию жировой инфильтрации тканей. К ЛИПОТРОПНЫМ веществам относятся:
ХОЛИН, ИНОЗИТ, СЕРИИ вещества, принимающие участие в синтезе
ФОСФОЛИПИДОВ. Витамин В6 (ПЕРИДОКСАЛЬФОСФАТ), входящий в состав ДК СЕРИНА. МЕТИОНИН поставщик МЕТИЛЬНЫХ групп при биосинтезе ХОЛИНА из ЭТАНОЛАМИНА.
Витамин BI2 и ФОЛИЕВАЯ К-ТА, которые являются КОФЕРМЕНТАМИ МЕТИЛТРАНСФЕРАЗ.
