
- •1.Ионное произведение воды. Водородный и гидроксильный показатели. Буферные растворы: их состав, расчет рН.
- •2.Азот. Строение атома, со. Соединения азота с металлами, водородом, кислородом
- •1.Закон Гесса – основной закон термохимии. Следствия из закона Гесса
- •1.Самопроизвольные процессы. Энтропия. Второй закон термодинамики. Факторы, определяющие энтропию.
- •2.Соединение фосфора с Ме, водородом, кислородом, галогенами (получение и химические свойства)
- •1.Энергия Гиббса. Энтальпийный и энтропийный факторы. Критерии направления химического процесса.
- •2.Соединение азота с водородом: аммиак гидразин, гидроксиламин, азотоводородная кислота. Их кислотно-основные и окислительно–восстановительные свойства.
- •2.Хром. Строение атома, степени окисления. Оксиды, гидроксиды, соли, комплексные соединения.
- •1.Хим равновесие. Константа равновесия. Принцип Ле Шателье.
- •2.Оксиды р-элементов группы IV. Изменения кислотно-основных и ов св-в в зависимости от природы элемента.
- •2.Железо, кобальт, никель. Строение атомов, со. Их отношение к к-там. Оксиды, гидроксиды, соли, комплексные соединения этих элементов.
- •1.Строение атомов (энергетические уровни, подуровни, орбитали). Формы орбиталей. Квантовые числа.
- •2.Галогениды n, p, As, Sb, Bi. Получение, характер связи элемент-галоген. Гидролиз галогенидов.
- •1.Многоэлектронные атомы. Заполнение электронных оболочек (принцип наименьшей энергии, принцип Паули, правило Хунда). Квантовые числа.
- •2.Кислород. Методы получения, физические свойств. Химические свойства. Соединения (оксиды, надпероксиды, озониды). Получение, свойства.
- •1.Основные типы хим связи: ковалентная, ионная, металлическая, водородная.
- •2.Кремний. Со. Св-ва кремния. Диоксид кремния. Кремниевые кислоты и их соли.
- •1.Хим связь в комплексных соединениях. Понятие о теории кристаллического поля. Параметр расщепления. Спектрохимический ряд лигандов.
- •2. Оксид азота (III) и азота (IV). Методы получения, химические свойства. Азотистая кислота, нитриты. Методы получения, химические свойства.
- •1. Ионизация комплексных соединений в растворах. Константы образования и нестойкости. Разрушение комплексных соединений.
- •2.Общая характеристика d-элементов группы I (медь, серебро, золото). Их со. Хим св-ва ме. Оксиды, гидроксиды, соли этих металлов.
- •1. Электродные потенциалы металлов. Факторы, определяющие положение металла в ряду стандартных электродных потенциалов.
- •2. Кислородосодержащие кислоты хлора. Методы получения. Закономерности в изменении кислотно-основных и окислительно-восстановительных свойств кислот
- •1.Природа связи в комплексных соединениях по методу вс. Геометрия комплексных ионов. Магнитные свойства.
- •2.Общая характеристика d-элементов II группы. Их оксиды, гидроксиды, соли, комплексные соед. Хим св-ва этих соединений.
- •1.Межмолекулярное взаимодействие (ориентационное, индукционное, дисперсионное) и их природа. Энергия межмолекулярного взаимодействия.
- •1.Ммо. Энергетические диаграммы гомоядерных молекул. Энергетические диаграммы для частиц: o2, f2, n2 (порядок, энергия, длина связи).
- •1.Ммо. Энергетические диаграммы гетероядерных молекул (no,hf). Понятие о несвязывающих мо.
- •2.Серная кислота. Методы получения. Хим св-ва.
1.Энергия Гиббса. Энтальпийный и энтропийный факторы. Критерии направления химического процесса.
Из-за того, что тепловой эффект реакции(ΔH) не может являться критерием самопроизвольности процесса (из-за того, что существуют самопроизвольные экзогенные процессы и эндотермические реакции), вводится изобарно-изотермический потенциал –ΔG - энергия Гиббса.
Основной критерий – переходит ли система в более устойчивое состояние.
Энергия Гиббса зависит от:
энтальпийного фактора: стремление частиц образовывать сложные связи для понижения П (потенциальной энергии)
энтропийного фактора: при повыш темп частицы стремятся разорвать связи
Таким образом, энергия Гиббса наиболее четко показывает устойчивость системы: ΔG=ΔH-TΔS
ΔG<0 – процесс протекает самопроизвольно
ΔG=0 – процесс равновесный
ΔG>0 – процесс не протекает самопроизвольно
2.Соединение азота с водородом: аммиак гидразин, гидроксиламин, азотоводородная кислота. Их кислотно-основные и окислительно–восстановительные свойства.
Аммиак: Промыш синтез аммиака — каталитич процесс, протекающий при высоких давлениях и темп в присутствии катализатора (98 % Fe304 + 2% KAIO2): В лаб аммиак получают, действуя на соли аммония растворами щелочей:
NH4Cl + КОН = NH3 + КСl + Н20
Молекула аммиака — тригональная пирамида с валентным углом 107,3°. Молекула полярна и проявляет электронодонорные св-ва. Водородная связь между молекулами аммиака слабее, чем в воде, поэтому вязкость аммиака меньше, а темп плавл ниже, чем воды и аммиак легко сжижается. При обычн усл аммиак — газ с резким запахом, хорошо р-римый в воде. При 20 °С в одном литре воды р-ряется до 700 л газообразного аммиака. Химические св-ва аммиака характеризуют: NH3+HCl=NH4Cl(присоединение) 2Na+2NH3=2NaNH2(амид)+H2(замещение)
В ОВР амиды и нитриды проявляют восст-ные св-ва, окисляясь до азота. В ОВР аммиак – в-ль: 2NH3 + 2КМп04 = N2 + 2Мп02 + 2КОН + 2Н20 Соли аммония термически неустойчивы и разлагаются при нагревании.
Гидразин, N2H4, получают окислением водного р-ра аммиака гипохлоритом натрия в присутствии желатина:2NH3 + NaCI = N2H4 + NaCl + H20
Гидразин — бесцв, дымящая на воздухе жидкость. Гидразин — слабое двукислотное основание, с кислотами образует соли гидразиния, например, N2H4 H2S04— сульфат гидразиния, с водой — гидразин-гидрат N2H4 Н20. В ОВР гидразин — сильный в-ль: 2CuS04+N2H4 H2S04=2Cu+N2+3H2S04. В р-циях с сильными восст-лями гидразин может проявлять ок-ные св-ва: N2H4+Н2=2NH3 Гидроксиламин — кристаллич в-во, слабое основание. СО азота в гидроксиламине -I. В щел среде гидроксиламин хороший восст-ль: 2NH2OH+I2+2КОН = N2+2KI + 4Н2O,а в кислой может быть и ок-лем: 4FeSO4 + 2NH2OH + 3H2S04 = 2Fe2(SO4)3 + (NH4)2SO4 + 2Н2O.
Азид водорода получают окислением гидразина азотистой кислотой: N2H4 + HN02 = HN3 + 2Н20 HN3 — бесцв жидкость с резким запахом
В водном р-ре азид водорода — слабая к-та. В водном р-ре медленно разлагается: HN3 + Н20 = N2 + NH2OH В ОВР проявляет ок-ные св-ва подобно азотной кислоте: HN3 + 2HI = I2 + NH3 + N2 При взаим-вии HN3 с ме обр соли — азиды, азот и аммиак: 3HN3 + Mg = Mg(N3)2 + N2 + NH3
Азиды тяжелых металлов (РЬ и др.), как и сама кислота, — взрывчатые в-ва.
Билет 16
1.Скорость химической реакции — изменение кол-ва одного из реагирующих в-в за единицу времени в единице реакционного пространства.
Скорость
хим р-ции — величина всегда положительная,
поэтому, если она опр по исходному в-ву
(конц которого убывает в процессе
р-ции), то полученное значение умножается
на −1.![]()
![]()
vгомог.=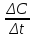 vгетерог.=
vгетерог.= S-площадь
поверхности
S-площадь
поверхности
Закон действующих масс: Скорость хим р-ции в каждый момент времени пропорциональна концентрациям реагентов, возведенным в степени, равные их стехиометрическим коэфф-там. Для элементарных р-ций показатель степени часто равен его стехиометрическому коэфф-ту, для сложных р-ций это правило не соблюдается. Кроме конц на скорость хим р-ции оказывают влияние следующие факторы: природа реаг в-в, наличие катализатора, темп (правило Вант-Гоффа), давление, площадь пов-ти реагирующих веществ.
