
- •1.Ионное произведение воды. Водородный и гидроксильный показатели. Буферные растворы: их состав, расчет рН.
- •2.Азот. Строение атома, со. Соединения азота с металлами, водородом, кислородом
- •1.Закон Гесса – основной закон термохимии. Следствия из закона Гесса
- •1.Самопроизвольные процессы. Энтропия. Второй закон термодинамики. Факторы, определяющие энтропию.
- •2.Соединение фосфора с Ме, водородом, кислородом, галогенами (получение и химические свойства)
- •1.Энергия Гиббса. Энтальпийный и энтропийный факторы. Критерии направления химического процесса.
- •2.Соединение азота с водородом: аммиак гидразин, гидроксиламин, азотоводородная кислота. Их кислотно-основные и окислительно–восстановительные свойства.
- •2.Хром. Строение атома, степени окисления. Оксиды, гидроксиды, соли, комплексные соединения.
- •1.Хим равновесие. Константа равновесия. Принцип Ле Шателье.
- •2.Оксиды р-элементов группы IV. Изменения кислотно-основных и ов св-в в зависимости от природы элемента.
- •2.Железо, кобальт, никель. Строение атомов, со. Их отношение к к-там. Оксиды, гидроксиды, соли, комплексные соединения этих элементов.
- •1.Строение атомов (энергетические уровни, подуровни, орбитали). Формы орбиталей. Квантовые числа.
- •2.Галогениды n, p, As, Sb, Bi. Получение, характер связи элемент-галоген. Гидролиз галогенидов.
- •1.Многоэлектронные атомы. Заполнение электронных оболочек (принцип наименьшей энергии, принцип Паули, правило Хунда). Квантовые числа.
- •2.Кислород. Методы получения, физические свойств. Химические свойства. Соединения (оксиды, надпероксиды, озониды). Получение, свойства.
- •1.Основные типы хим связи: ковалентная, ионная, металлическая, водородная.
- •2.Кремний. Со. Св-ва кремния. Диоксид кремния. Кремниевые кислоты и их соли.
- •1.Хим связь в комплексных соединениях. Понятие о теории кристаллического поля. Параметр расщепления. Спектрохимический ряд лигандов.
- •2. Оксид азота (III) и азота (IV). Методы получения, химические свойства. Азотистая кислота, нитриты. Методы получения, химические свойства.
- •1. Ионизация комплексных соединений в растворах. Константы образования и нестойкости. Разрушение комплексных соединений.
- •2.Общая характеристика d-элементов группы I (медь, серебро, золото). Их со. Хим св-ва ме. Оксиды, гидроксиды, соли этих металлов.
- •1. Электродные потенциалы металлов. Факторы, определяющие положение металла в ряду стандартных электродных потенциалов.
- •2. Кислородосодержащие кислоты хлора. Методы получения. Закономерности в изменении кислотно-основных и окислительно-восстановительных свойств кислот
- •1.Природа связи в комплексных соединениях по методу вс. Геометрия комплексных ионов. Магнитные свойства.
- •2.Общая характеристика d-элементов II группы. Их оксиды, гидроксиды, соли, комплексные соед. Хим св-ва этих соединений.
- •1.Межмолекулярное взаимодействие (ориентационное, индукционное, дисперсионное) и их природа. Энергия межмолекулярного взаимодействия.
- •1.Ммо. Энергетические диаграммы гомоядерных молекул. Энергетические диаграммы для частиц: o2, f2, n2 (порядок, энергия, длина связи).
- •1.Ммо. Энергетические диаграммы гетероядерных молекул (no,hf). Понятие о несвязывающих мо.
- •2.Серная кислота. Методы получения. Хим св-ва.
1.Межмолекулярное взаимодействие (ориентационное, индукционное, дисперсионное) и их природа. Энергия межмолекулярного взаимодействия.
Межмолекулярное взаимодействие имеет электростатическую природу. В наиболее широком смысле под ним можно понимать такие взаимодействия между любыми частицами (молекулами, атомами, ионами), при которых не происходит образования хим связей. Иными словами, эти взаимодействия существенно слабее ковалентных и не приводят к существенной перестройке электронного строения взаимодействующих частиц.
На больших расстояниях преобладают силы притяжения, которые могут иметь ориентационную, поляризационную (индукционную) и дисперсионную природу.
Ориентационные силы, диполь-дипольное притяжение. Осуществляется между молекулами, являющимися постоянными диполями. Примером может служить HCl в жидком и твердом состоянии. Энергия такого взаимодействия обратно пропорциональна кубу расстояния между диполями.
Дисперсионное притяжение (лондоновские силы). Взаимодействием между мгновенным и наведенным диполем. Энергия такого взаимодействия обратно пропорциональна шестой степени расстояния между диполями.
Индукционное притяжение. Взаимодействие между постоянным диполем и наведенным (индуцированным). Энергия такого взаимодействия обратно пропорциональна шестой степени расстояния между диполями.
2.S-элементы группы I. Общая характеристика хим св-в этих металлов. Особенности взаимодействии этих металлов с кислородом
Все s-элементы I группы проявляют устойчивую СО +1. Невысокие значения энергий ионизаций позволяют предположить наличие сильных восст-ных св-в атомов. Все элементы легко вступают во взаим-е с кислородом, водородом, галогенами и серой. Вследствие большого сродства к кислороду s-элементы восст-ют элементы из их оксидов: 2Na+CuO=Na2O+Cu
Литий непосредственно реагирует с азотом: 6Li+N2=2Li3N
Для s-элементов характерен ионный тип связи. Ионность связи возрастает с увелич ионного R.
s-элементы образуют с кислородом оксиды Э2О, пероксиды Э2О2, надпероксиды ЭО2 и озониды ЭО3.
При взаим-ии с кислородом литий образует оксид 4Li+O2=2Li2O
Натрий – пероксид: 2Na+O2=Na2O2
Калий - надпероксид K+O2=KO2
Озониды образуют только калий, рубидий и цезий: K+O3=KO3
Оксиды натрия и элементов подгруппы калия получают из пероксидов: Na2O2+2Na=2Na2O
Гидроксиды проявляют основные св-ва, которые усиливаются в группах с увеличением порядкового номера.
Билет 29
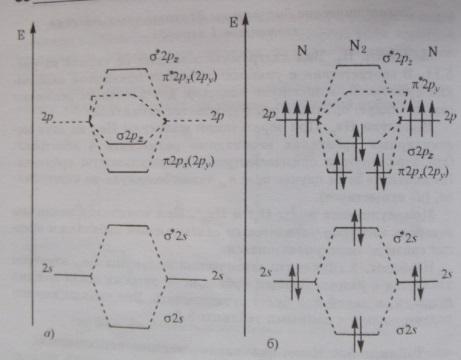
1.Ммо. Энергетические диаграммы гомоядерных молекул. Энергетические диаграммы для частиц: o2, f2, n2 (порядок, энергия, длина связи).
Метод МО – метод, в котором из одноэлектронных атомных орбиталей(АО) строятся одноэлектронные обобщенные МО, охватывающие всю молекулу.
В этом методе молекула представляется как единая многоэлектронная, многоцентровая система, где каждый электрон принадлежит молекул в целом и движется в поле всех ядер и электронов.
N2. Электроны 1s слоя участие в образовании химической связи не принимают, 8 орбиталей внешнего слоя 2х атомов азота комбинируются в 8 МО. На 2s и 2p орбиталях находится 10е. При образовании молекулы е заселяют орбитали с наиболее низкой энергией. Разрыхляющие орбитали П*2рх, П*2ру и 6*2рz остаются незаселенными, е 2s орбиталей, заполняя при комбинировании связывающую и разрыхляющую орбитали, фактически не образуют хим. Связи – это неподелённые электронные пары на атомах азота. Порядок связи в молекуле азота 3, энергия связи 940 кДж/ моль.
О2. Отличительная особенность - орбитали П*2рх, П*2ру и 6*2рz находится. Во внешнем слое 12 е, 10е заполняют 62s, 6*2s, 62pz, П2px, П2py. 2е должны быть на П*2px – П*2py.
Так
как энергии равны, то по правилу Хунда
е занимают обе орбитали, порядок связи
2. В молекуле 2 неспаренных е – она
парамагнитна. Е связи 494 кДж /моль.
2.Галогены. Методы получения. хим св-ва.
Реаг почти со всеми простыми в-вами, кроме некоторых неме. Все галогены — энергичные ок-ли, поэтому встр в природе только в виде соед. С увелич порядкового номера хим активность галогенов уменьшается, хим активность галогенид-ионов F−, Cl−, Br−, I−, At− уменьш.
К галогенам относятся фтор F, хлор Cl, бром Br, иод I, астат At.
Все галогены — неме. На внешнем энергетич уровне 7 электронов, явл сильными ок-лями. При взаим-ии с ме возникает ионная связь, и образуются соли. Галогены, (кроме F) при взаим-ии с более ЭОными эл-тами, могут проявлять и восст-ные св-ва вплоть до высшей СО +7.
Основным способом получения простых в-в явл окисление галогенидов. В промыш применяется только электролитическое окисление. В промыш хлор в основном получают электролизом водного раствора хлорида натрия в специальных электролизёрах. Бром получают хим окислением бромид-иона, находящегося в морской воде. Подобный процесс используется и для получения йода из природных рассолов, богатых I−. В кач-ве ок-ля в обоих случаях используют хлор, обладающий более сильными ок-ми св-вами, а образующиеся Br2 и I2 удаляются из р-ра потоком воздуха.
Все галогены проявляют высокую ок-ную активность, которая уменьшя при переходе от фтора к астату. Фтор — самый активный из галогенов, реагирует со всеми ме без искл, многие из них в атмосфере фтора самовоспламеняются, выделяя большое кол-во теплоты, например:
2Al + 3F2 = 2AlF3 + 2989 кДж,
2Fe + 3F2 = 2FeF3 + 1974 кДж.
Без нагр фтор реаг и со многими неме (H2, S, С, Si, Р) — все р-ции при этом сильно экзотермические, напр:Н2 + F2 = 2HF + 547 кДж,
Si + 2F2 = SiF4(г) + 1615 кДж.
При нагр фтор ок-ет все другие галогены по схеме
Hal2 + F2 = 2НalF
где Hal = Cl, Br, I, At, причем в соед HalF степени окисления хлора, брома, иода и астата равны +1.
Наконец, при облучении фтор реагирует даже с инертными (благородными) газами:
Хе + F2 = XeF2 + 152 кДж.
Взаимодействие фтора со сложными в-вами также протекает очень энергично. Так, он ок-ет воду, при этом р-ция носит взрывной характер:
3F2 + ЗН2О = OF2↑ + 4HF + Н2О2.
Свободный хлор также очень реакционноспособен, хотя его активность и меньше, чем у фтора.
Он непосредственно реаг со всеми простыми в-вами, за искл кислорода, азота и благородных газов. Для сравнения приведем ур-ния р-ций хлора с теми же простыми в-вами, что и для фтора: 2Al + 3Cl2 = 2AlCl3(кр) + 1405 кДж,
2Fe + ЗCl2 = 2FeCl3(кр) + 804 кДж,
Si + 2Cl2 = SiCl4(Ж) + 662 кДж,
Н2 + Cl2 = 2HCl(г)+185кДж.
Особый интерес представляет р-ция с водородом. Так, при комн темп, без освещения хлор практически не реаг с водородом, тогда как при нагр или при освещении (напр, на прямом солнечном свету) эта р-ция протекает со взрывом по приведенному ниже цепному механизму:
Cl2 + hν → 2Cl,
Cl + Н2 → HCl + Н,
Н + Cl2 → HCl + Cl,
Cl + Н2 → HCl + Н и т. д.
Хлор вступает в р-цию со многими сложными в-вами, напр замещения и присоединения с углеводородами:
СН3-СН3 + Cl2 → СН3-СН2Cl + HCl,
СН2=СН2 + Cl2 → СН2Cl — СН2Cl.
Хлор способен при нагревании вытеснять бром или йод из их соед с водородом или металлами:
Cl2 + 2HBr = 2HCl + Br2,
Cl2 + 2HI = 2HCl + I2,
Cl2 + 2KBr = 2KCl + Br2,
а также обратимо реагирует с водой:
Cl2 + Н2О = HCl + HClO — 25 кДж.
Хлор может таким же образом реагировать (диспропорционировать) со щелочами:
Cl2 + 2NaOH = NaCl + NaClO + Н2О (на холоде),
3Cl2 + 6КОН = 5KCl + KClO3 + 3Н2О (при нагр).
Для примера приведем р-ции взаимодействия брома с кремнием и водородом:
Si + 2Br2 = SiBr4(ж) + 433 кДж,
Н2 + Br2 = 2HBr(г) + 73 кДж.
Н2 + I2 = 2HI — 53 кДж.
Билет 30.
