
- •1.Ионное произведение воды. Водородный и гидроксильный показатели. Буферные растворы: их состав, расчет рН.
- •2.Азот. Строение атома, со. Соединения азота с металлами, водородом, кислородом
- •1.Закон Гесса – основной закон термохимии. Следствия из закона Гесса
- •1.Самопроизвольные процессы. Энтропия. Второй закон термодинамики. Факторы, определяющие энтропию.
- •2.Соединение фосфора с Ме, водородом, кислородом, галогенами (получение и химические свойства)
- •1.Энергия Гиббса. Энтальпийный и энтропийный факторы. Критерии направления химического процесса.
- •2.Соединение азота с водородом: аммиак гидразин, гидроксиламин, азотоводородная кислота. Их кислотно-основные и окислительно–восстановительные свойства.
- •2.Хром. Строение атома, степени окисления. Оксиды, гидроксиды, соли, комплексные соединения.
- •1.Хим равновесие. Константа равновесия. Принцип Ле Шателье.
- •2.Оксиды р-элементов группы IV. Изменения кислотно-основных и ов св-в в зависимости от природы элемента.
- •2.Железо, кобальт, никель. Строение атомов, со. Их отношение к к-там. Оксиды, гидроксиды, соли, комплексные соединения этих элементов.
- •1.Строение атомов (энергетические уровни, подуровни, орбитали). Формы орбиталей. Квантовые числа.
- •2.Галогениды n, p, As, Sb, Bi. Получение, характер связи элемент-галоген. Гидролиз галогенидов.
- •1.Многоэлектронные атомы. Заполнение электронных оболочек (принцип наименьшей энергии, принцип Паули, правило Хунда). Квантовые числа.
- •2.Кислород. Методы получения, физические свойств. Химические свойства. Соединения (оксиды, надпероксиды, озониды). Получение, свойства.
- •1.Основные типы хим связи: ковалентная, ионная, металлическая, водородная.
- •2.Кремний. Со. Св-ва кремния. Диоксид кремния. Кремниевые кислоты и их соли.
- •1.Хим связь в комплексных соединениях. Понятие о теории кристаллического поля. Параметр расщепления. Спектрохимический ряд лигандов.
- •2. Оксид азота (III) и азота (IV). Методы получения, химические свойства. Азотистая кислота, нитриты. Методы получения, химические свойства.
- •1. Ионизация комплексных соединений в растворах. Константы образования и нестойкости. Разрушение комплексных соединений.
- •2.Общая характеристика d-элементов группы I (медь, серебро, золото). Их со. Хим св-ва ме. Оксиды, гидроксиды, соли этих металлов.
- •1. Электродные потенциалы металлов. Факторы, определяющие положение металла в ряду стандартных электродных потенциалов.
- •2. Кислородосодержащие кислоты хлора. Методы получения. Закономерности в изменении кислотно-основных и окислительно-восстановительных свойств кислот
- •1.Природа связи в комплексных соединениях по методу вс. Геометрия комплексных ионов. Магнитные свойства.
- •2.Общая характеристика d-элементов II группы. Их оксиды, гидроксиды, соли, комплексные соед. Хим св-ва этих соединений.
- •1.Межмолекулярное взаимодействие (ориентационное, индукционное, дисперсионное) и их природа. Энергия межмолекулярного взаимодействия.
- •1.Ммо. Энергетические диаграммы гомоядерных молекул. Энергетические диаграммы для частиц: o2, f2, n2 (порядок, энергия, длина связи).
- •1.Ммо. Энергетические диаграммы гетероядерных молекул (no,hf). Понятие о несвязывающих мо.
- •2.Серная кислота. Методы получения. Хим св-ва.
Билет 11
1.Ионное произведение воды. Водородный и гидроксильный показатели. Буферные растворы: их состав, расчет рН.
Вода - очень слабый электролит.
Уравнение ионизации воды: Н2О+Н2О=Н3О++ОН-
K(H2O)= =1.8*10-16
=1.8*10-16
С(Н2О)=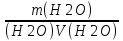
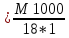 =55,55 моль/л.
=55,55 моль/л.
Подставив это значение в уравнение, получим: 1,8*10-16*55,55=С(Н+)*С(ОН-) или С(Н+)*С(ОН-)=10-14. (всё это при t= 22 C)
Произведение С(Н+)*С(ОН-) называется ионным произведением воды и обозначается Кw. Уравнение используется для вычисления концентраций С(Н+) и С(ОН-) в водных растворах.
Т.к
в чистой воде |H+|
= |OH-|,
то |H+|=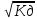 = 10-7
= 10-7
В растворах с ионной силой I>0.001 используют активности ионов водорода и гидроксид-иона. В этом случае Kw=а(Н+)*а(ОН-).рН=-lgС(Н+), где а()- активная концентрация ионов = с* гамма
Водородный и гидроксильный показатели:
Гидроксильный показатель рОН=-lgС(ОН-) – для слабых электролитов;
водородный показатель рН=-lgа(Н+), рОН=-lgа(ОН-) – для сильных электролитов.
Буферные растворы – это растворы, содержащие одноимённую кислоту и сопряжённое ей основание (обычно её соль) или слабое основание и сопряжённую ему кислоту.
1) Буферные растворы поддерживают постоянное значение рН при добавлении к ним небольших количеств кислот и оснований.
2) Буферные растворы сохраняют постоянное значение рН при разбавлении.
Ka= следовательно
с(H+)=
следовательно
с(H+)= .
.
pH=-lg
c(H+)=-lg Ka - lg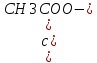
Учитывая,
что величина -lg
Ka=pKa,
a
-lg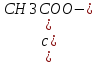 =lg
=lg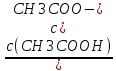
Окончательно
можно записать pH=
pKa(CH3COOH)+
lg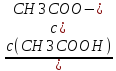
Или
для любого буфера pH=
pKa(кислоты)+
lg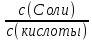
2.Соединения серы, селены, теллура со степенью окисления +4 (оксиды, гидроксиды, соли). Получение, кислотно-основные, окислительно-восстановительные свойства соединений.
SO2 – бесцв газ, с резким запахом, хорошо р-рим в воде. S+O2=SO2; 2ZnS+3O2=2ZnO+2SO2
Na2SO3(тв.)+H2SO4=Na2SO4+SO2+H2O (лаб)
При каталитическом (V2O5) окислении SO2 образуется триоксид серы: 2SO2+O2=2SO3
SO2+Cl2=SO2Cl2 образование сульфурилхлорида (свет, кат- С* или камфора)
Сернистая кислота и её соли могут проявлять св-ва вос-лей 2Na2SO3+O2=2Na2SO4 и ок-лей SO2+2H2S=3S+2H2O
При нагр сульфиты различных металлов разлагаются следующим образом:
4Na2SO3=Na2S+3Na2SO4
ZnSO3=ZnO+SO2
2Ag2SО3=4Ag+2SO2+O2
Гидросульфиты существуют только в р-рах, при кристаллизации происходит отщепление воды: 2NaHSO3=H2O+Na2S2O5
При восстановлении сульфитов можно получить дитиониты – соли дитионистой кислоты Na2S2O4: 2NaHSO3+Zn+H2SO3=Na2S2O4+ZnSO3+2H2O
Дитиониты устойчивы только в сухом виде, в присутствии воды легко окисляются: 2Na2S2O4+2H2O+O2=4NaHSO3
В щелочной среде Na2S2O4 – один из самых сильных восстановителей.
В отличие от диоксида серы, диоксиды селена и теллура можно получить не только сжиганием на воздухе простых веществ, но и окислением их азотной кислотой: 3Э+4HNO3=3ЭO2+4NO+2H2O
Диоксиды селена и теллура – кристаллич в-ва, а диоксид серы – газ. В ряду SO2, SeO2, TeO2 кислотные св-ва уменьш. Если SO2 и SeO2 хорошо р-римы в воде, и щелочах SeO2+H2O=H2SeO3, SeO2+2NaOH=Na2SeO3, то практически не р-римый в воде TeO2 взаимодействует с р-рами щелочей и сильных кислот: TeO2+2NaOH=Na2TeO3+H2O
TeO2+4HI=TeI4+2H2O
В ряду гидроксидов H2SO3, H2SeO3, H2TeO2 кислотные св-ва уменьш. Теллуристая к-та амфотерна. Селениты можно получать нейтрализацией растворов H2SeO3, а теллуриты растворением TeO2 в щелочах.
В отличие от соед S(IV) производные Se(IV) и Te(IV) проявляют в большей степени ок-ные свойства, чем восстановительные:
H2ЭО3+2H2SO3=2H2SO4+Э+H2O, где Э= Se, Te
H2SeO3+2SO2+H2O=2H2SO4+Se
Билет 12
1.Ок-ли и в-ли, часто применяемые в хим практике. Влияние pH, темп, конц реагентов и их природы на протекание ОВР.
Окислители: F2, O3, KMnO4, K2FeO4, KBiO3, HNO3, H2SO4, PbO2, Sb2O5
Восстановители: K, Na, Al, Zn, Cu, в-ва, включающие в свой состав элементы в низших СО: S2-, Se2-, I-, Br-, NaH, B2H6, SiH4
ОВ двойственность Cl2, Br2, H2, P, S, Fe2+, Cu+, Bi3+, NO2-, ClO-, H3PO3, NO, SO2, N2H4
Влияние концентраций: При протекании ОВР концентрации исходных веществ падают, а продуктов реакции - возрастают. Это приводит к изменению величин потенциалов обеих полуреакций: электродный потенциал окислителя падает, а электродный потенциал восстановителя возрастает. Когда потенциалы обоих процессов становятся равными друг другу, реакция заканчивается - наступает состояние химического равновесия.
Влияние pH: Величина pH влияет на потенциалы Е (электродный потенциал - разность электростатич. потенциалов между электродом и находящимся с ним в контакте электролитом)
и направление протекания окислительно-восстановительной реакции тогда, когда в реакции принимают участие ионы водорода
Пример,
где не влияет:
2Fe2++2I-=2Fe2++I2
ионы
водорода участия не принимают; потенциал
реакции не зависит от активности ионов
водорода:
![]() Влияет:
Влияет:
![]() (п=2)
непосредственно
участвуют ионы водорода, поэтому
потенциал этой реакции
(п=2)
непосредственно
участвуют ионы водорода, поэтому
потенциал этой реакции
![]() Также
рH
может оказывать влияние на ов реакцию,
в которой ион вородорода не принимает
участия. Например, в цериметрии, в основе
которой лежит полуреакция без участия
ионов водорода Се4++е
Также
рH
может оказывать влияние на ов реакцию,
в которой ион вородорода не принимает
участия. Например, в цериметрии, в основе
которой лежит полуреакция без участия
ионов водорода Се4++е![]() =Се3+
определение
восстановителей ведут в сернокислой
среде, поскольку именно в этой среде
устойчив церий (IV) в форме сульфатных
комплексов.
=Се3+
определение
восстановителей ведут в сернокислой
среде, поскольку именно в этой среде
устойчив церий (IV) в форме сульфатных
комплексов.
Влияние
температуры из уравнения Нернста
![]() видно, что электродный потенциал также
зависит от температуры.
видно, что электродный потенциал также
зависит от температуры.
