
- •Охарактеризуйте наиболее важные биологические функции воды. Как эти функции связаны со строением молекулы воды?
- •Что такое рН растворов? Раскройте значение этого показателя для живых организмов.
- •Механизм действия буферных растворов.
- •Элементы-органогены. Влияние органогенов на свойства биогенных соединений.
- •4.Основные виды атомных группировок в составе биогенных соединений.
- •Биохимические функции минеральных субстратов. Макро- и микроэлементы.
- •Биологические функции и особенности строения аминокислот.
- •Биологические функции и роль пептидов.
- •Уровни организации белковых молекул. Механизм денатурации и ренатурации.
- •Изоэлектрическая точка и изоэлектрическое состояние аминокислот и белков. Физико-химические свойства аминокислот и белков.
- •Денатурация и факторы ее вызывающие.
- •Общие и отличительные свойства неорганического катализатора и фермента.
- •Чем обусловлена специфичность ферментов? Виды специфичности.
- •Методы определения и способы выражения активности ферментов.
- •Клиническое значение определения активности ферментов в биологических жидкостях.
- •Механизм ферментного катализа.
- •Биологические функции активного и аллостерического центров фермента.
- •Активаторы и ингибиторы ферментов, их биологическая роль.
- •Способы регулирования активности ферментов.
- •Мультиферментные комплексы, проферменты, изоферменты и их биохимическое значение.
- •Классификация и номенклатура ферментов.
- •Витамины – как предшественники коферментов.
- •Витамины группы в и их биохимические функции.
- •Строение и биохимические функции витамина а.
- •Строение и биохимические функции витамина д.
- •Строение и биохимические функции витамина е.
- •Строение и биохимические функции витамина к.
- •29. Роль гормонов в регуляции метаболизма. Классификация гормонов по химическому строению и биологическим функциям.
- •30. Строение, механизм синтеза и биологическая роль эйкозаноидов.
- •31. Биохимическая роль вторичных мессенджеров при передаче гормонального сигнала.
- •32. Механизм действия и передачи сигнала гормонов стероидной природы.
- •33. Механизм действия и передачи сигнала гормонов аминокислотной и белковой природы
-
Активаторы и ингибиторы ферментов, их биологическая роль.
Регуляция активности ферментов может осуществляться путём взаимодействия ферментов с различными биологическими компонентами или чужеродными соединениями, которые называются регуляторами ферментов. Они могут либо ускорять, либо замедлять ферментативную реакцию.
Активаторы – это вещества, увеличивающие скорость ферментативной реакции.
Виды активаторов:
1. Вещества, влияющие на область активного центра. К ним относятся ионы металлов (Na+, K+, Fe2+, Co2+, Cu2+, Ca2+, Zn2+, Mg2+, Mn2+ и др.). В ряде случаев ионы металлов выполняют функцию кофактора фермента. В других случаях они способствуют присоединению субстрата к активному центру фермента. Ионы металлов оказываются активаторами только в условиях дефицита их в организме.
2. Аллостерические эффекторы, которые связываются с аллостерическим (регуляторным) участком апофермента. Это связывание вызывает конформационные изменения в молекуле белка, приводящие к изменению структуры активного центра, что сказывается на связывании и превращении субстрата в активном центре. При этом активность фермента либо увеличивается (это аллостерические активаторы), либо уменьшается (это аллостерические ингибиторы). Аллостерическими эффекторами ферментов наиболее часто выступают различные метаболиты, а также гормоны, ионы металлов, нуклеозиды - АТФ, АДФ, АМФ.
3. Вещества, вызывающие модификации, не затрагивающие активный центр фермента.
- активация путём присоединения специфической модифицирующей группы к молекуле фермента.
- активация путём перехода неактивного предшественника - профермента в активный фермент за счёт частичного протеолиза.
- активатор вызывает диссоциацию субъединиц фермента, имеющего четвертичную структуру.
Ингибиторы ферментов - это вещества, замедляющие ферментативные реакции.
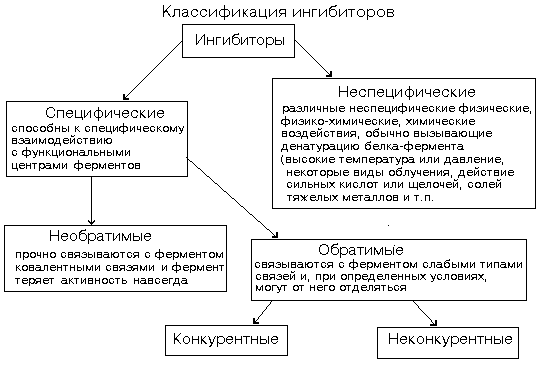
Конкурентное ингибирование. Ингибитор похож на субстрат фермента по своей структуре и соперничает с субстратом за активный центр (садится на активный центр фермента), что приводит к уменьшению связывания субстрата с ферментом и нарушению катализа. В этом состоит особенность конкурентного ингибирования – возможность усилить или ослабить ингибирование через изменение концентрации субстрата.
Неконкурентное ингибирование. Ингибитор не имеет структурного сходства с субстратом и присоединяется не в активном центре, а в другом месте молекулы, одновременно с субстратом. Образуется тройной комплекс: субстрат - фермент - ингибитор. Это ведет к деформации активного центра и каталитической активности. Например, синильная кислота (цианиды) связывается с гемовым железом ферментов дыхательной цепи и блокирует клеточное дыхание.
Многие лекарственные препараты действуют по типу конкурентного ингибитора. Примером является применение СУЛЬФАНИЛА (СА). При различных инфекционных заболеваниях, которые вызываются бактериями, применяются СА препараты. Введение СА приводит к ИНГИБИРОВАНИЮ фермента бактерий, которые синтезируют ФОЛИЕВУЮ кислоту. Нарушение синтеза этой кислоты проводит к нарушению роста микроорганизмов и их гибели.
В качестве неконкурентного ингибитора выступают ЦИАНИДЫ. Они прочно связываются с ионами железа ЦИТОХРОМОКСИДАЗЫ. Этот фермент является одним из компонентов дыхательной цепи. Блокирование дыхательной цепи приводит к мгновенной гибели организма. Действие можно снять только с помощью РЕАКТИВАТОРОВ.
