
- •Охарактеризуйте наиболее важные биологические функции воды. Как эти функции связаны со строением молекулы воды?
- •Что такое рН растворов? Раскройте значение этого показателя для живых организмов.
- •Механизм действия буферных растворов.
- •Элементы-органогены. Влияние органогенов на свойства биогенных соединений.
- •4.Основные виды атомных группировок в составе биогенных соединений.
- •Биохимические функции минеральных субстратов. Макро- и микроэлементы.
- •Биологические функции и особенности строения аминокислот.
- •Биологические функции и роль пептидов.
- •Уровни организации белковых молекул. Механизм денатурации и ренатурации.
- •Изоэлектрическая точка и изоэлектрическое состояние аминокислот и белков. Физико-химические свойства аминокислот и белков.
- •Денатурация и факторы ее вызывающие.
- •Общие и отличительные свойства неорганического катализатора и фермента.
- •Чем обусловлена специфичность ферментов? Виды специфичности.
- •Методы определения и способы выражения активности ферментов.
- •Клиническое значение определения активности ферментов в биологических жидкостях.
- •Механизм ферментного катализа.
- •Биологические функции активного и аллостерического центров фермента.
- •Активаторы и ингибиторы ферментов, их биологическая роль.
- •Способы регулирования активности ферментов.
- •Мультиферментные комплексы, проферменты, изоферменты и их биохимическое значение.
- •Классификация и номенклатура ферментов.
- •Витамины – как предшественники коферментов.
- •Витамины группы в и их биохимические функции.
- •Строение и биохимические функции витамина а.
- •Строение и биохимические функции витамина д.
- •Строение и биохимические функции витамина е.
- •Строение и биохимические функции витамина к.
- •29. Роль гормонов в регуляции метаболизма. Классификация гормонов по химическому строению и биологическим функциям.
- •30. Строение, механизм синтеза и биологическая роль эйкозаноидов.
- •31. Биохимическая роль вторичных мессенджеров при передаче гормонального сигнала.
- •32. Механизм действия и передачи сигнала гормонов стероидной природы.
- •33. Механизм действия и передачи сигнала гормонов аминокислотной и белковой природы
-
Клиническое значение определения активности ферментов в биологических жидкостях.
Оптимальная температура для активности ферментов составляет обычно 40-50°С. При более низкой температуре скорость ферментативной реакции, как правило, снижается, а при 0°С функционирование ферментов прекращается. При превышении оптимальной температуры скорость реакции снижается, а затем реакция полностью прекращается вследствие постепенной денатурации белков и инактивации. Отдельные ферменты различаются по оптимальному для их действия значению рН. Многие ферменты наиболее активны при величине рН, близкой к нейтральной (рН около 7,0), но ряд ферментов имеет оптимум рН вне этой области. Так, пепсин наиболее активен в сильнокислой среде (рН 1,0-2,0), а трипсин - в слабощелочной (рН 8,0-9,0).
Существенное влияние на активность ферментов оказывает наличие в среде определенных химических веществ: активаторов, повышающих активность ферментов, и ингибиторов, подавляющих ее. Часто одно и то же вещество служит активатором одних ферментов и ингибитором других. Ингибирование ферментов может быть обратимым и необратимым. Определяемая в норме активность ферментов в сыворотке крови есть результат сбалансированности скорости, с которой ферменты синтезируются внутри клеток и выходят из них, со скоростью удаления ферментов из внеклеточной жидкости путем инактивации и разрушения и их экскреции.
При различных заболеваниях наблюдается изменение активности ферментов в биологических жидкостях. Это может быть обусловлено рядом причин. Повышение активности может быть результатом ускорения процессов синтеза (например, щелочная фосфатаза при рахите, гепатите), некроза клеток (например, креатинкиназа, аспарагиновая трансаминаза при инфаркте миокарда), понижения выведения (например, щелочная фосфатаза при закупорке желчных путей), повышения проницаемости клеточных мембран (например, аспарагиновая трансаминаза, аланинаминотрансфераза при вирусном гепатите).
-
Строение ферментов. Ферменты простые и сложные. Биологическое значение апофермента и кофермента.
По строению ферменты делятся на простые (однокомпонентные) и сложные (двукомпонентные). Простые ферменты состоят только из аминокислот – например, пепсин , трипсин, лизоцим.
Сложные ферменты (холоферменты) имеют в своем составе белковую часть, состоящую из аминокислот – апофермент, и небелковую часть – кофактор. Кофактор, в свою очередь, может называться коферментом или простетической группой. Примером могут быть сукцинатдегидрогеназа (содержит ФАД) (в цикле трикарбоновых кислот), аминотрансферазы (содержат пиридоксальфосфат), пероксидаза (содержит гем).
Простой состоит только из белковой части, сложный (холофермент) – из белковой и небелковой частей. Белковая часть – апофермент, небелковая – кофермент. Отдельно апофермент и кофермент не обладают каталитической активностью. Участок на поверхности молекулы фермента, который взаимодействует с молекулой субстрата – активный центр.
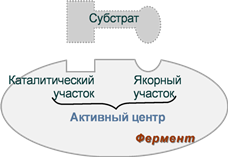
Апофермент - Это белки, имеющие третичную и даже четвертичную структуры. Первый вариант представлен глобулой. Если же апофермент обладает четвертичной структурой, то следовательно, состоит из нескольких одинаковых или разных субъединиц. Аналоги объединяются в мультимер, обладающий максимальной активностью. Выполняет следующие функции:
1) Обеспечивает определённую локализацию фермента в клетке.
2) Определяет специфичность действия фермента.
3) Его поверхностные группировки за счёт лигандности отвечают за работу аллостерического центра энзима.
4) На нём формируется активный центр фермента.
5) Благодаря своеобразной конформации определяет тип химической реакции.
Сложные ферменты – это по сути сложные белки, содержащие, кроме, полипептидной цепи, небелковый компонент.
Белковая часть сложного фермента получила название апофермента, небелковая часть – кофактора. Кофактор, который легко отделяется от апофермента и способен к самостоятельному существованию, называется коферментом.
Все коферменты делят на две большие группы: витаминные и невитаминные.
1.Коферменты витаминной природы– производные витаминов или химические модификации витаминов.
2.Коферменты невитаминной природы – вещества, которые образуются в процессе метаболизма.
Коферменты относятся к сложным органическим веществам, их молекулы значительно меньше по размеру, чем молекулы ферментов. Коферменты могут проникать через биологические мембраны, нагревание обычно не вызывает изменения их структуры.
Кофермент, локализуясь в каталитическом участке активного центра фермента, принимает непосредственное участие в химической реакции, выступая в качестве акцептора и донора химических группировок, атомов, электронов. В ходе реакции кофермент претерпевает химические превращения, в точности противоположные тем, которые происходят в субстрате. Например, в окислительно-восстановительных реакциях молекула субстрата окисляется, а молекула кофермента восстанавливается. При последующих сопряжённых реакциях изменения в коферменте протекают в обратном направлении и он воспроизводится в первоначальной форме.
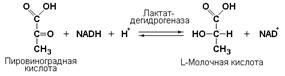
Таким образом, кофермент является одним из субстратов ферментативной реакции, т.е. выступает как косубстрат.
