
- •Билет 1.
- •1. Активность, коэффициент активности и способы их определения. Ограниченная и полная взаимная растворимость компонентов в различных фазовых состояниях. Диаграммы состояния.
- •2. Соли. Соли кислородсодержащих и бескислородных кислот. Склонность элементов к вхождение в состав солей в катионной и анионной формах в зависимости от природы элемента и степени окисления.
- •3. Сложные эфиры. Реакции этерификации и гидролиза сложных эфиров, их механизм. Жиры, их состав. Гидрирование и гидролиз жиров.
- •Билет №2
- •1. Ковалентная связь. Квантово-химическая трактовка природы химических связей и строения молекулы. Химическая связь в молекуле водорода.
- •2. Хроматография. Принципы хроматографического разделения. Параметры хроматограмм. Газовая, жидкостная и сверхкритическая флюидная хроматография.
- •ГомоПк.
- •Билет №3.
- •1. Основные положения теорий валентных связей и молекулярных орбиталей. Их сравнительные возможности.
- •2. Электроанализ: потенциометрия, вольтамперометрия, кулонометрия.
- •3. Радикальная, катионная, анионная полимеризация.
- •Билет 4.
- •1.Концепция гибридизации атомных орбиталей. Концепция отталкивания электронных пар. Простанственная конфигурация молекул и ионов.
- •2. Простые вещества, образуемые р-элементами. Аллотропия и полиморфизм. Химические свойства галогенов, кислорода, озона, халькогенов, азота, фосфора, углерода, кремния.
- •3. Нитросоединения. Способы получения и важнейшие свойства.
- •Билет 5
- •1. Нефть, её состав и переработка. Особенности строения и химический состав циклоалканов.
- •2. Спектральные методы анализа и исследования, люминесцентный, эпр- и ямр-спектроскопия.
- •3. Количественные характеристики химической связи: порядок, энергия, длина, степень ионности, дипольный момент, валентный угол.
- •Билет №6.
- •1. Трактовка ионной связи на основе электростатических представлений.
- •2. Оптические методы анализа. Атомно-эмиссионный, атомно-абсорбционный и молекулярно-абсорбционный анализ, реагенты и реакции в фотометрическом анализе. Экстракционно-фотометрический анализ.
- •3. Алкены, методы синтеза и общие представленияо реакционной способности. Присоединение электрофильных реагентов реагентов по двойной связи.
- •Билет №7
- •1. Типы координационной связи (особенности химической связи в комплексных соединениях). Донорно-акцепторный и дативный механизм ее образования.
- •2. Основные различия между нмс и вмс.
- •3. Сульфидный, кислотно-щелочной, аммиачно-фосфатный методы разделения катионов.
- •Билет № 8.
- •1. Метод валентных связей и его недостатки в применении к координационным соединениям. Теория кристаллического поля и мо в применении к комплексным соединениям.
- •2. Экстракционные и сорбционные методы разделения и концентрирования. Факторы, определяющие межфазный перенос компонентов в экстракции и сорбционных системах.
- •Билет №9
- •1. Методы исследования и способы описания геометрических параметров молекулы. Симметрия молекул. Основные виды изомерии молекул и принципы динамической стереохимии
- •2. Простые и комплексные соли. Кристаллогидраты. Гидролиз солей.
- •3. Алкадиены. Сопряженные диены, особенности их строения и свойств. Каучуки.
- •Билет 10.
- •1.Силы Ван-дер-Ваальса. Водородная связь.
- •2. Титриметрия. Кислотно-основное, комплексонометрическое и электрохимическое титрование. Кривые титрования. Индикаторы.
- •3. Алкины. Методы синтеза и важнейшие свойства алкинов. Ацетилен.
- •Билет 11
- •1. Энергетические параметры молекул. Понятие об энергии образования молекул. Энергетические состояния: вращательные, электронные и колебательные спектры молекул.
- •3. Ароматические углеводороды. Промышленное источники аренов, их химические свойства и применение. Механизм и закономерности реакций электрофильного замещения в ароматическом ядре.
- •Билет 12
- •1. Магнитные свойства молекул. Спектры электронного парамагнитного резонанса и ямр спектры. Принципы и возможности исследования структуры и свойств молекул.
- •4. Активация галогенпроизводных и генерация карбокатионов.
- •Билет 13
- •1. Основы тд анализа хим процессов. Постулаты и законы хим тд. Функция состояния: температура, внутр энергия, энтальпия, энтропия, энергии Гиббса и Гельмгольца.
- •2. Особенности свойств р-элементов II и V периодов.
- •3. Спирты и фенолы. Методы получения и сравнительная характеристика хим св-в. Этиленгликоль. Глицерин. Лавсан.
- •14 Билет
- •1.Условия равновесия и критерии самопроизвольного протекания процессов, выраженные через характеристические функции.
- •3.Особенности реакционной способности арилгалогенидов. Получение литий- и магнийорганических соединений, их применение в органическом синтезе.
- •Билет №15
- •1. Энергетика химических реакций, основные законы термохимии и термохимические расчеты.
- •2. Особенности изменения химических свойств d-элементов по группам и периодам по сравнению с p-элементами. Образование катионных и анионных форм, комплексообразование.
- •3. Фенолформальдегидные смолы. Простые эфиры. Методы синтеза и свойства. Диэтиловый эфир.
- •Билет 16
- •2. Гидриды. Типы гидридов: солеобразные, полимерные, летучие, гидриды внедрения. Типичные примеры и общая характеристика свойств каждой группы гидридов. Гидрокомплексы.
- •3. Правило Марковникова и его интерпретация. Реакция по аллильному положению.
- •Билет 17
- •1. Основные типы химической связи: ковалентная, ионная, металлическая. Многоцентровая, σ и π-связи
- •2. Гравиметрия. Варианты гравиметрии: осаждение, отгонка, выделение. Термогравиметрия. Реагенты-осадители: минеральные, органические.
- •3. Альдегиды и кетоны. Методы получения представителей, их свойства
- •Билет 18
- •1. Коллоидное состояние вещества. Особенности свойств дисперсных систем и их классификация. Получение и молекулярно-кинетические свойства дисперсных систем, их устойчивость.
- •2. Гидроксиды. Типы гидроксидов: гидроксиды с ионной, молекулярной, полимерной структурой.
- •3. Енолизация альдегидов и кетонов. Альдольная конденсация и родственные процессы. Реакции альдегидов и кетонов с гетероатомными нуклеофилами. Альфа-бета-непредельные карбинильные соединения.
- •Билет 19
- •2. Периодичность изменения хим св-в э-тов и образуемых ими соединений. Валентность и степень окисления.
- •3. Углеводы. Важнейшие представители моносахаридов, их строение и важнейшие свойства. Дисахариды и полисахариды, сахароза, крахмал, целлюлоза.
- •-Рибоза -дезоксирибоза Рибоза и дезоксирибоза входят в сотав рнк и днк соответственно. Основные реакции моносахаридов, продукты реакций и их свойства
- •Билет №20
- •1. Влияние температуры на скорость химической реакции. Уравнение Аррениуса, понятие об энергии активации и методах ее определения.
- •3. Карбоновые кислоты и их производные. Методы синтеза, взаимные превращения.
- •Билет №21.
- •3. Углеводороды. Алканы. Конформационная изомерия. Важнейшие свободнорадикальные реакции алканов.
- •Билет 22
- •1. Понятие о катализе и катализаторах. Гомогенный и гетерогенный катализ. Энергетические профили каталитических реакций. Основы теории гетерогенного катализа.
- •2. Комплексные соединения. Типичные комплексообразователи и лиганды. Пространственная конфигурация комплексных ионов. Особенности диссоциации комплексных соединений в растворе. Карбонилы металлов.
- •3. Амины. Типы аминов и их свойства. Особенности свойств ароматических аминов. Реакция диазотирования и её значение в органическом синтезе.
- •Билет 23
- •2. Радиоактивационный анализ. Масс-спектральный анализ. Рентгеновская фотоэлектронная спектроскопия. Инфракрасная спектроскопия.
- •3. Гетероциклические соединения, общие принципы их классификации. Важнейшие пятичленные и шестичленные, гетероароматические соединения с одним гетероатомом. Особенности их химических свойств.
- •Билет №24
- •1.Равновесные электродные процессы. Понятие о скачке потенциала на границе раздела фаз. Электрохимический потенциал. Образование и строение двойного электрического слоя.
- •2. Оксиды. Типы оксидов: оксиды с ионной, молекулярной и полимерной структурой.
- •Билет 25
- •3. Декструкция высокомолекулярных соединений. Сшивание высокомолекулярных соединений. Синтез и свойства привитых сополимеров.
2. Экстракционные и сорбционные методы разделения и концентрирования. Факторы, определяющие межфазный перенос компонентов в экстракции и сорбционных системах.
Экстракция – физ-хим процесс распределения в-ва между двумя фазами, чаще между двумя несмешивающимися жидкостями (обычно вода и органический растворитель) и соответствующий метод выделения, разделения и концентрирования вещества.
Второй фазой фазой может быть расплав какого-либо орг. в-ва (нафталин, дифенил, бензохинон) содержащий органический реагент, например 8-оксихинолин. После распределения в-ва фазы охлаждают, расплав застывает и его отделяют от водной фазы.
При экстракции протекают процессы: обр-е экстрагируемых соед.; распределение экстрагируемых соединений между водной и органической фазами; реакций в органической фазе (диссоциация, ассоциация, полимеризация).
Соединения (обычно в органической фазе), ответственное за образование экстрагируемых экстрагируемого соединения, наз. экстрагентом. Инертные орг. Растворители, такие как хлороформ. Тетрахлорид углерода, бензол, применяемые для улучшения физических и экстракционных св-в экстрагента, называется разбавителями. Органическую фазу, отделенную от водной фазы и содержащую экстрагируемое соединение, называют экстрактом. Перевод в-ва из орг. фазы в водную – реэкстракция, а р-р для реэкстракции – реэкстрагентом.
Условия экстракции:
Чтобы ион Ме и др. заряженные частицы перешли в органическую фазу надо нейтрализовать заряд. Ионы Ме можно связать в незаряженные комплексы; комплексы с зарядом можно экстрагировать в виде ионных ассоциатов.
Экстракция возможна, если растворимость экстрагирующегося соединения в органическом растворителе выше, чем в воде; чем ↑ энергия гидратации, тем ↑ степень извлечения.
Чтобы лучше соединение растворялось в орг. растворителе, надо обеспечить его гидрофобность, чтобы не было гидрофильных групп (-SO3H, -COOH, -OH) и внешняя орг-я часть хелата должна быть достаточно объемистой и могла блокировать гидрофильную часть молекулы.
С ↑ размера молекул экстрагирующегося соединения степень извлечения обычно ↑, т.к. крупные молекулы сильнее нарушают структуру воды.
Экстракция протекает лучше, если есть «сольватация» молекулами экстрагента.
Экстракция ↓ с ↑ заряда и ↓ размера ионов. Лучше однозарядные ионы.
Более устойчивые комплексы экстрагируются лучше.
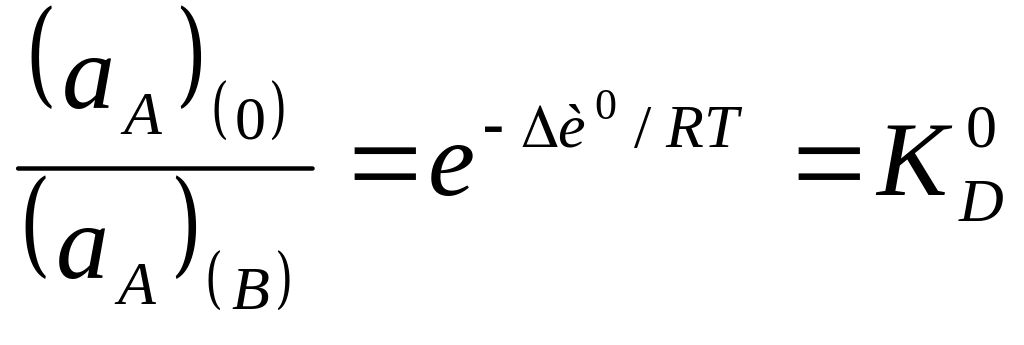 -
константа распределения.
-
константа распределения.
Закон распределения Нернста
![]() -
реальная константа.
-
реальная константа.
Р – коэффициент распределения, зависит от условий распределения и не зависит от V фаз. Экстракция – процесс массопереноса. Скорость определяется самой медленной реакцией или скоростью образования экстракционных соединений (хим. реакция), либо скоростью переноса различных соединений из одной фазы в другую (массоперенос), или экстракция осуществляется в смешанном режиме (скорости сравнимы).
Наиболее широко экстракцию используют для разделения смесей элементов. Применяют избирательные экстрагенты. Например, S-содержащие экстрагенты (дитизон) извлекают элементы, проявляющие сродство к донорным атомам серы (Сu, Ni, Co, Hg, Pb, Bi) и не экстрагируют Mg, Al, редкоземельные элементы, цирконий и т.д. Для улушения разделения экстракцию проводят в присутствии маскирующих в-в.
Для комплексов:
mMI(B)n+ + nMIILm(0)↔mMILn(0) + nMII(B)m+

Если
![]() >>
>>
![]() ,
то ион Ме МIn+
вытесняет ион Ме МIIм+.
,
то ион Ме МIn+
вытесняет ион Ме МIIм+.
Снижение предела обнаружения микрокомпонентов, удаление макрокомпонентов, разделение микрокомпонентов – концентрирование.
Применяют хелатообразующие реагенты (дитизон, 8-оксихинолин). Обычно хелатообр. агенты извлекают несколько элементов (групповое концентрирование).
Классификация экстракционных процессов.
Процессы по типу используемого экстрагента можно разделить на 3 группы:
хелатообразующие, карбоновые и нафтеновые к-ты, фосфорорганические к-ты, сульфокислоты;
соли трет-аминов, соли четвертичных аммониевых оснований;
эфиры, кетоны, фосфаты, сульфиды, сульфоксиды.
Классификация экстрагирующихся соединений по типу:
Неионизированные (однородно- и смешаннолигандные комплексы) и ионные ассоциаты.
Способы осуществления экстракции:
Периодическая
– экстракция из водной фазы отдельными
порциями свежего экстрагента.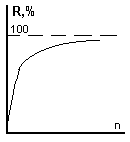
Степень
извлечения

Степень
извлечения после n-кратной
экстракции
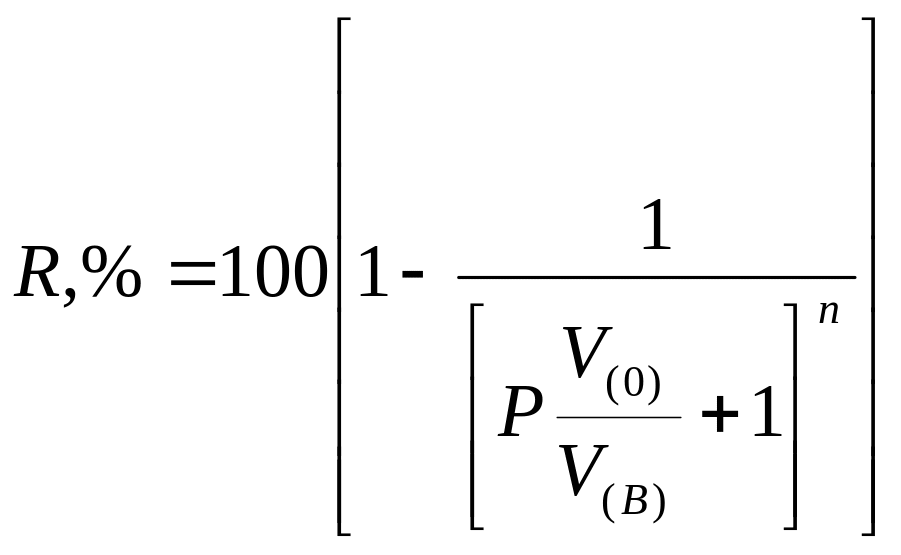 .
.
Непрерывная экстракция – непрерывное и относительное перемещение 2-х фаз; одна (обычно водная) неподвижна.
Противоточная – верхняя (органическая) фаза переносится последовательно через серию экстракционных трубок и в каждой из них контактирует со свежими порциями нижней водной фазы до устойчивого равновесия. Процесс повторяется n раз.
Применяют для разделения сложных смесей, и для выделения малых количеств из больших V.
Сорбция.
Наиболее высокие значения коэффициента концентрирования достигается при определении микрокомпонентов непосредственно в фазе сорбента с использованием атомно-эмиссионного, атомно-адсорбционного, атомно-флуорисцентного и рентгенофлуорисцентного методов.
Сорбция – процесс поглощения газов, паров и растворенных в-в твердыми или жидкими поглотителями на твердом носителе (сорбентами).
Классификация методов основана на различии механизмов взаимодействия в-в с сорбентами.
Различают: адсорбцию (физическая и хемосорбция);
Распределение в-в между двумя несмешивающимися фазами (растворитель и жидкая фаза на сорбент) и капиллярную конденсацию – образование жидкой фазы в парах и капиллярах тв. сорбента при поглощении паров в-ва. Обычно наблюдается смешанные механизмы.
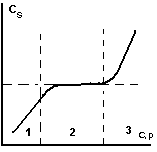
1 – уравнение Генри;
2 – уравнение Фрейндлиха и Лэнгмюра;
3 – уравнение Брунауэра-Эммета-Теллера;
CS – сорбированное в-во.
1. Генри CS=ac или CS=a’p. a и а’ – постоянные. Наблюдается постоянство коэффициента распределения.
2. эмпирический коэффициент распределения становится зависимым от равновесной концентрации сорбируемого в-ва,
Лэнгмюр
![]() или
или
![]() .
.
Ионообменники. Синтетические органические ионообменники представляют собой продукты полимеризации и поликонденсации непредельных орг.соединений, содержащие кислотные (-SO3H, -COOH, -OH, -PO3H2) или основные (-N+(CH3)3, -N+H3, =NH2+) группы.
Ионообменники с кислотными группами – катионообменники, с основными группами – анионообменники.
Хелатообразующие сорбенты – сшитые полимеры трехмерной структуры, обладающие комплексообразующими или одновременно ионообменными и комплексообразующими св-ми, обусловленные наличием функционально-аналитических групп, входящих в состав полимера.
Кремнезем – это диоксид кремния во всех его формах: кристаллический, аморфный, гидратированный. Универсальный – аморфные пористые кремнеземы, т.к. характеристики можно изменять в широком интервале.
Аэросилы – безводные, аморфные частицы кремнезема, полученные при высокой температуре.
Аэросилогели – чистая и геометрическая однородная форма пористого кремнезема.
Силикогели – сухие гели поликремниевой кислоты.
Пористые стекла – особая форма пористого кремнезема.
Неорганические сорбенты. (оксиды, гидроксиды, сульфиды, фосфаты, алюмосиликаты и т.д.)
Сорбция определяется как дисперсионными, так и электростатическими силами, сопровождающимися протеканием ионообменных реакций, образованием химических соединений с ионами матрицы и фазовыми превращениями. Высокая селективность.
При сорбции воды, спиртов, кетонов, аминов. На сорбентах, поверхность которых гидрокси- и оксигруппами (кремнезем, оксид Al), в дополнению к неспецифичным (дисперсионным и электростатическим) взаимодействиям происходит образование комплексов с межмолекулярной водородной связью. В этом случае может осуществляться смешанный механизм.
Хемосорбция. Сорбция сопровождается возникновением между сорбирующимися соединениями и поверхностью прочной химической связи и образованием нового химического соединения на поверхности такой механизм осуществляется на природных и синтетических сорбентах с ионогенными и хелатообразующими группами.
Хемосорбция обратима не полностью. Использование синтетических сорбентов с ионогенными и хетообразующими группами наиболее эффективно, и ИК широко применяют для селективного раделения макро- и микрокомпонентов и для группового и селективного концентрирования микрокомпонентов.
Основные количественные характеристики сорбции, как и экстракции, - коэффициент распределения и степень извлечения. Так, коэффициент распределения представляет собой отношение концентрации в-ва Ств в фазе сорбента к концентрации СВ его в водной фазе: D=Ств/СВ. Процесс сорбции осуществляется 2-мя методами:
Статическим и динамическим (хроматография)
Активные угли: Получают при действии на неактивные угли паров Н2О или СО2 при 850-950 0С. При этом часть угля выгорает и получается активный уголь, пронизанный тонкими порами с радиусом менее 1 нм. Поверхность покрыта оксидныим группами.
Для описания процессов адсорбции на неоднородных поверхностях при образовании мономолекулярного слоя – уравнения Фрейндлиха СS=ZCn или CS=Z/pn.
Z, Z/ и n – постоянные.
Для полимерных слоев – Брунауэр-Эммет-Теллер:
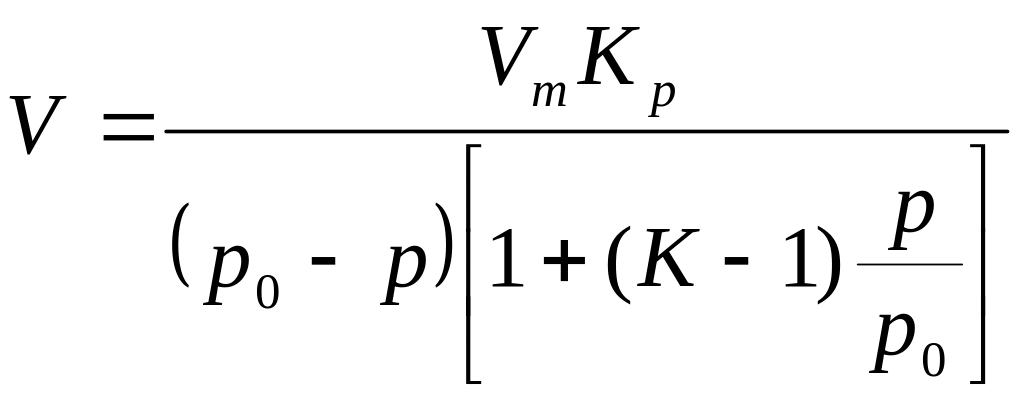 .
.
V – объем газа, сорбируемого при давлении р.
Vm – объем газа, собственного мономолекулярного слоя.
К – постоянная, характерная для данного в-ва; р0 – давление пара сорбируемого вещества.
Физадсорбция. Взаимодействие молекул сорбирующихся в-в с поверхностью сорента определяется главным образом дисперсионными силами, вызываемыми согласованным движением электронов в сближающихся молекулах.
Такой механизм характерен для сорбции на активных углях.
Для некоторых сорбентов, например кремнеземов, оксида Al, цеолитов, имеют значение электростатические силы: ориентационные силы, проявляющиеся при адсорбции полярных молекул на поверхности, несущей постоянный электростатический заряд, и индукционные силы, обусловленные появлением в сорбирующихся молекулах дипольных моментов, наведенных зарядами поверхности или появлением дипольных моментов молекул. Физическая адсорбция легко обратима.
Нет 3-го вопроса.
